大載體轉染豬胎兒成纖維細胞的電轉條件優化
鐘翠麗,李國玲,王豪強,莫健新,全絨,張獻偉,李紫聰,吳珍芳,,顧婷,蔡更元,
?
大載體轉染豬胎兒成纖維細胞的電轉條件優化
鐘翠麗1,李國玲1,王豪強1,莫健新1,全絨1,張獻偉2,李紫聰1,吳珍芳1,2,顧婷1,蔡更元1,2
(1華南農業大學動物科學學院/國家生豬種業工程研究中心,廣州 510642;2溫氏食品集團股份有限公司,廣東新興 527400)
【背景】隨著生物技術發展,研究的生理機制和生物功能日益復雜,提高大載體的轉染效率對多基因共表達系統、基因編輯技術、轉基因育種等具有重要的意義。在轉基因育種中,使用的轉基因載體相對較大,而且轉基因動物的制備效率也與供體細胞豬胎兒成纖維(porcine Fetal Fibroblasts,PFFs)細胞的轉染效率有關。【目的】研究主要從轉染參數、質粒用量和拓撲結構三方面,比較3種電轉儀ECM?830/NEPA 21/NucleofectorTM2b的大載體轉染效率,以探索大載體轉染PFFs的最佳條件。【方法】使用3種不同電轉儀將長達26 kb的攜帶增強型綠熒光蛋白基因的pPXAT-EGFP質粒轉染1×106個PFFs,48 h后使用流式細胞儀測定熒光細胞比例,從電轉參數、質粒用量和拓撲結構三方面分別比較瞬時轉染效率。【結果】首先比較電轉儀不同參數的轉染效率,結果顯示當電轉參數為脈沖電壓300 V,脈沖長度1 ms,脈沖間隔50 ms,脈沖次數3次,NEPA 21轉染PFFs的效率最高,為13.24%±1.63%,而NucleofectorTM2b的最佳電轉參數為U-023,其轉染效率高達46.36%±3.95%。然后在最佳電轉參數下分別比較6、8、10和12 μg的26 kb超螺旋質粒的轉染效率,ECM?830和NucleofectorTM2b轉染PFFs的最佳質粒用量為12 μg,其轉染效率分別為8.44%±0.90%(電轉參數:脈沖電壓300 V,脈沖長度1 ms,脈沖次數3 次)和14.63%±3.21%(電轉參數:U-023),而NEPA 21使用10 μg質粒轉染PFFs時效率達到最高(6.09%±0.72%)。最后比較不同質粒拓撲結構的轉染效率,結果顯示線性化質粒的轉染效率較低,僅為超螺旋質粒轉染效率的34.96%—48.39%。【結論】因此NucleofectorTM2b轉染PFFs的最佳條件為:U-023程序、12 μg超螺旋質粒;NEPA 21為:脈沖電壓200 V,脈沖長度3 ms,脈沖間隔50 ms,脈沖次數3次、10 μg超螺旋質粒;ECM?830則在脈沖電壓300 V,脈沖長度1 ms,脈沖次數3 次條件下轉染12 μg超螺旋質粒可獲得最佳轉染效率。綜合比較上述3種電轉儀,26 kb大載體轉染PFFs的最佳電轉儀是NucleofectorTM2b。
電轉染;大載體;豬胎兒成纖維細胞;ECM?830;NEPA 21;NucleofectorTM2b
0 引言
【研究意義】為滿足日益復雜的生物研究需求,運用的載體分子量越來越大(如本試驗所用到26 kb載體),其主要原因有以下兩點:(1)載體中兩側同源臂較大:運用同源重組的原理,需要在載體上根據靶點上下序列設計約600—6 000 bp兩側同源臂以定點敲入外源DNA[1-3];(2)多基因共表達的應用:多基因共表達系統能夠滿足研究復雜的生理機制和實現多種生物功能的需求,在腫瘤多基因治療和蛋白工程等方面具有重大的應用價值。目前主要提高經濟性質的轉基因模型載體都在10 kb以上,如腮腺生物反應器的轉基因載體[4]。因此優化大載體轉染條件對多基因共表達系統、基因編輯、轉基因育種等具有重要的意義。【前人研究進展】轉基因豬的制備效率與大載體轉染供體細胞PFFs的效率有關,大載體轉染至PFFs后外源基因可通過隨機整合和定點整合兩種基因整合方式制備轉基因動物。隨機整合如系統具有基因轉移能力強、整合效率高、轉基因穩定表達和遺傳等優點,而且整合位點相對安全[5-8]。據統計48.8%的整合位點位于已注釋的基因位點[9];而杜新華等(2013)獲得的8個轉座子的有效整合位點中有5個位于牛基因組的非調控區內[10]。因此可借助增強型綠色熒光蛋白(enhanced green fluorescent protein, EGFP)基因報告載體和系統獲得有效整合位點,分析外源基因的表達效果和對內源基因表達的影響等以評估位點的安全性[11]。而基于同源重組的定點整合技術整合效率較低,效率僅0.5%—20%,可選的安全位點較少,主要以為靶點插入外源基因制備轉基因動物,如小鼠[12]、羊[13]、豬[11, 14],對20 kb以上的大片段定點整合仍存在極大的技術難度。目前轉染方法主要有碳酸鈣化學法、脂質體轉染法和電穿孔法等。雖然有研究人員通過脂質體法和碳酸鈣法可獲得陽性PFFs細胞,但是碳酸鈣轉染效率低,脂質體轉染法細胞毒性大[15]。而電穿孔法主要將額外加入的遺傳物質從電擊形成的瞬時孔隙導入細胞膜甚至細胞核內的一種轉染方式,這種方式快速簡易、毒性低、而且轉染效率相對較高,約30%—90%[16-18]。故相比之下,電穿孔法更適合大載體轉染PFFs。市面上電轉儀種類繁多,如ECM?830、NEPA 21和NucleofectorTM2b等。ECM?830具有方形波電穿孔系統,通過擊穿細胞膜將質粒導入細胞質內來實現高效轉染,而NEPA 21和 Nucleofector?2b均能擊穿細胞膜及核膜。三者相比,ECM?830轉染成本較低;NEPA 21不需要特殊轉染試劑盒,多數用于活體轉染[19-20],甚少用于體外轉染,Ishino等[21]使用NEPA 21成功轉染牛耳成纖維細胞,但效率很低(0.35%)。Nucleofector?2b雖然根據細胞類型使用專用轉染試劑盒,但無需自行摸索電轉條件。【本研究切入點】研究表明上述3種電轉儀轉染PFFs的小載體(10 kb以內)轉染效率可以達到50%以上[16-17, 22],但大載體轉染PFFs的效率較低,且相關研究甚少,因此可通過優化電轉儀(如ECM?830、NEPA 21和Nucleofector?2b)、電轉參數、質粒用量和拓撲結構的轉染條件來提高大載體轉染PFFs的效率,為新型轉基因環保豬的制備提供參考。【擬解決的關鍵問題】本文比較上述3種常用電轉儀的電轉參數、質粒用量和拓撲結構對26 kb質粒轉染PFFs的影響,以尋找針對豬胎兒成纖維細胞的更高效、合適的大載體轉染條件,為多基因共表達系統、基因編輯、轉基因育種等的應用提供參考。
1 材料與方法
1.1 材料
電轉儀:ECM?830(BTX,美國);Nucleofector?2b(LONZA,德國);NEPA 21(NEPA GENE,日本)。PFFs細胞:由廣東溫氏食品集團股份有限公司提供。質粒pPXAT-EGFP(26 kb):由國家生豬種業工程技術研究中心提供。
1.2 試驗時間和地點
2016年7月廣東省廣州市華南農業大學國家生豬種業工程技術研究中心。
1.3 方法
1.3.1 質粒準備 pPXAT-EGFP質粒依照Endo-free Plasmid Maxi Kit(Omega,美國)說明書進行抽提,取部分超螺旋質粒使用FastDigest?I(Thermo Scientific,美國)進行酶切線性化,純化回收備用(圖1)。
1.3.2 電轉染 將PFFs細胞于39℃、12%胎牛血清(Fetal bovine serum,FBS)的DMEM完全培養基中培養至融合度至80%—90%,胰酶消化后取1×106個細胞懸液至新的離心管中,棄上清,根據不同試驗分組添加電轉預混液(由電轉液和質粒組成的,不電轉的空白組以相應體積的電轉液代替電轉預混液),輕柔打散成單細胞懸浮液,全部轉至無菌的2 mm間距電轉杯中,根據不同電轉參數進行電轉,然后轉移至含有12% FBS的DMEM完全培養基6孔板,置于39℃,5% CO2的培養箱中培養。電轉6 h后更換成含有1×青鏈霉素(penicillin-streptomycin solution,PS)、12% FBS的DMEM完全培養基繼續培養。電轉48 h后0.05%胰酶消化,90×g離心5 min,添加1 mL/孔PBS重懸后用流式細胞儀檢測轉染效率[轉染效率=(綠色熒光細胞/細胞總數)×100%]。
圖1 pPXAT-EGFP質粒圖譜
1.3.3 電轉參數優化 ECM?830電轉PFFs的最佳電轉參數可參考Ross等[18]研究結果(脈沖電壓300 V,脈沖長度1 ms,脈沖次數3次),而NEPA 21和Nucleofector?2b轉染PFFs細胞的電轉參數有待優化。
為獲得NEPA 21最佳電轉參數,分別采用廣州市華粵行儀器有限公司(NEPA 21供貨商)提供的4種電轉參數轉染PFFs,即分為4個處理組(NEPA-1、NEPA-2、NEPA-3和NEPA-4,表1)和一個空白組(不電轉,100 μL NEPA電轉液代替電轉預混液),每個組3個重復,其他電轉步驟及檢測見1.3.2。此外,NEPA 21電轉參數見表1,其電轉預混液由100 μL NEPA 21電轉液和8 μg質粒組成,而NEPA 21電轉液為無血清Opti-MEM。
NucleofectorTM2b則選取文獻報道中適用于PFFs的電轉參數進行優化[17],即分為2個處理組(LONZA-A:A-033和LONZA-U:U-023,表2)和一個空白組(不電轉,100 μL NucleofectorTM2b電轉液代替電轉預混液),每個處理組重復3次,其他電轉步驟及檢測見1.3.2。此外,NucleofectorTM2b電轉參數為A-033和U-023,其電轉預混液由100 μL NucleofectorTM2b電轉液和8 μg質粒組成,而 NucleofectorTM2b電轉液則來自電轉試劑盒Basic Nucleofector Kit for Primary Mammalian Fibroblasts (Amaxa,德國)中Nucleofector?Solution 和supplement按比例4.5﹕1混合的液體。

表1 NEPA21的穿孔脈沖參數
NEPA 21電轉參數參考分為兩部分:轉移脈沖和穿孔脈沖,其中轉移脈沖參數不變(脈沖電壓20 V,脈沖長度50 ms,脈沖間隔50 ms,脈沖次數5次,電壓衰減幅度40%,電極+/-)。上述4種電轉參數由NEPA 21供貨商廣州市華粵行儀器有限公司提供。NEPA 21電轉液為無血清Opti-MEM
The electroporation parameter of NEPA 21 is divided into two parts: transfer pulse and poring pulse. The transfer pulse remains fixed(pulse voltage of 20 V, pulse length50 ms , pulse interval 50 ms, pulse number 5 times, Voltage attenuation range 40% , + / -). And the above 4 kinds of poring pulse are provided by Guangzhou Hua Yue Enterprise Holdings Ltd which is the supplier of NEPA 21. In addition, the transfection mixture of NEPA 21 is Opti-MEM without serum

表2 優化Nucleofector? 2b電轉參數的試驗分組
1)A-033;2)U-023;3)Nucleofector?2b的電轉液由電轉試劑盒Basic Nucleofector Kit for Primary Mammalian Fibroblasts(Amaxa,德國)中Nucleofector?Solution 和supplement(4.5﹕1)
1)A-033;2)U-023;3)The transfection mixture of Nucleofector?2b is composed of Nucleofector?Solution and supplement(4.5﹕1) whcih is from Basic Nucleofector Kit for Primary Mammalian Fibroblasts(Amaxa, Germany)
1.3.4 優化質粒用量 使用上述優化的NEPA 21和Nucleofector?2b電轉儀參數,及ECM?830電轉參數(脈沖電壓300 V,脈沖長度1 ms,脈沖次數3次)[18],分別使用6、8、10和12 μg的超螺旋質粒進行轉染,即根據電轉儀分為3個處理組(ECM?830、NEPA 21和Nucleofector?2b)和對應的3個空白組(不電轉,相應電轉液代替電轉預混液),每個處理組根據質粒用量分為4個小組(6、8、10和12 μg的超螺旋質粒),每個處理小組重復3次,電轉步驟及檢測見1.3.2。此外ECM?830電轉預混液由200 μL的ECM?830電轉液和質粒組成,其中電轉液是25% Opti-MEM和75% cytosalts(120 mmol·L-1KCl,0.15 mmol·L-1CaCl2,10 mmol·L-1K2HPO4;pH 7.6,5 mmol·L-1MgCl2)的混合液[18]。
1.3.5 質粒拓撲結構的影響 使用3種電轉儀的最優電轉參數和摸索的最適質粒用量,分別使用超螺旋和線性化的質粒進行轉染,即根據電轉儀分為3個處理組(ECM?830、NEPA 21和Nucleofector?2b)和對應的3個空白組(不電轉,相應電轉液代替電轉預混液),每個處理組根據質粒分子結構分為2個小組(超螺旋質粒和線性化質粒),每個處理小組重復3次,電轉步驟及檢測見1.3.2。
1.3.6 比較電轉儀的轉染效率 根據上述探索的ECM?830,NEPA 21和Nucleofector?2b的最佳電轉條件(電轉參數、質粒用量和結構)轉染PFFs以探索電轉儀對轉染效率的影響,即分為3個處理組和對應的3個空白組(不電轉,相應電轉液代替電轉預混液),每個處理組重復3次,電轉步驟及檢測見1.3.2。
1.3.7 統計學處理 采用 SPSS 18軟件進行單因素分析(Duncan)。數據以 Mean ± SD表示,顯著性水平<0. 05則表示差異有統計學顯著性意義。
2 結果
2.1 不同電轉參數的比較
分別在不同的電轉參數下以8 μg質粒轉染PFFs,研究結果表明NEPA 21的最佳電轉參數為NEPA-4(脈沖電壓300 V,脈沖長度1 ms,脈沖間隔50 ms,脈沖次數3次),轉染效率為13.24%±1.63%(>0.05,圖2-A)。在Nucleofector?2b的最佳電轉參數為U-023,其轉染效率高達46.36%±3.95%(<0.05,圖2-B)。
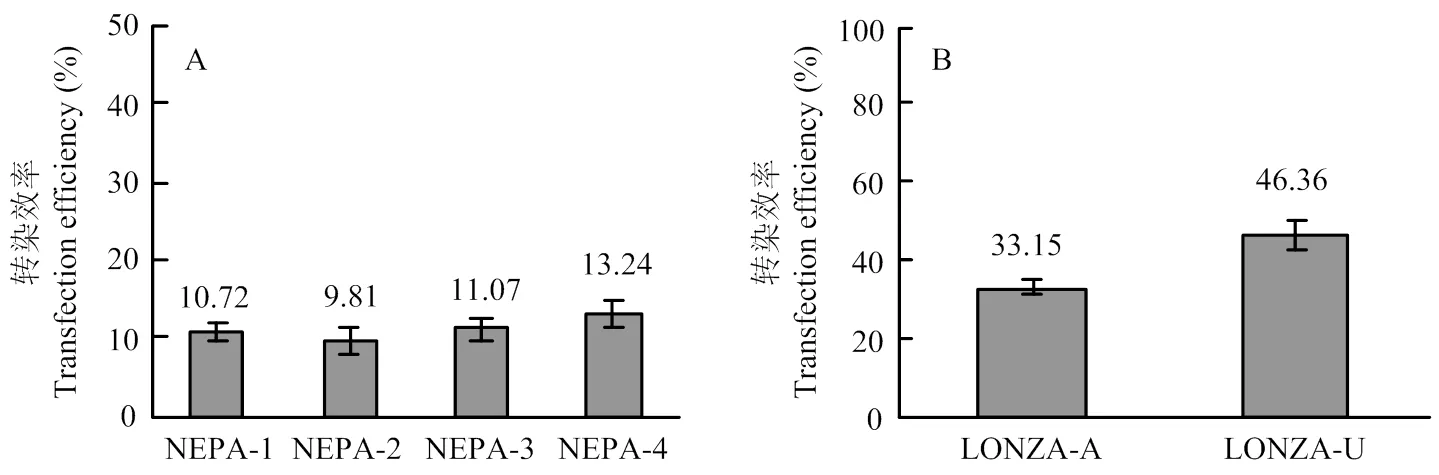
A:4種NEPA21電轉參數的轉染效率比較,NEPA-1~NEPA-4的電轉參數見表2;B:2種Nucleofector? 2b電轉參數的轉染效率比較,LONZA-A:A-033;LONZA-U:U-023
2.2 不同質粒用量的比較
在最佳電轉參數下使用3種電轉儀分別轉染6、8、10和12 μg的26 kb超螺旋質粒。由圖3可知當質粒用量為12 μg時,ECM?830和Nucleofector?2b轉染效率最高,分別為8.44%±0.90%(<0.05)和14.63%±3.21%(>0.05)。而NEPA 21使用10 μg質粒轉染PFFs時效率達到最高(6.09%±0.72%),但與12 μg質粒的轉染效率差異不顯著(5.12%±1.96%,>0.05)。
2.3 不同質粒拓撲結構的比較
在上述摸索的最佳參數下ECM?830,NEPA 21和Nucleofector?2b分別將12 μg超螺旋和線性化質粒轉染PFFs細胞。結果顯示3種電轉儀分別使用超螺旋和線性化質粒的轉染效率為:16.18%±1.45%和7.83%±1.27%;5.64%±1.12%和2.20%±0.23%;33.15%±1.30%和11.59%±1.20%(圖4)。由此可知線性化質粒的轉染效率為顯著低于其超螺旋結構(<0.05),且僅為超螺旋質粒轉染效率的34.96%—48.39%。
2.4 不同電轉儀的比較
在最佳電轉參數下比較ECM?830、NEPA 21和Nucleofector?2b轉染12 μg超螺旋質粒的效率。結果顯示3種電轉儀的轉染效率分別為:16.18%±1.45%、5.64%±1.12%和33.15%±1.30%,即3種電轉儀中Nucleofector?2b轉染PFFs的轉染效率最高(圖5)。
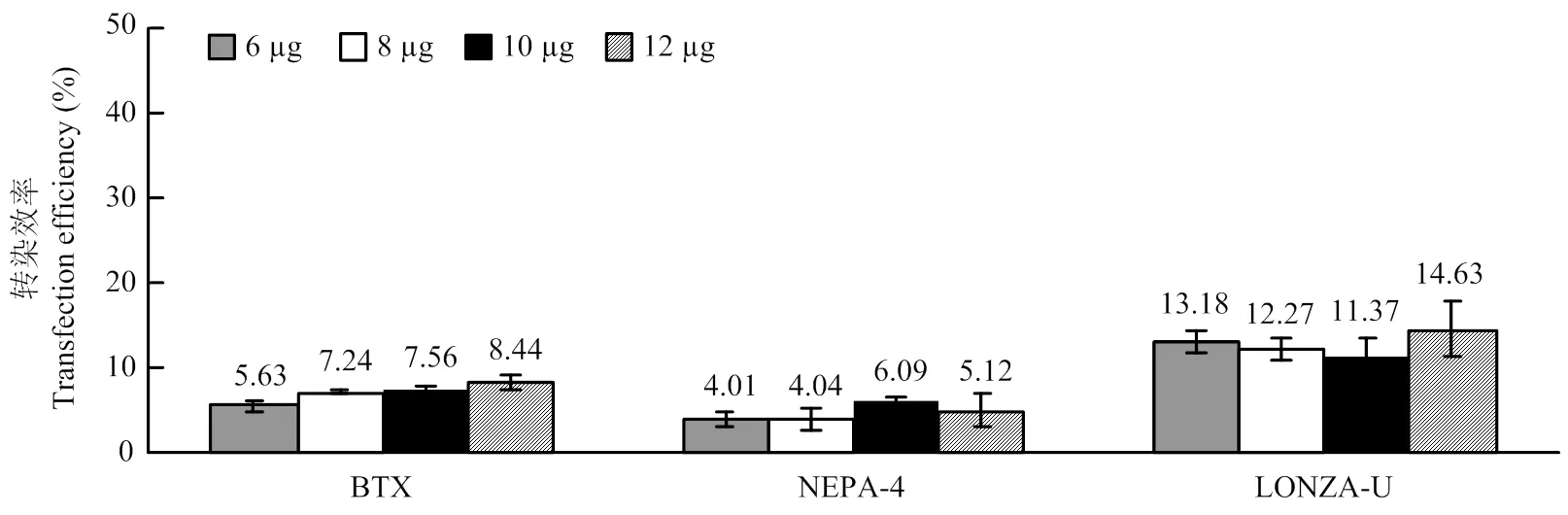
BTX:ECM? 830的最佳電轉參數(脈沖電壓300 V,脈沖長度1 ms,脈沖次數3次);NEPA-4:NEPA 21的最佳電轉參數(脈沖電壓200 V,脈沖長度3 ms,脈沖間隔50 ms,脈沖次數3次); LONZA-U:Nucleofector? 2b的最佳電轉參數(U-023)
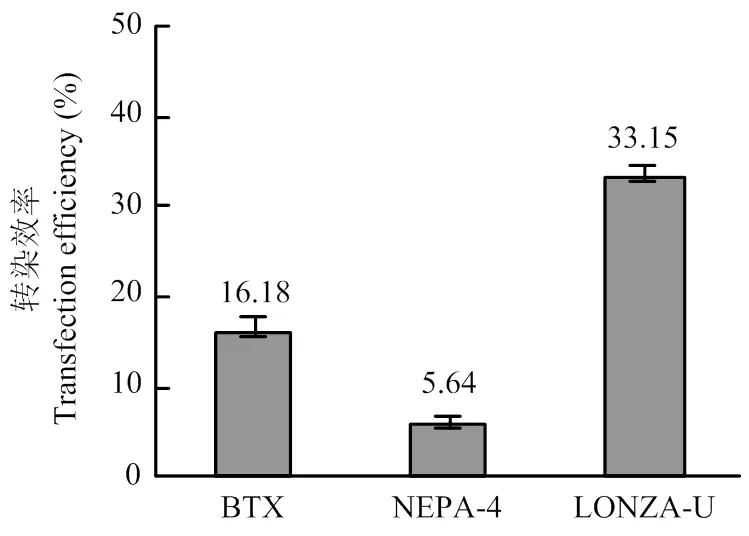
BTX:ECM? 830的最佳電轉參數(脈沖電壓300 V,脈沖長度1 ms,脈沖次數3次);NEPA-4:NEPA 21的最佳電轉參數(脈沖電壓200 V,脈沖長度3 ms,脈沖間隔50 ms,脈沖次數3次); LONZA-U:Nucleofector? 2b的最佳電轉參數(U-023)
3 討論
市面上電轉儀種類繁多,除了使用廣泛的ECM?830以外,還出現了很多轉染效率高的新型電轉儀,如NEPA 21和NucleofectorTM2b,本研究主要是與ECM?830相比,探索新型電轉儀轉染PFFs的效果并優化大載體轉染條件。ECM?830轉染條件借鑒Ross等[18]研究,文獻結果顯示在優化的轉染參數下將2.5 μg/200 μL的5.8 kb超螺旋質粒電轉1×106個PFFs,其最高轉染效率在70%左右。據報道使用NEPA 21將7 μg/100 μL的9 kb環狀質粒轉染至牛耳成纖維細胞,其轉染效率僅為0.35%[21]。而Nakayama等[17]使用Nucleofector?2b的U-023程序轉染3.5 kb超螺旋質粒,PFFs的轉染效率為79%。
相比之下,本試驗結果顯示26 kb質粒轉染至PFFs的轉染效率最高僅為46.36%±3.95%(Nucleofector?2b),NEPA 21的效率不足10%,而ECM?830在Ross等[18]優化的電轉參數下轉染26 kb超螺旋質粒的效率低于16%,而明顯低于上述小載體的轉染效率,表明質粒大小與轉染效率成反比的關系。本試驗還探索不同拓撲結構的質粒對轉染效率的影響,結果顯示超螺旋質粒轉染PFFs的效率高于線性化質粒效率的兩倍(圖4),這可能由于線性質粒的空間位阻較大[23]。而且有報道顯示超螺旋質粒和線性化質粒的細胞死亡率和轉染效率分別為:15%和35%、76%和11%[24]。推測線性化質粒對細胞的毒性較大,很可能影響后期豬體細胞克隆效率,因此超螺旋質粒更利于轉染。
此外,電轉儀也是顯著影響轉染效率的一個重要因素。3種電轉儀相比,Nucleofector?2b的轉染效率顯著高于ECM?830和NEPA 21(圖5),而且應用于小載體轉染時效率亦可高達79%,這可能由于Nucleofector?2b的電流同時擊穿細胞膜和細胞核膜更利于外源遺傳物質轉染。因此轉染26 kb大載體的最佳電轉儀是Nucleofector?2b,而且被廣泛大量運用于轉染成纖維細胞以制備轉基因動物。結合鐘翠麗等[22]研究結果認為電轉成本較低且轉染效率高達90%的ECM?830、ECM?2001等電轉儀更適合小載體轉染PFFs。此外ECM?830還具有對細胞損傷小的優勢,如圖4-A中雖然ECM?830轉染12 μg線性化質粒的效率低于NEPA 21和Nucleofector?2b,但是存活率較高且熒光細胞總數相對較多。最后,NEPA 21在本試驗中應用于轉染PFFs,26 kb超螺旋質粒的轉染效率較低(4%—13%),而7.6 kb超螺旋質粒的效率可達80%以上[22]。相比之下,NEPA 21不適合大載體轉染PFFs。
本試驗主要通過優化電轉參數、質粒用量和拓撲結構等條件以提高大載體轉染效率,對多基因共表達系統、基因編輯和轉基因育種等的應用具有重要的意義。大載體的低轉染效率是上述技術的難點之一,因此除了通過探索電轉條件,還可以通過降低載體大小來提高轉染效率。結合本試驗結果及前人研究提出以下策略:(1)構建單啟動子表達多基因或無啟動子基因打靶載體,其中單啟動子載體需要選擇一個強啟動子以啟動多個基因表達,而無啟動子基因載體則是借助內源啟動子實現多基因表達[25-26];(2)運用IRES和2A序列等元件構建多順反子[27-28];(3)縮短同源臂長度(短至300 bp)[29],能大幅度降低載體負載量,有利于提高轉染效率,或運用同源臂長度僅5—25 bp的微同源重組技術[30]。
4 結論
針對目前大載體轉染PFFs的效率較低且優化轉染條件的研究甚少的情況,本研究通過在不同的電轉儀(ECM?830/NEPA 21/Nucleofector?2b)、電轉參數、質粒用量和拓撲結構的條件下轉染PFFs以優化大載體的轉染條件,為多基因共表達系統、基因編輯、轉基因育種等提供參考數據。本研究結果顯示3種電轉儀中,Nucleofector?2b是大載體轉染PFFs的理想電轉儀,且在U-023的程序下轉染12 μg的26 kb超螺旋質粒時可達到最高轉染效率。
[1] RUAN J, LI H, XU K, WU T, WEI J, ZHOU R, LIU Z, MU Y, YANG S, OUYANG H, CHEN-TSAI R Y, LI K. Highly efficient CRISPR/Cas9-mediated transgene knock in at the H11 locus in pigs., 2015, 5: 14253.
[2] 王金霞, 徐影琪, 魏政立, 楊葳, 張梅英, 鄭志紅. 一種能實現蛋白可逆表達的敲入載體構建方法. 遼寧農業科學, 2016(4): 27-32.
WANG J X, XU Y Q, WEI Z L, YANG W, ZHANG M Y, ZHENG Z H. A method of constructing a knock-in vector which can achieve reversible protein expression.2016(4): 27-32. (in Chinese)
[3] 張駒. CRISPR/Cas9系統介導羊MSTN基因敲除和定點整合fat-1基因的研究[D]. 呼和浩特: 內蒙古大學, 2016.
ZHANG J. Generation ofgene knock-out andgene Knock-in goat via CRISPER/CAS9[D]. Huhhot: Inner Mongolia University, 2016. (in Chinese)
[4] GUAN L Z, SUN Y P, XI Q Y, WANG J L, ZHOU J Y, SHU G, JIANG Q Y, ZHANG Y L. β-Glucanase specific expression in the parotid gland of transgenic mice., 2013, 22(4): 805-812.
[5] CLARK K J, CARLSON D F, FAHRENKRUG S C. Pigs taking wing with transposons and recombinases., 2007, 8(Suppl 1): S13.
[6] DING S, WU X, LI G, HAN M, ZHUANG Y, XU T. Efficient transposition of the(PB) transposon in mammalian cells and mice., 2005, 122(3): 473-483.
[7] LI M A, TURNER D J, NING Z, YUSA K, LIANG Q, ECKERT S, RAD L, FITZGERALD T W, CRAIG N L, BRADLEY A. Mobilization of gianttransposons in the mouse genome., 2011, 39(22): e148.
[8] WU S C, MEIR Y J, COATES C J, HANDLER A M, PELCZAR P, MOISYADI S, KAMINSKI J M. piggyBac is a flexible and highly active transposon as compared to sleeping beauty, Tol2, and Mos1 in mammalian cells., 2006, 103(41): 15008-15013.
[9] WILSON M H, COATES C J, GEORGE AL JR.transposon-mediated gene transfer in human cells., 2007, 15(1): 139-145.
[10] 杜新華, 高雪, 張路培, 高會江, 李俊雅, 許尚忠. Piggybac轉座子在牛基因組的整合位點及特征分析. 遺傳, 2013, 35(6): 771-777.
DU X H, GAO X, ZHANG L P, GAO H J, LI J Y, XU S Z. Integration sites and their characteristic analysis oftransposon in cattle genome., 2013, 35(6): 771-777. (in Chinese)
[11] Xie Z, Pang D, Wang K, Li M, Guo N, Yuan H, Li J, Zou X, Jiao H, Ouyang H, Li Z, Tang X. Optimization of a CRISPR/Cas9-mediated knock-in strategy at the porcine Rosa26 locus in porcine foetal fibroblasts., 2017, 7(1): 3036.
[12] CHU V T, WEBER T, GRAF R, SOMMERMANN T, PETSCH K, SACK U, VOLCHKOV P, RAJEWSKY K, KüHN R. Efficient generation of Rosa26 knock-in mice using CRISPR/Cas9 in C57BL/6 zygotes., 2016, 16: 4.
[13] WU M, WEI C, LIAN Z, LIU R, ZHU C, WANG H, CAO J, SHEN Y, ZHAO F, ZHANG L, MU Z, WANG Y, WANG X, DU L, WANG C. Rosa26-targeted sheep gene knock-in via CRISPR-Cas9 system., 2016, 6: 24360.
[14] LAI S, WEI S, ZHAO B, OUYANG Z, ZHANG Q, FAN N, LIU Z, ZHAO Y, YAN Q, ZHOU X, LI L, XIN J, ZENG Y, LAI L, ZOU Q. Generation of knock-in pigs carrying oct4-tdtomato reporter through CRISPR/Cas9-mediated genome engineering., 2016, 11(1). doi:10.1371/journal.pone.0146562.
[15] 覃兆鮮, 潘天彪, 謝炳坤. 豬成纖維細胞轉染方法的比較. 江蘇農業科學, 2011(3): 250-251.
QIN Z X, PAN T B, XIE B K. Comparison of the transfection methods for porcine fibroblasts cell., 2011(3): 250-251. (in Chinese)
[16] RICHTER A, KUROME M, KESSLER B, ZAKHARTCHENKO V, KLYMIUK N, NAGASHIMA H, WOLF E, WUENSCH A. Potential of primary kidney cells for somatic cell nuclear transfer mediated transgenesis in pig., 2012, 12(1): 84.
[17] NAKAYAMA A, SATO M, SHINOHARA M, MATSUBARA S, YOKOMINE T, AKASAKA E, YOSHIDA M, TAKAO S. Efficient transfection of primarily cultured porcine embryonic fibroblasts using the Amaxa Nucleofection System?., 2007, 9(4): 523-534.
[18] ROSS J W, WHYTE J J, ZHAO J, SAMUEL M, WELLS K D, PRATHER R S. Optimization of square-wave electroporation for transfection of porcine fetal fibroblasts., 2009, 19(4): 611-620.
[19] BARNABé-HEIDER F, MELETIS K, ERIKSSON M, BERGMANN O, SABELSTR?M H, HARVEY MA, MIKKERS H, FRISéN J. Genetic manipulation of adult mouse neurogenic niches by in vivo electroporation., 2008, 5(2): 189-196.
[20] Zou M, Koninck P D, Neve R L, Friedrich R W. Fast gene transfer into the adult zebrafish brain by herpes simplex virus 1 (hsv-1) and electroporation: methods and optogenetic applications.s, 2014, 8(7): 41.
[21] ISHINO T, HASHIMOTO M, AMAGASA M, SAITO N, DOCHI O, KIRISAWA R. Establishment of protocol for preparation of gene-edited bovine ear-derived fibroblasts for somatic cell nuclear transplantation., 2018, 39(2): 95-104.
[22] 鐘翠麗, 李國玲, 莫健新, 全絨, 王豪強, 李紫聰, 吳珍芳, 張獻偉. 不同電轉儀的電轉參數、質粒用量和拓撲結構對豬胎兒成纖維細胞轉染效率的影響. 遺傳, 2017(10): 930-938.
ZHONG C L, LI G L, MO J X, QUAN R, WANG H Q, LI Z C, WU Z F, ZHANG X W. Effects of parameters, plasmid dosages and topological structures on transfection efficiency of porcine fetal fibroblasts using different electroporators., 2017(10): 930-938. (in Chinese)
[23] VON GROLL A, LEVIN Y, BARBOSA M C, RAVAZZOLO A P. Linear DNA low efficiency transfection by liposome can be improved by the use of cationic lipid as charge neutralizer., 2006, 22(4): 1220-1224.
[24] AUER T O, DUROURE K, DE CIAN A, CONCORDET J P, DEL BENE F. Highly efficient CRISPR/Cas9-mediated knock-in in zebrafish by homology-independent DNA repair., 2014, 24(1): 142-153.
[25] 楚素霞, 姚倫廣, 邢延豪, 周延清. 多基因表達系統研究進展. 中國生物工程雜志, 2011, 31(6): 116-123.
CHU S X, YAO L G, XING Y H, ZHOU Y Q. Progress in research on multiple gene expression system., 2011, 31(6): 116-123. (in Chinese)
[26] 李瑞國, 苗朝華, 侯健, 關宏, 安曉榮, 陳永福. 牛β-酪蛋白座位無啟動子基因打靶載體的構建. 華北農學報, 2010, 25(4): 17-24.
LI R G, MIAO Z H, HOU J, GUAN H, AN X R, CHEN Y F. Non-promotor gene targeting vector construction for bovine β-casein site., 2010, 25(4): 17-24. (in Chinese)
[27] 沈俊杰, 單娟娟, 駱菁菁, 劉立, 錢程. 構建多順反子表達載體系統的新策略[J]. 浙江理工大學學報, 2009, 26(4): 561-566.
SHEN J J, SHAN J J, LUO J J, LIU L, QIAN C. New strategy for construction of polycistron expression vector., 2009, 26(4): 561-566. (in Chinese)
[28] DENG W, YANG D, ZHAO B, OUYANG Z, SONG J, FAN N, LIU Z, ZHAO Y, WU Q, NASHUN B, TANG J, WU Z, GU W, LAI L. Use of the 2A Peptide for Generation of multi-transgenic pigs through a single round of nuclear transfer., 2011, 6(5): e19986.
[29] SATO M, KAGOSHIMA A, SAITOH I, INADA E, MIYOSHI K, OHTSUKA M, NAKAMURA S, SAKURAI T, WATANABE S. Generation of α-1, 3-galactosyltransferase-deficient porcine embryonic fibroblasts by CRISPR/Cas9-mediated knock-in of a small mutated sequence and a targeted toxin-based selection system., 2015, 50(5): 872-880.
[30] NAKADE S, TSUBOTA T, SAKANE Y, KUME S, SAKAMOTO N, OBARA M, DAIMON T, SEZUTSU H, YAMAMOTO T, SAKUMA T, SUZUKI K T. Microhomology-mediated end-joining-dependent integration of donor DNA in cells and animals using TALENs and CRISPR/Cas9., 2014, 5: 5560.
Optimizing the Electroporation Condition of Porcine Fetal Fibroblasts for Large Plasmid
ZHONG CuiLi1, LI GuoLing1, WANG HaoQiang1, MO JianXin1, QUAN Rong1, ZHANG XianWei2, LI ZiCong1, WU ZhenFang1,2, GU Ting1, CAI GengYuan1,2
(1College of Animal Science, South China Agricultural University/National Engineering Research Center for Breeding swine Industry, Guangzhou 510642;2Wenshi Food Group Co. Ltd., Xinxing 527400, Guangdong)
【Background】With the development of biotechnology, the physiological mechanisms and biological functions of research are becoming more and more complex, and improving the transfection efficiency of large vectors is of great significance for multi-gene co-expression systems, genome editing, and transgenic breeding. In transgenic breeding, the transgenic vectors is relatively large, and the efficiency of generating transgenic animals is also attributed to the transfection efficiency of porcine fetal fibroblasts (PFFs). 【Objective】Therefore, this study mainly compared the electroporation efficiency of three electroporation apparatus ECM?830/NEPA 21/NucleofectorTM2b on various parameters, plasmid dosage and topology, to explore the optimal electroporation condition of large vector in PFFs. 【Method】we transfected a 26 kb plasmid, namely pPXAT-EGFP, into the PFFs, and then the electroporation efficiencies of various parameters of three electroporation apparatus ECM? 830/NEPA 21/Nucleofector?2b, and the dosage and topological structure of the plasmid by the flow cytometry were compared.【Result】By comparing the transfection efficiency of different transfection parameters, the results showed that the highest transfection efficiency of NEPA 21 was 13.24%±1.63% at pulse voltage 300 V, pulse length 1 ms, pulse interval 50 ms, pulse number 3 times, and the optimal electrical rotation parameter of NucleofectorTM2b was U-023, whose transfection efficiency was 46.36%±3.95%. In addition, the transfection efficiencies of 6, 8, 10 and 12 μg 26 kb supercoiled plasmids were compared under the optimal electroporation parameters, and the results showed that the optimal plasmid dosage for ECM? 830 and NucleofectorTM2b transfected PFFs was 12 μg with 8.44% ± 0.90% efficiency (transfection parameters: pulse voltage 300 V, pulse length 1 ms, pulse number 3 times) and 14.63% ± 3.21% (U-023), while the NEPA 21 achieved the highest efficiency of 6.09% ± 0.72% with 10 μg plasmid. Finally, we compared the transfection efficiency of different quality topologies and found that the transfection efficiency of linearized plasmids was low, only 34.96%-48.39% of the supercoiled plasmids. 【Conclusion】 Therefore, the optimal electroporation condition of PFFs by Nucleofector?2b was U-023 procedure, 12 μg supercoiled plasmid; NEPA 21 was pulse voltage 200 V, pulse length 3 ms, pulse interval 50 ms, pulse number 3 times, and 10 μg supercoiled plasmid; ECM? 830 was transfected with 12 μg supercoiled plasmid at pulse voltage 300 V, pulse length 1 ms, and pulse number 3 times to obtain the highest transfection efficiency. Comprehensive comparison of the above three kinds of electroporation apparatus, the optimum for transfecting PFFs with 26 kb large carrier was Nucleofector?2b.
electroporation; large plasmid; porcine fetal fibroblasts; ECM?830; NEPA 21; Nucleofector?2b
10.3864/j.issn.0578-1752.2019.03.013
2018-09-18;
2018-12-29
國家科技重大專項(2016ZX08006002)、國家自然科學基金(31802036)、廣東省自然科學基金(2017A030310001)
鐘翠麗,E-mail:1014942996@qq.com。通信作者蔡更元,E-mail:cgy0415@163.com。通信作者顧婷,E-mail:tinggu@scau.edu.cn
(責任編輯 林鑒非)

