等離子體處理對不同含水量穿心蓮種子萌發的影響
,,,
(1.廣州中醫藥大學中藥學院,廣東 廣州 510006;2.廣州中醫藥大學中藥資源科學與工程研究中心、嶺南中藥資源教育部重點實驗室、國家中成藥工程技術研究中心南藥研發實驗室,廣東 廣州 510006)
物理農業中γ射線和離子注入等方法常用于誘變育種[1-2]。而低溫等離子體(low temperature plasma)能量較低,農業上常應用于提高種子活力、促進萌發及種子表面消毒等方面[3-4]。相對于化學試劑處理,低溫等離子體處理具有方便、快捷、無殘留等優點[3-4]。研究表明,多種方式激發的等離子體處理均可達到提高種子萌發率或萌發速度的作用,包括:電暈放電(corona discharge)[5-6]、射頻放電(radiofrequency discharge)[7-10]、低頻輝光放電(low frequency glow discharge)[11]、滑動弧光放電(gliding arc discharge)[12]、介質阻擋放電(dielectric barrier discharge)[13-14]、高壓納秒脈沖放電(high voltage nanosecond pulsed plasma)[15-16]、擴散共面表面阻擋放電(diffuse coplanar surface barrier discharge)等[17]。在多種作物種子研究中得到證實,包括:油菜(Brassicanapus)[5,10]、蘿卜(Raphanussativus)[6]、兵豆(Lensculinaris)[7]、菜豆(Phaseolusvulgaris)[7-8]、大豆(Glycinemax)[14]、豌豆(Pisumsativum)[17]、小麥(Triticumaestivum)[7,11,13]、菠菜(Spinaciaoleracea)[15]、芥菜(Brassicajuncea)[16]、刺菜薊(Cynaracardunculus)[9]、歐亞花葵(Lavaterathuringiaca)等種子[12]。Gómez-Ramírez等采用介質阻擋和射頻放電等離子體,均能提高昆諾藜(Chenopodiumquinoa)種子的萌發率[18]。
前期實驗采用大氣壓下介質阻擋放電激發的空氣等離子體處理種皮具有蠟質層的穿心蓮(Andrographispaniculata)種子,結果表明能夠刻蝕種皮,提高發芽指數和田間出苗率,并且增強幼苗的抗氧化能力;但過高的電壓或太長的處理時間卻會傷害種子[21]。進一步研究重新從3個激發電壓和3個處理時間組合共9個處理組中優選了適當處理劑量,可以提高穿心蓮種子發芽勢,促進植株生物量的積累[22]。然而,在實驗過程中觀察發現,大氣壓下敞開式放電環境的空氣濕度會影響等離子體的激發效果,空氣濕度越大需要激發的能量越高。環境的濕度相對容易調節,但是種子不同的含水量是否會影響等離子體的激發,從而對處理效應產生影響。以往的文獻大多沒有標明種子的含水量,說明前人的研究沒有考慮到環境濕度和種子含水量對處理效果的影響。為此,本研究調節穿心蓮種子到不同含水量,再進行等離子體處理和發芽試驗,考察不同含水量下處理對萌發和幼苗參數的影響,為播種前處理和進一步研究等離子體技術在農業生產中的應用提供參考。
1 材料與方法
1.1 材料與試劑
穿心蓮(Andrographispaniculata(Burm.f.) Nees)種子于2014年12月10日收購于廣西貴港,批號為GX 20141210 DX-1,經人工凈選,含水量為12.9%,試驗前保存于4 ℃冰箱內備用。
1.2 儀器與設備
DBD-50低溫等離子體放電設備,配CTP-2000 K型電源,南京蘇曼等離子體科技有限公司;Sartorius BSA 2245分析天平,賽多利斯科學儀器(北京)有限公司;ZRX-1000 EC智能人工氣候培養箱,杭州錢江儀器設備有限公司;DGX-9073烘箱,上海福瑪實驗設備有限公司。
1.3 試驗方法
1.3.1 種子初始含水量的測定
參照《農作物種子檢驗規程》[23](下文簡稱《規程》)及《<規程>實施指南》[24](下文簡稱《指南》),采用高溫法測定種子初始含水量。
1.3.2 種子水分的調節
十字分樣法扦樣,取穿心蓮種子,裝于尼龍網袋內,參考硅膠干燥法[25],在4 ℃冰箱中的密封盒內脫水處理3 h和24 h。或飽和水蒸汽增濕法加濕8,24,72 h(裝種子的尼龍網袋置于4 ℃冰箱內的密封盒上層,下層為滅菌蒸餾水)[26]。取出種子,迅速精密稱重,計算干燥或加濕后含水量。每組設置3個重復,每個重復1.5~1.7 g種子。
1.3.3 種子的等離子體處理
采用空調調節室溫為25 ℃,相對濕度約70%。調整低溫大氣壓介質阻擋放電(DBD)等離子體裝置的石英介質間距(氣隙)為8 mm,連接定時插座,調整電壓為30 V,把電源頻率調整到10 KHz。每個實驗重復的種子置于下介質板上,開啟定時插座放電處理3 s。處理后密封放置4 d后置種,以未處理種子作對照組[22]。每組設置4個重復,每個重復100粒種子。
1.3.4 發芽試驗
按照穿心蓮種子發芽試驗規程,室溫條件純水浸種20 h,0.3%雙氧水消毒5 min,置種,紙上法(TP)發芽,在溫度(27.5±1)℃光照培養。以胚根突破種皮達種子長度一半(約1 mm)計為發芽,每天進行發芽計數,置種后第7天結束發芽,并測量胚根長度[27]。
1.3.5 數據分析
參照《規程》及《指南》要求[23-24]按下式計算發芽率、第2天發芽勢、發芽指數等參數。數據組間差異采用SPSS 19.0軟件進行方差分析,兩兩比較采用Duncan檢驗。
發芽率(%)=(試驗中所有發芽種子數/供試種子總數)×100%;
發芽勢(%)=(規定天數內(2 d)發芽種子數/供試種子總數)×100%;
發芽指數(GI)=∑(Gt/Dt)(式中,Gt為置種后第t天的發芽數,Dt為不同的發芽試驗天數);
日均發芽數=∑(Gt×Dt)/∑Gt;
活力指數(VI)=發芽指數(GI)×胚根長;
霉變率(%)=(試驗中所有霉變種子數/供試種子總數)×100%;
正常幼苗百分比(%)=(第7天所有健康的正常幼苗數/供試種子總數)×100%。
2 結果與分析
2.1 穿心蓮種子水分調節結果
經測定,該批穿心蓮種子的初始含水量為(12.91±0.01)%;經過硅膠干燥24 h和3 h,含水量分別降至6.27%和8.58%;飽和水蒸汽加濕8,24 h和72 h,含水量分別提高到18.58%、23.97%和33.39%(見表1)。
2.2 穿心蓮種子含水量對等離子體處理后萌發的影響
發芽試驗結果表明,穿心蓮種子經過水分調節后,未經等離子體處理組中含水量為6.3%種子的發芽勢與基礎水分組(含水量為12.9%)的發芽勢(21.3±3.9)%相比降低了28.2%,但未達到顯著性差異;而含水量為18.6%組發芽勢相比基礎水分組提高了54.0%(p<0.05)。由此看來,4 ℃條件下飽和水蒸汽增濕處理種子8 h有助于提高穿心蓮種子發芽勢。但是,等離子體處理組和未處理組間發芽勢未見顯著性差異(見圖1 A)。從7 d內的總發芽率來看(見圖1 B),水分增加到18.6%組相比基礎水分組的發芽率(52.8±4.2)%顯著提高了25.9%(p<0.05);經過等離子體處理后從含水量為12.9%、18.6%到24.0%各組發芽率有逐漸升高的趨勢,含水量為12.9%組和24.0%組的發芽率與未經等離子體處理組相比較分別顯著提高了25.0%和39.2%(p<0.05),其它各組包括含水量為18.6%組差異不顯著。發芽指數與發芽率變化情況類似。未經等離子體處理前含水量為18.6%組相比基礎水分組的發芽指數(19.48±2.09)提高了34.4%(p<0.05);經過等離子體處理后從含水量12.9%、18.6%到24.0%各組發芽指數分別比未經等離子體處理組提高了24.8%(p<0.05)、8.1%和29.3%(p<0.05),含水量為18.6%組差異不顯著(見圖1 C)。從日均發芽數來看,未經等離子體處理各組間差異不顯著;經等離子體處理后從含水量為12.9%、18.6%到24.0%各組日均發芽數有逐漸升高趨勢;含水量為12.9%、24.0%和33.4%各組日均發芽數分別比未處理組提高22.1%、51.2%和19.5%(p<0.05);其它各組包括含水量為18.6%組差異不顯著(見圖1 D)。
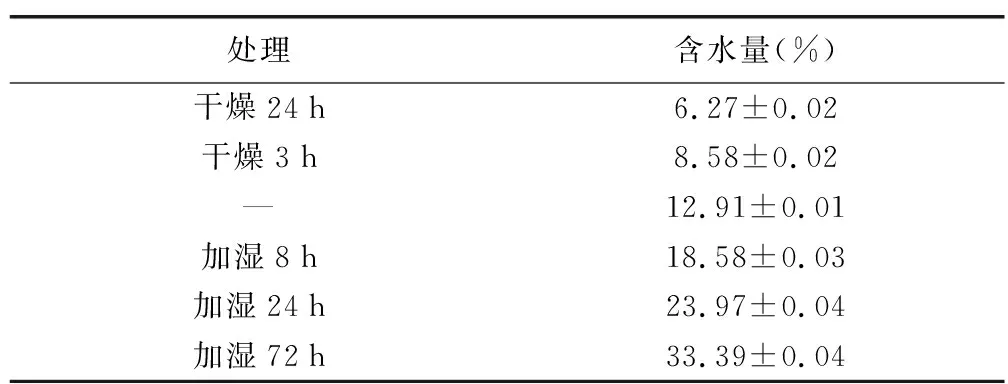
表1 干燥或增濕處理后穿心蓮種子的含水量(mean±SD,n=3)
注:“—”表示未進行干燥或增濕調節的初始狀態。
2.3 穿心蓮種子含水量對等離子體處理后幼苗的影響
置種后第7天結束發芽試驗,測量胚根長度,計算試驗過程中受到細菌或霉菌感染而腐爛的種子或幼苗與試驗種子總數的百分比(霉變率),剔除霉變等不正常幼苗并計算最終正常幼苗百分比。結果顯示,未經等離子體處理前含水量為8.6%組的胚根長度為(1.55±0.13)cm,顯著長于基礎水分組的(1.16±0.23)cm,表明4 ℃低溫干燥3 h后進行播種能促進萌發早期胚根生長;但該組經等離子體處理后胚根長為(1.19±0.09)cm,顯著短于未處理前,其原因有待進一步研究。含水量為33.4%未經等離子體處理組的胚根長度為(0.91±0.13)cm,短于基礎水分組,差異雖未達顯著水平,但是4 ℃低溫條件下飽和水蒸汽增濕72 h有可能對種子產生了吸脹冷害的影響。從活力指數來看,受到胚根長度的影響,未經等離子體處理含水量為8.6%組相比基礎水分組的的活力指數(22.88±6.61)提高了46.5%(p<0.05);含水量為18.6%組的活力指數相比基礎水分組提高了51.5%(p<0.05),為未處理組的最高值。經等離子體處理后,含水量為18.6%組的活力指數為最高值(42.65±8.21),由于試驗重復間差異太大,與未處理組差異未達顯著水平;但含水量為24.0%處理組相比未處理組的活力指數(25.23±4.20)提高了57.8%(p<0.05)。從種子或幼苗霉變情況來看,各干燥或增濕處理組間未見顯著差異,說明4 ℃低溫條件干燥24 h或增濕處理72 h對種子萌發過程感染細菌或霉菌情況沒有顯著影響。經等離子體處理后,含水量為12.9%、18.6%、24.0%和33.4%組霉變率顯著降低(p<0.05),與未處理組比較分別降低36.5%、41.4%、54.7%和31.0%,含水量為24.0%組的霉變率最低。從正常幼苗百分比來看,未處理組間未見顯著差異;經等離子體處理后受到霉變率顯著降低的影響,含水量為12.9%、18.6%、24.0%和33.4%組正常幼苗百分比顯著提高(p<0.05),與未處理組比較分別提高46.2%,51.0%,58.2%,36.6%,含水量為24.0%組的正常幼苗百分比最高。

注:組間比較采用方差分析,兩兩比較采用Duncan檢驗;不含有相同字母的組間差異具有顯著意義。下同。圖1 穿心蓮種子含水量對等離子體處理后萌發參數的影響
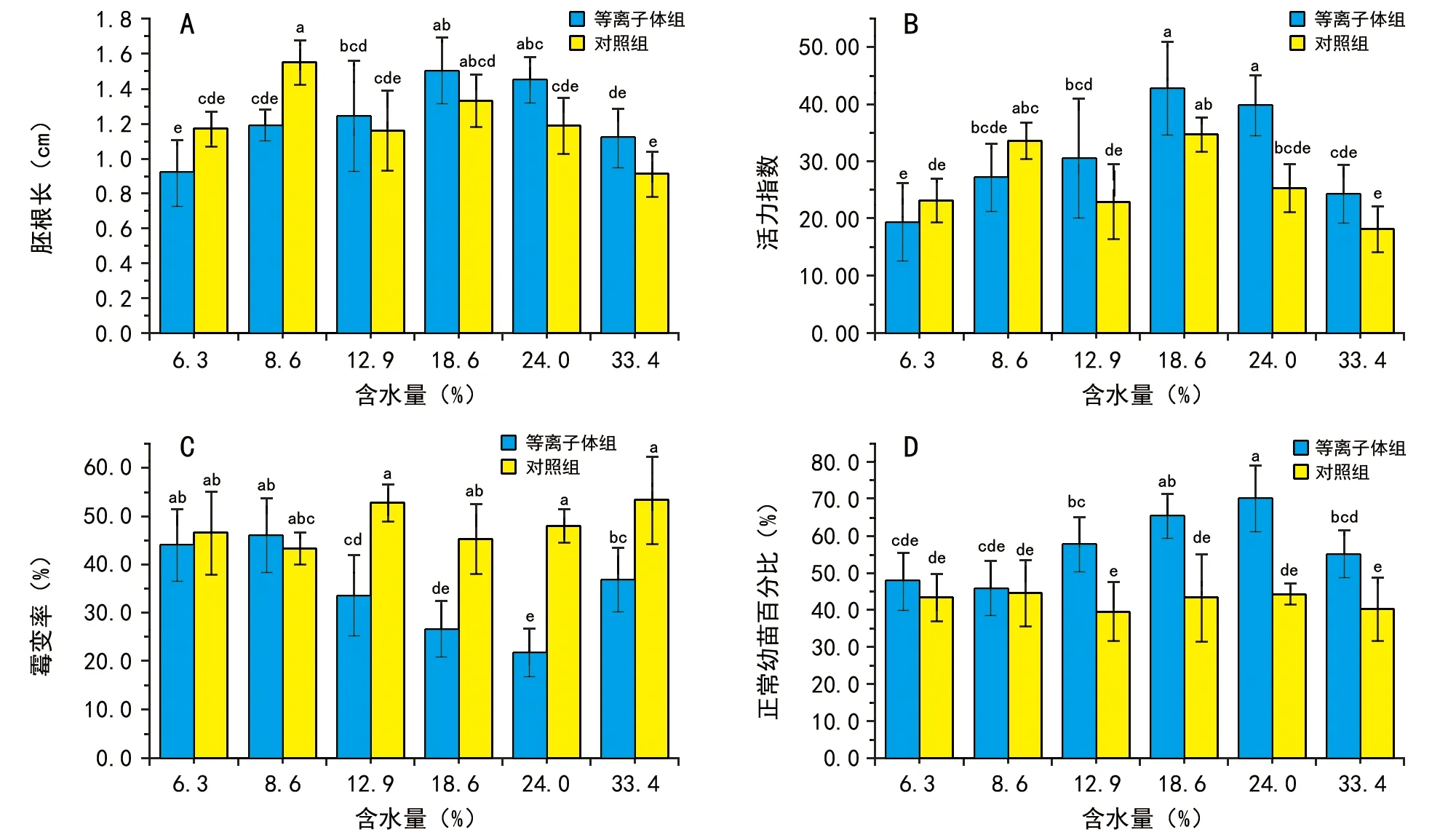
圖2 穿心蓮種子含水量對等離子體處理后幼苗參數的影響
3 討 論
前人采用等離子體處理種子,大多沒有考慮空氣濕度和種子含水量對處理效應的影響。本研究把空氣濕度調節到70%,盡量避免處理過程中種子受到空氣影響而含水量產生變化,從而考察種子含水量對處理效果的影響。結果表明,不同含水量的穿心蓮種子進行等離子體處理后萌發效應不一。基礎水分為12.9%或提高到18.6%、24.0%水分條件下種子經等離子體處理,發芽指數、日均發芽數和發芽率有逐漸升高趨勢,含水量為12.9%和24.0%組相比未處理組有顯著提高;水分和等離子體處理對含水量為18.6%組可能有交互作用,差異未達顯著意義。前期研究采用相同劑量等離子體處理含水量為11.6%的穿心蓮種子,也能達到提高發芽勢和促進幼苗生長的作用[22]。但含水量降低到6.3%和8.6%進行等離子體處理,對種子萌發和幼苗生長的效應不明顯。
種子含水量為12.9%到33.4%各組,等離子處理除了表現出促進萌發的作用之外,還有明顯的抑制細菌和霉菌、降低種子和幼苗染菌,從而提高正常幼苗存活率的效果;含水量為24.0%組效果最好。Jiang等研究表明,等離子體處理番茄(Solanumlycopersicum)種子后,幼苗抗青枯菌感染,從而降低青枯病的發病率[28];處理小麥種子,對攜帶的種傳病原如雪腐鐮刀菌(Fusariumnivale)、大刀鐮刀菌(Fusariumculmorum)、粉紅單端孢(Trichotheciumroseum)、黃曲霉(Aspergillusflavus)、棒曲霉(Aspergillusclavatus)等都有顯著的滅活作用[29]。其機理是由于等離子體中的帶電粒子和激發過程產生的活性氧(reactive oxygen species)有明顯的抗菌效果。胡友誼等采用不同含水量的空氣等離子體對指狀青霉(Penicilliumdigitatum)進行滅活處理,結果顯示隨著氣氛中水分比例的升高滅菌效果越好,分析認為主要是由于水分子電離產生的活性氫氧離子(OH)的作用[30]。
但是,并不是種子含水量調節得越高處理效果越好。當種子含水量升高到33.4%時進行等離子體處理,表現出明顯提高日均發芽數,也有顯著的殺菌和提高正常幼苗百分比的效應,但沒有明顯提高發芽指數和發芽率。研究表明,空氣中水分含量越高,激發產生的等離子體中帶電氫氧離子濃度越高;但是從液態水激發產生等離子體需要更高的能量,否則無法產生等離子體[30-31]。而前期研究表明,過高劑量的等離子體處理會對穿心蓮種子產生傷害,從而降低發芽率[32]。同時,結果顯示,調節水分處理的長時低溫(72 h,4 ℃)高濕環境可能對種子產生吸脹冷害,這在實際運用中也要考慮避免。此外,不同作物種子的大小、種皮厚薄和質地等具有多態性,最適合的種子含水量區間可能不同,應用前需要進行試驗摸索。
4 結 論
由于大氣壓敞開環境下等離子體的激發會受到空氣濕度和處理對象所含水分的影響,采用該條件的介質阻擋放電等離子體處理種子來促進萌發,種子含水量是影響處理效果的重要因素,需要適當的含水量才能達到促進萌發的效果,過低或過高的水分條件下進行處理都有可能達不到效果。總體來說,穿心蓮種子含水量在11.6%~24.0%范圍以內是合適的,該水分條件下進行等離子體處理能夠促進發芽,抑制種子攜帶的微生物的生長,從而獲得更多的健康幼苗。

