氯化苦熏蒸對土壤反硝化作用及nirS型反硝化細菌群落結構的影響
燕平梅 魏愛麗 趙文婧 李娜 李博 曹坳程
摘要 :探究氯化苦熏蒸對土壤反硝化作用的影響及機制。采用理化分析和DGGE方法分析了氯化苦熏蒸后土壤反硝化及nirS型反硝化細菌群落結構。不同濃度氯化苦熏蒸對土壤nirS型反硝化細菌群落均勻度無影響,而對nirS型反硝化細菌多樣性和豐富度指數的影響為高濃度>中濃度>低濃度>對照。對土壤反硝化作用的影響表現為,經500 mg/kg氯化苦熏蒸的土壤在培養初期(0 d)反硝化率比對照降低10.55%,土壤反硝化作用被顯著抑制。2周后3種濃度氯化苦均抑制土壤反硝化作用, 4周后土壤的反硝化作用緩慢恢復。500 mg/kg濃度氯化苦對土壤反硝化強度的影響與nirS型反硝化細菌群落結構變化不同,說明土壤反硝化作用的強弱并非完全決定于土壤nirS型反硝化細菌。
關鍵詞 :氯化苦;?土壤熏蒸劑;?nirS;?反硝化作用;?DGGE
中圖分類號:
S 482.6
文獻標識碼:?A
DOI:?10.16688/j.zwbh.2018491
Effects of chloropicrin fumigation on soil denitrification and
the community structure of nirS?denitrifying bacteria
YAN Pingmei1,2,?WEI Aili1,2,?ZHAO Wenjing1,2,?LI Na1,2,?LI Bo1,2,?CAO Aocheng3
(1. Department of Biology, Taiyuan Normal University, Taiyuan?030619, China; 2. Strategic Alliance of Green Industry
Technology Innovation for Soil Disinfestation and Activation, Taiyuan?030619, China; 3. Institute of Plant Protection,
Chinese Academy of Agricultural Sciences, Beijing?100193, China)
Abstract
The effects of chloropicrin fumigation on edaphic denitrification and the mechanisms were studied by using DGGE and physical and chemical analysis of soil denitrification and the community structure of nirS?denitrifying bacteria. Different concentrations of chloropicrin fumigation had no effect on the evenness of soil nirS?denitrifying bacterial community, but their effects on the diversity and abundance indexes of nirS?denitrifying bacteria were as followed: high concentration > medium concentration> low concentration > the control. The soil denitrification experiments showed that after treated by 500 mg/kg chloropicrin, at the initial stage of culture (0 d) the denitrification rate decreased by 10.55% compared with the control, denitrification were significantly inhibited in soil. After two weeks, all of the three concentrations of chloropicrin inhibited denitrification in soil, but the denitrification in soil naturally recovered after four weeks. The effect of 500 mg/kg chloropicrin on soil denitrification intensity was different from the change in the community structure of nirS?denitrifying bacteria, explaining why the strength of denitrification in soil was not completely determined by nirS?denitrifying bacteria.
Key words
chloropicrin;?soil fumigant;?nirS;?denitrification;?DGGE
土壤熏蒸技術主要用于防治土傳性病害,可有效控制農業生產中的病蟲草害。用于土傳病蟲草害防治的高效、廣譜土壤熏蒸劑——溴甲烷,由于其對臭氧層產生很大的破壞作用,危害地球表面的生態環境,被《蒙特利爾議定書》列為受控物質,全世界在2015年全部淘汰(必要用途豁免除外)該藥劑,因此需要尋找溴甲烷的替代品或替代技術。氯化苦等溴甲烷的替代品作為防治土傳病害的土壤消毒劑已有大量研究和商業化應用[14]。有關溴甲烷替代品的研究主要是針對其對病蟲害及雜草的防治效果及對環境的影響等[57]。 熏蒸處理后,土壤中病原微生物被抑制,但其他非目標微生物,如反硝化細菌的生長也受到抑制[89],導致反硝化活性顯著低于對照土壤[10]。但也有報道[11]認為,氯化苦和棉隆熏蒸顯著促進土壤反硝化作用。熏蒸劑對土壤反硝化作用影響有不同的報道,目前從反硝化細菌的群落結構變化探究氯化苦熏蒸與土壤反硝化作用關系及機制的研究還未見報道。反硝化細菌不是分類學特定類群,采用細菌16S rDNA研究反硝化細菌群落有明顯缺陷[12]。而反硝化過程中的關鍵功能基因可用于分析反硝化細菌群落結構。nirS基因編碼的亞硝酸還原酶基因被用于不同生境下反硝化細菌群落結構分析[1315]。本試驗從氯化苦熏蒸土壤中提取病原微生物的總DNA,采用nirS?PCR?DGGE方法研究了氯化苦熏蒸對土壤中nirS型反硝化細菌群落結構影響及其與反硝化活性變化的關系。
1?材料和方法
1.1?土壤樣品及土壤處理
土壤樣品來自通州區黃瓜大棚土壤。土壤理化性質為:銨態氮73.01 mg/kg,硝態氮249.46 mg/kg,有機質33.55 g/kg,速效鉀443.45 mg/kg,有效磷657.66 mg/kg,pH 6.86。土壤熏蒸劑是90%氯化苦液劑。
供試藥劑與土壤處理:將土壤濕度調節到15%,取1 kg土壤置于1.5 L干燥器中。將氯化苦液劑按20、100、500 mg/kg加到干燥器中的土壤中, 25℃密閉熏蒸7 d后敞氣恒溫避光培養。每處理重復3次,以不熏蒸的土樣為對照(CK),分別于培養0、14、28、56、84 d取樣測定。
1.2?反硝化活性的測定和計算
土壤中加入一定量的硝酸鹽,經厭氧培養后,測定土壤硝酸根的消滅率,用以表示土壤的反硝化活性的強度[16]。
1.3?土壤指標的測定
采用連續流動分析儀法(INTEGRAL Futura ALLIANCE INSTRUMENTS)測定濾液中NH4?N和NO3?N含量[17]。
1.4硝酸還原酶和亞硝酸還原酶活性測定
硝酸還原酶和亞硝酸還原酶活性采用比色法[8,17]測定。
1.5?PCR?DGGE方法
1.5.1?土壤微生物基因組DNA的提取與檢測
按照MO BIO公司土壤DNA提取試劑盒的操作步驟提取,以2%瓊脂糖凝膠電泳檢測。
1.5.2?PCR擴增nirS基因
以Cd3aF?GC F 5′?GT(C/G) AAC GT(C/G) AAG GA(A/G) AC(C/G) GG?3′和R3cd 5′?GA(C/G) TTC GG(A/G) TG(C/G) GTC TTGA?3′為引物擴增nirS基因[13,18]。PCR擴增體系為:10×PCR緩沖溶液[500 mmol/L tris?HCl (pH 80),0.5 μmol/L引物, 25 mmol/L MgCl2],0.25 mmol/L dNTPs,1.25 U TaqDNA聚合酶。PCR反應條件為:95℃預變性4 min;95℃變性50 s,52℃退火30 s,72℃延伸50 s,35次循環;72℃延伸8 min。PCR擴增產物為706 bp。
1.5.3?變性梯度凝膠電泳(DGGE)
變性劑梯度范圍為30%~50%,聚丙烯酰胺凝膠濃度為7%(變性劑為尿素7 mol/L和40%的去離子甲酰胺)。200 V 60℃下電泳5 h。采用SYBR Green對凝膠進行染色。
1.5.4?DGGE指紋圖譜分析、群落結構計算和系統學分析
采用凝膠成像系統分析DGGE指紋圖譜。計算豐富度指數(Margalef)R=S-1/lnN,S為某一泳道的總帶數;Shannon多樣性指數: H=-Σ (ni/N) ln(ni/N),ni表示單一條帶的峰面積,N為所有峰的面積;均勻度指數(Eveness): E=H/Hmax (其中Hmax=lnS )[19],并據此分析反硝化細菌群落結構。
1.5.5?nirS基因序列的鑒別和系統發育分析
將所測陽性轉化克隆菌nirS基因序列用DNAMAN (Version 4.0)軟件去除兩端的載體序列;用CHECK CHEMERA程序檢測人工嵌合序列并剔除,得到nirS序列。用BLAST程序在GenBank中搜索相似序列,用DNAMAN (Version 50)進行比對和系統發育分析。
2?結果與分析
2.1?氯化苦熏蒸土壤的反硝化作用
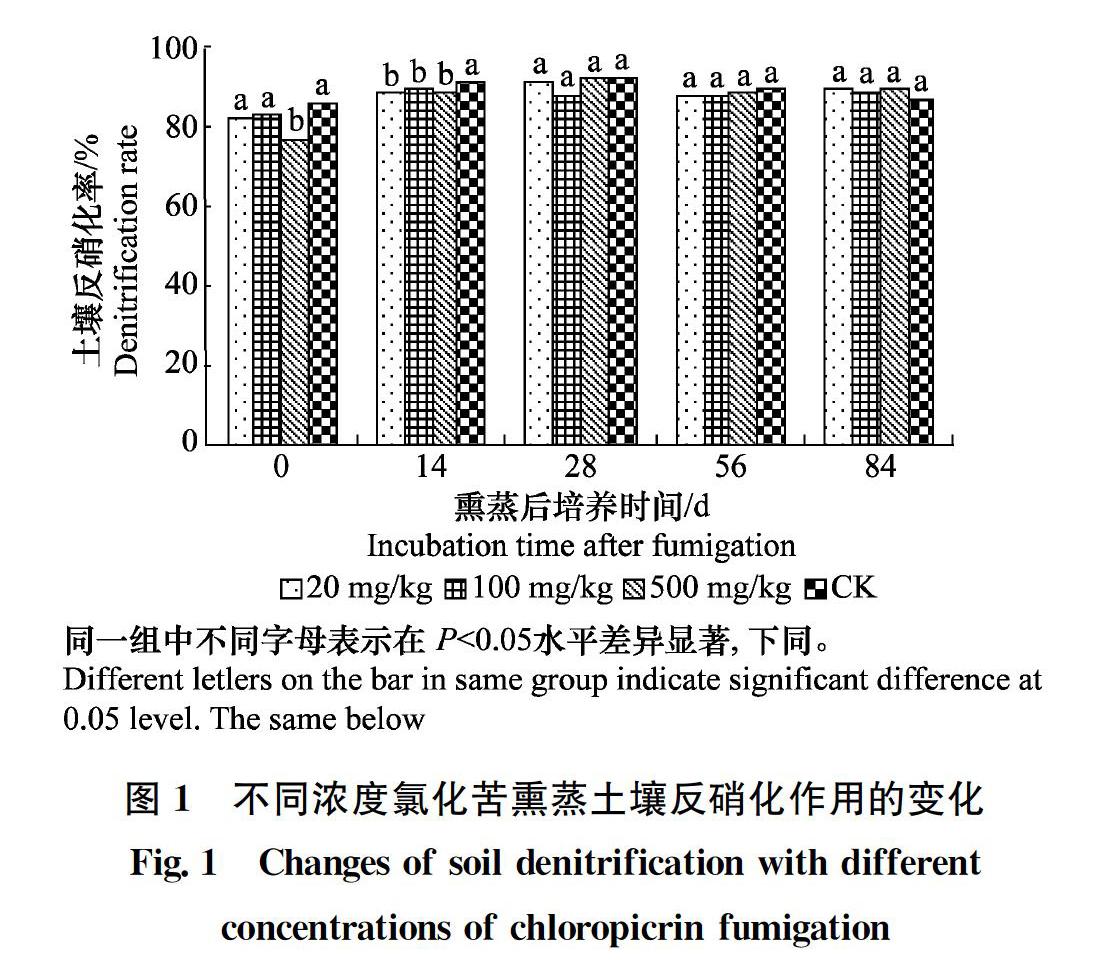
以20 mg/kg(低濃度)、100 mg/kg(中濃度)、500 mg/kg(高濃度)90%氯化苦液劑處理土壤,于處理后的0 d及培養14、28、56、84 d 測定土壤反硝化率,結果見圖1。熏蒸劑處理不同時間對土壤反硝化作用的影響不同,處理后0 d高濃度(500 mg/kg)處理反硝化率為77.57%,顯著低于低、中濃度處理土樣及對照(86.72%)(P<0.05),比對照減低了10.55%。低、中濃度氯化苦處理土樣之間及與對照土樣無顯著差異(P>0.05)。熏蒸后培養14 d,低、中、高濃度處理均顯著低于對照土樣(P<005),而3種濃度處理之間無顯著差異。熏蒸培養28、56、84 d,3種濃度氯化苦(低、中、高)熏蒸的土樣的反硝化率無顯著差異(P>0.05);其與對照(未熏蒸土樣)土樣無顯著差異(P>0.05)。試驗結果說明土壤反硝化作用對氯化苦熏蒸敏感,剛熏蒸后就表現出高濃度氯化苦抑制土壤反硝化作用;2周后三種濃度氯化苦均抑制土壤反硝化作用;4周后土壤的反硝化作用自然恢復。
2.2?氯化苦熏蒸土壤硝酸還原酶和亞硝酸還原酶活性的變化
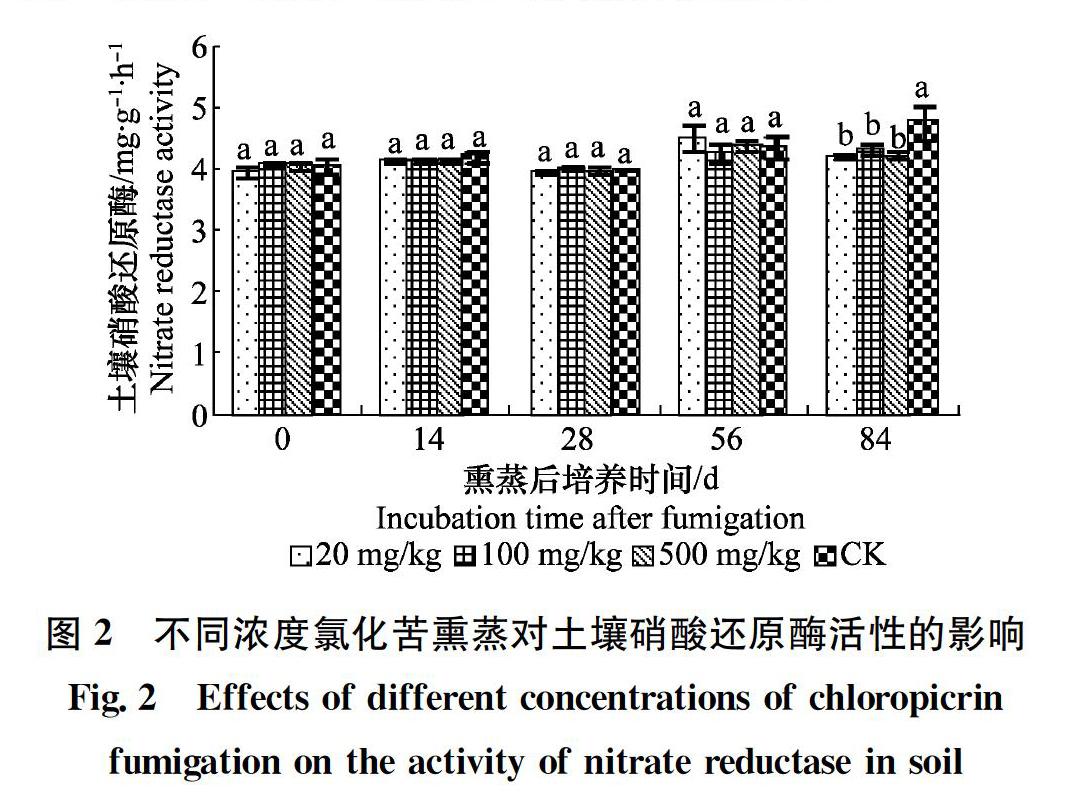
氯化苦熏蒸土壤硝酸還原酶活性的變化如圖2所示,培養不同時間土壤硝酸還原酶活性不同,熏蒸后0 d與14、28、56 d低、中、高濃度氯化苦熏蒸的土樣之間無顯著差異(P>0.05);其與對照(未熏蒸土樣)土樣無顯著差異(P>0.05)。熏蒸培養84 d高、中、低濃度氯化苦處理土樣硝酸還原酶活性顯著低于對照土樣(P<0.05);而低、中、高濃度氯化苦處理土樣之間無顯著差異(P>0.05)。說明氯化苦熏蒸后在土樣培養的后期(84 d)抑制土樣硝酸還原酶活性,且不同濃度之間無顯著差異。
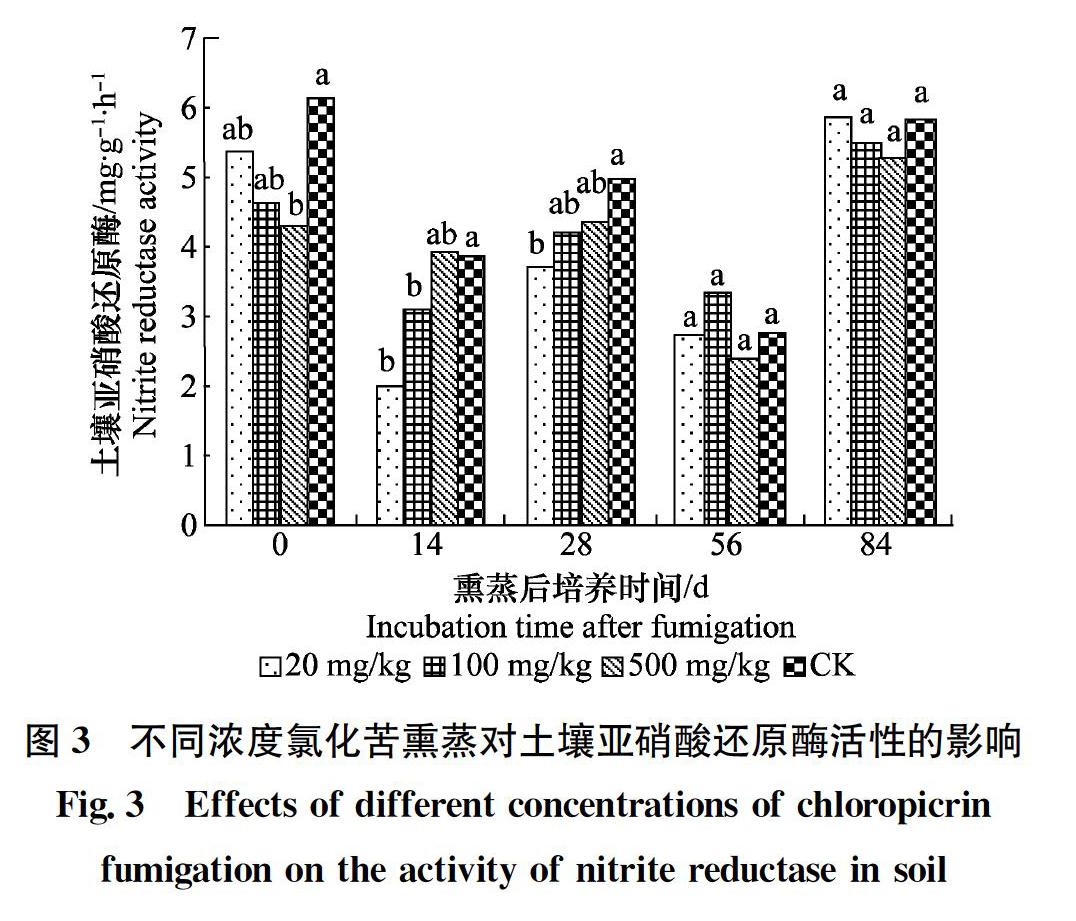
不同濃度氯化苦熏蒸對土壤亞硝酸還原酶活性的影響見圖3,處理后0 d,高濃度(500 mg/kg)處理顯著低于對照土樣(P<0.05),高、中、低濃度氯化苦處理土樣之間無顯著差異(P>0.05),中、低濃度氯化苦處理與對照土樣無顯著差異(P>0.05)。熏蒸后培養14 d,低、中濃度處理土壤亞硝酸還原酶活性均顯著低于對照土樣(P<0.05),而高濃度處理與對照之間無顯著差異(P>0.05)。熏蒸培養28 d,低濃度處理顯著低于對照土樣(P<0.05),而中、高濃度處理與對照之間無顯著差異(P>0.05)。56 d、84 d,三種濃度氯化苦(低、中、高)熏蒸的土樣土壤亞硝酸還原酶活性無顯著差異(P>0.05);其與對照土樣無顯著差異(P>0.05)。試驗結果表明,高濃度氯化苦熏蒸后,土壤亞硝酸還原酶活性被抑制;而8周后土壤的亞硝酸還原酶活性恢復。
2.3?氯化苦熏蒸土壤NH4?N、NO3?N含量的變化
不同濃度氯化苦熏蒸對土壤NH4?N含量的影響見圖4。熏蒸后,培養0 d和14 d,低、中、高濃度氯化苦處理土樣之間及與對照土樣NH4?N含量無顯著差異(P>0.05)。培養28 d,低濃度氯化苦熏蒸處理NH4?N含量顯著低于中、高濃度氯化苦熏蒸處理和對照土樣(P<0.05)。培養56 d,中濃度處理NH4?N含量顯著低于對照(P<005),而高、低濃度處理土樣與對照無顯著差異(P>005)。培養84 d,低,中、高濃度處理NH4?N含量顯著低于對照(P<0.05),低濃度處理顯著低于中、高濃度處理(P<0.05),而中、高濃度處理無顯著差異(P>0.05)。試驗結果說明氯化苦熏蒸對土壤NH4?N含量的影響發生在培養的后期(28 d后),且不同濃度的影響不同。
氯化苦熏蒸對土壤NO3?N含量的影響如圖5,熏蒸后0 d及培養14、28 d,低、中、高
濃度氯化苦熏蒸的土樣無顯著差異(P>0.05);其與對照(未熏蒸土樣)土樣也無顯著差異(P>0.05)。熏蒸后培養56 d,中濃度處理NO3?N含量顯著低于對照及高、低濃度處理(P<0.05),而高、低濃度處理與對照無顯著差異(P>0.05)。培養84 d,低濃度氯化苦熏蒸處理與對照無顯著差異(P>005),高、中濃度氯化苦熏蒸處理顯著高于對照(P<0.05),低濃度氯化苦熏蒸處理顯著低于高、中濃度處理(P<0.05)。說明高、中濃度氯化苦熏蒸對土壤NO3?N含量有影響。
2.4?PCR?DGGE方法分析氯化苦熏蒸土樣nirS型反硝化細菌群落結構
2.4.1?氯化苦熏蒸土壤樣品nirS型反硝化型細菌的DGGE指紋分析
不同濃度氯化苦熏蒸土樣培養不同時間后,土樣nirS型反硝化基因的DGGE圖譜結果見圖6。不同泳道上有一些共同的DNA條帶,且其中有一條泳帶在不同樣品中遷移率一致,說明不同濃度氯化苦熏蒸處理間以及和對照土壤間存在相同的反硝化細菌類群, DNA條帶信號強度不同說明不同濃度氯化苦熏蒸對土樣反硝化細菌豐富性影響不同。各個土樣的擴增產物經DGGE電泳區分條帶數目、遷移率差別很小,說明土樣反硝化細菌類群相似。回收圖6中1、2、3號電泳條帶,經測序鑒定為均Uncultured denitrifying bacterium (表1),系統發育關系結果見圖7,1號和3號條帶回收產物的同源關系較近,和2號條帶同源關系較遠。
2.4.2?氯化苦熏蒸劑處理土壤nirS型反硝化細菌群落結構分析
物種多樣性指數是應用數學的方法來度量組成群落的物種種類數、個體總數以及各種群均勻程度等3 個方面的數量指標,從而表明群落的組織結構水平及其生態學特征[19]。多樣性指數(H),均勻度(E)和豐富度(R)分別從不同角度反映群落結構特征,它們可以反映群落類型的不同,群落結構的差異,群落演替的動態變化。
90%氯化苦液劑3種濃度熏蒸土樣的多樣性指數(H)隨熏蒸后培養時間不同表現不同(表2)。熏蒸后0 d和14 d,H表現為500 mg/kg>20 mg/kg>CK>100 mg/kg;熏蒸后28 d,H表現為20 mg/kg>500 mg/kg>100 mg/kg>CK;熏蒸后56 d和84 d,H表現為500 mg/kg>100 mg/kg>20 mg/kg>CK。
90%氯化苦液劑3種濃度熏蒸后的土樣和對照土樣的均勻度指數(E)相近(表2),表明氯化苦熏蒸不會影響nirS型反硝化細菌群落的均勻度。
90%氯化苦液劑3種濃度熏蒸后土樣的豐富度指數(R)隨熏蒸后培養時間不同表現不同(表2)。熏蒸后0 d,R表現為500 mg/kg>CK>20 mg/kg>100 mg/kg;熏蒸后14 d,R表現為500 mg/kg>20 mg/kg>CK>100 mg/kg;熏蒸后28 d,R表現為20 mg/kg>500 mg/kg>100 mg/kg>CK;熏蒸后56 d,R表現為100 mg/kg>20 mg/kg>500 mg/kg>CK;熏蒸后84 d,R表現為100 mg/kg=500 mg/kg>20 mg/kg>CK。熏蒸后28~84 d,經氯化苦熏蒸土壤豐富度指數(R)均大于對照(CK),說明說明20 mg/kg、100 mg/kg和500 mg/kg氯化苦可誘導新類型nirS型反硝化細菌的大量產生。
1) 表中數據為平均值,數據后不同字母表示同一時間不同氯化苦濃度處理差異顯著(P<0.05)。
Data in the table are the mean value. Different small letter in same incubation time indicate significant difference among different concentration treatment of chloropicrin (P<0.05).
3?討論
參與土壤生物反硝化的主要生物酶有硝酸鹽還原酶(基因:narG)、亞硝酸鹽還原酶(基因:nirS、 nirK)。本研究中硝酸還原酶在熏蒸后12周受到抑制,2周后20、100、500 mg/kg濃度氯化苦均抑制土壤反硝化作用。氯化苦抑制硝酸還原酶與抑制反硝化作用時間不一致,表明反硝化過程中硝酸還原酶的催化作用不起主要作用,而亞硝酸還原酶是反硝化作用的關鍵酶。編碼反硝化細菌的亞硝酸還原酶基因有nirS 和nirK[20],且廣泛存在于土壤反硝化細菌中[2122]。從本試驗結果可知高濃度氯化苦熏蒸增加了nirS型反硝化細菌的種類和豐富性,由此推斷氯化苦應促進反硝化作用,但是本試驗結果表明高濃度氯化苦抑制土壤反硝化作用,說明了nirS型反硝化細菌在土壤反硝化作用中不起主要作用,有可能是nirK型反硝化細菌在土壤反硝化作用中起主要作用。該推斷尚有待于進一步的研究。
參考文獻
[1]?BEN?YEPHET Y, MELERO?VERA J M, Devay J E. Interaction of soil solarization and metharn?sodium in the destruction of Verticillium dahliae and Fusarium oxysporum f.sp. vasinfecmm [J]. Crop Protection, 1988,7(5): 327331.
[2]?GILREATH J P, MOILS T N, SANTOS B M, et al. Influence of supplementary in?bed chloropicrin application on soilborne pest control in tomato (Lycopersicon esculentum)[J]. Crop Protection, 2005,24(9): 779784.
[3]?HUTCHINSON C M, MCGIFEN M E, OHR H D, et al. Efficacy of methyl iodide and synergy with chloropicrin for control of fungi [J]. Pest Management Science, 2000,56: 413418.
[4]?MINUTO A, GULLINO M L, LAMBERTI F, et al. Application of an emulsifiable mixture of 1, 3?dichloropropene and chloropicrin against root knot nematodes and soilborne fungi for greenhouse tomatoes in Italy [J]. Crop Protection, 2006,25(12): 12441252.
[5]?GILREATH J, SANTOS B M.Herbicide dose and incorporation depth in combination with 1,3?dichloropropene plus chloropicrin for Cyperus rotundus control in tomato and pepper [J]. Crop Protection, 2004,23(3): 205210.
[6]?HANSON B D, GAO S, GERIK J S, et al. Effects of emission reduction surface seal treatments on pest control with shank?injected 1,3?dichloropropene and chloropicrin [J]. Crop Protection, 201l,30(2): 203207.
[7]?KLOSE S, AJWA H A, FENNIMORE S A. Dose response of weed seeds and soilborne pathogens to 1,3?D and chloropicrin[J]. Crop Protection, 2007,26(4): 535542.
[8]?孫軍德, 趙春燕, 曲寶成, 等. 氯化苦熏蒸土壤對微生物種群數量的影響[J].土壤通報, 2005, 12(2): 5153.
[9]?TANAKA S, KOBAYASHI T, IWASAKI K, et al. Properties and metabolic diversity of microbial communities in soils treated with steam sterilization compared with methyl bromide and chloropicrin fumigations [J]. Soil Science and Plant Nutrition, 2003, 49(4): 603610.
[10]ROUX?MICHOLLET D, CZARNES S, ADAM B, et al. Effects of steam disinfestation on community structure, abundance and activity of heterotrophic, denitrifying and nitrifying bacteria in an organic farming soil [J]. Soil Biology & Biochemistry,2008, 40: 18361845.
[11]顏冬冬. 熏蒸對設施栽培土壤中可溶性氮素、氧化亞氮的影響及其微生物學機制[D]. 北京: 中國農業科學院, 2013.
[12]MOUNIER E, HALLET S, CHENEBY D. Influence of maize mucilage on the diversity and activity of the denitrifying community [J].Environmental Microbiology,2004,6(3):301312.
[13]莫旭華, 麻威, 史榮久, 等. 氮肥對小麥田土壤型反硝化細菌多樣性的影響[J]. 微生物學報, 2009, 49(9): 12031208.
[14]BRAKER G, FESEFELDT A, WITZE K P. Development of PCR primer systems for amplification of nitrite reductase genes (nirK and nirS) to detect denitrifying bacteria in environmental samples [J]. Applied and Environmental Microbiology, 1998, 64(10): 37693775.
[15]BRAKER G, ZHOU Jizhong, WU Liyou. Nitrite reductase genes (nirK and nirS) as functional markers to investigate diversity of denitrifying bacteria in Pacific northwest marine sediment communities [J]. Applied and Environmental Microbiology, 2000, 66(5): 20962104.
[16]李阜棣,喻子牛,何紹江.農業微生物學實驗技術[M].北京:中國農業出版社,1996:2134.
[17]李振高,駱永明,滕應.土壤與環境微生物研究法[M].北京:科學出版社,2008:5668.
[18]陳哲, 陳春蘭, 秦紅靈, 等. 化肥對稻田土壤細菌多樣性及硝化、反硝化功能菌組成的影響[J]. 生態學報, 2009, 29(11):61426147.
[19]李曄,孫麗娜,楊繼松,等.基于PCR?DGGE的重金屬污染土壤微生物種群指紋分析[J].生態環境學報,2010,19(9):22042208.
[20]PETER M, MARK A, BOHLKE J K, et al. Methods for measuring denitrification: diverse approaches to a difficult problem [J].Ecological Applications, 2006, 16(6): 20912122.
[21]PRIEME A, BRAKER G, TIEDJE M.Diversity of nitrite reductase (nirK and nirS) gene fragments in forested upland and wetland soils[J]. Applied and Environmental Microbiology, 2002, 68(4): 18931900.
[22]THROBACK IN, ENWALL K, JARVIS A, et al. Reassessing PCR primers targeting nirS, nirK and nosZ genes for community surveys of denitrifying bacteria with DGGE [J]. FEMS Microbiology Ecology, 2004, 49: 401417.
(責任編輯:楊明麗)

