調強放療在晚期胃癌根治術后淋巴結轉移患者中的臨床效果及對炎癥因子、免疫功能的影響研究
許清,周彬
(東部戰區總醫院放療科,江蘇 南京 210002)
胃癌發病情況在我國具有一定的地域特征(西北地區、東部沿海地區發病率高于南方),且多發于50歲以上人群[1],其發病率居第四位,死亡率居第二位。胃癌根治術是治療胃癌的首選方法,但術后仍有21.8%~49.5%的局部區域復發率,且難以再次進行手術治療,而單純化療對局部控制欠佳,不能兼顧全身[2-6]。本研究以病例隨機對照展開,探討調強放療聯合同步化療在晚期胃癌根治術后淋巴結轉移患者中的臨床效果和不良反應情況,以及治療前后炎性因子及免疫功能變化對預后的影響。
1 資料與方法
1.1 一般資料
選擇2012年1月至2017年1月在南京東部戰區總醫院行胃癌根治術后淋巴結轉移患者150例,根據治療方法分為對照組和觀察組,每組各75例。納入標準:(1)確診腹腔淋巴結轉移前均已行全胃或胃大部分RO切除術,D2淋巴結清掃術;(2)腹部增強CT或磁共振確診腹腔淋巴結轉移,病灶直徑≥10 mm;(3)無其他部位轉移;(4)觀察組患者均無放化療禁忌癥。排除標準:(1)合并其他原發腫瘤或病歷資料不全者;(2)近1個月內接受過系統化療或對本研究結果產生影響的其他治療方案;(3)合并精神異常、治療依從性差或自身免疫系統疾病者。本研究均得到醫院倫理委員會批準,且患者及家屬對治療方法均具有知情同意。兩組臨床資比較,差異無統計學意義(P>0.05)。見表1。
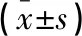
表1 兩組臨床資料比較
1.2 方法
1.2.1 治療方法 治療前完善有關檢查,了解患者身體狀態,評估治療耐受性。對照組:給予XELOX方案化療。奧沙利鉑(深圳海王藥業有限公司)使用劑量為85 mg/m2,靜脈滴注,每3周治療1次;卡培他濱(江蘇恒瑞醫藥股份有限公司)1 000 mg/m2,口服,每天2次,連續使用2周,休息1周后再次服用,患者均接受3~6周期化療。觀察組在對照組基礎上聯合調強放療。于3~6周期化療完畢后患者開始給予調強放療,治療前行CT模擬機定位,取仰臥位姿勢,體模固定,設置掃描層距5 mm,掃描范圍為膈上5 cm至臍水平部位。勾畫靶區:大體腫瘤體積(GTV)為腹腔轉移淋巴結,臨床靶區(CTV)為GTV基礎上外放5 mm,計劃靶區(PTV)為CTV基礎外放3~5 mm。放療劑量1.8~2.0 Gy/次,1次/d,5次/周,總中位劑量50 Gy(40~60) Gy。根據RTOG要求勾畫危及器官如殘胃、小腸、肝臟等,劑量均在可耐受范圍之內。
1.2.2 觀察指標 (1)療效評價。有效率:參考《實體瘤評價標準》[7]分別從完全緩解、部分緩解、疾病穩定與疾病進展對患者近期有效率進行評估。完全緩解(CR):靶病灶及非靶病灶完全消失;部分緩解(PR):靶病灶體積縮小30%,同時4周確認PR;穩定(SD):不到PR也不到PD的情況;進展(PD):病情持續惡化、靶病灶體積增大20%或死亡。生存率:患者結束治療后,安排定期隨訪,每三個月隨訪一次,為期兩年,計算患者總生存率。(2)不良反應:依據世界衛生組織化療毒性評價標準對患者治療后的不良反應進行評定,比較兩組不良反應發生情況。(3)炎癥因子:取兩組治療前、化療/放療療程后次日空腹狀態下靜脈血5 mL,血清分離后采用酶聯免疫吸附試驗檢測患者白細胞介素-4(IL-4)、白細胞介素-10(IL-10)及腫瘤壞死因子-α(TNF-α)水平[8],并評價炎癥因子與患者預后的關系。(3)免疫水平:取上述獲得的血液標本,采用流式細胞儀完成患者CD3+、CD4+、CD8+水平測定和CD4+/CD8+計算[9]。
1.3 統計學分析
2 結果
2.1 兩組療效比較
觀察組近期有效率(82.67%)高于對照組(54.67%),差異有統計學意義(P<0.05)。此外,通過隨訪2年發現,觀察組第1和2年生存率為90.7%、76.0%;對照組第1和2年生存率為85.3%、62.7%,差異無統計學意義(P>0.05)。見表2。
2.2 兩組不良反應比較
經統計表明觀察組患者白細胞減少62例,血小板減少12例,惡心嘔吐59例,腹瀉12例,神經毒性42例,手足綜合征8例;對照組患者白細胞減少57例,血小板減少11例,惡心嘔吐53例,腹瀉9例,神經毒性42例,手足綜合征5例,兩組各不良反應比較,差異無統計學意義(P<0.05)。見表3。

表2 兩組有效率比較[n(%)]
注:總有效率(ORR)=完全緩解率(CRR)+部分緩解率(PRR)

表3 兩組不良反應比較[n(%)]
2.3 兩組炎癥因子比較
兩組治療前各炎癥因子水平比較均無統計學意義(P>0.05);化療/放療療程結束后,兩組組內比較炎癥因子水平均有所改善(P<0.05);觀察組化療/放療療程結束后IL-4、IL-10及TNF-α水平均低于對照組(P<0.05)。見表4。

表4 兩組炎癥因子比較
2.4 兩組免疫功能比較
兩組治療前免疫功能各細胞百分比差異無統計學意義(P>0.05);觀察組化療/放療療程結束后CD3+、CD4+及CD4+/CD8+百分比高于對照組(P<0.05)但CD8+百分比低于對照組(P<0.05)。見表5。

表5 兩組免疫功能比較
2.5 炎癥因子與預后的相關性
通過計算兩組患者炎癥因子IL-4、IL-10和TNF-α水平與預后的相關性,發現炎癥因子水平與患者死亡情況均呈正相關,且差異有統計學意義(P<0.05)。見表6。

表6 炎癥因子與預后的相關性
3 討論
胃癌是一種常見的消化系統惡性腫瘤,由于早期缺少典型的臨床表現,多數患者確診時已經是中、晚期[10]。胃癌根治術是可手術患者的首選治療手段,但術后發生腹腔淋巴結轉移率高[11],影響患者預后。近年來,調強放療在晚期胃癌根治術后淋巴結轉移患者中得到應用,且效果理想[12]。調強放療是晚期胃癌根治術后淋巴結轉移患者中常用的治療方法,通過對靶區內射線強度進行調整、改變,保證靶區內部所有部位均能得到理想的劑量分布,使得治療可針對腫瘤實現物理劑量分布[13]。臨床研究[14]表明,調強放療能將每一個輻射線分割呈諸多細小的野,能在制定計劃的同時,根據靶區的三維形狀、相關危險等確定與周圍組織的關系,能對不同的區域分配相應的權重,使得照射野內能產生不均勻、優化的強度分布,有助于提高患者治療針對性,從而能獲得良好的治療預后。本研究中,觀察組調強放療3個療程近期有效率為82.67%,高于對照組的54.67%(P<0.05),隨訪2年發現,觀察組第1和2年生存率為90.7%、76.0%,對照組第1和2年生存率為85.3%、62.7%,差異無統計學意義(P>0.05)。此外,兩組患者不良反應比較無明顯差異(P<0.05),說明調強放療用于晚期胃癌根治術后淋巴結轉移患者中能獲得較高的近期療效,并且不會增加病情惡化的風險,利于患者恢復。
晚期胃癌根治術后淋巴結轉移的發生、發展與炎癥因子水平及免疫水平相關。國內學者[15]研究表明,胃癌根治術后淋巴結轉移與多種細胞分泌因子有關,炎性因子是引起局部性、全身性癌細胞擴散的重要原因。TNF-α是常見的炎癥因子,其表達水平與多種炎性反應有關,是多種細胞因子的啟動者,能參與機體免疫反應。IL-4是由抗原或絲裂原刺激的CD4+T細胞產生,且活化的肥大細胞亦可產生IL-4,能促進抗原或絲裂原活化,提高細胞的增殖分化能力,促進肥大細胞的增殖,對淋巴細胞的遷移具有一定的意義;IL-10是一種多細胞源、多功能的細胞因子,能調節細胞的生長、分化,直接參與炎性及免疫反應,是目前公認的炎癥與免疫抑制因子。臨床研究[16]表明,晚期胃癌根治術后淋巴結轉移患者機體免疫功能受到抑制,且Th2細胞功能相對增強,導致機體Th1/Th2平衡被打破,患者免疫功能下降,加劇疾病的發生。本研究同樣發現高水平的炎癥因子與患者死亡情況呈顯著正相關。而臨床上,將調強放療用于晚期胃癌根治術后淋巴結轉移患者中能降低炎癥因子水平,改善患者免疫功能,增強機體免疫抵抗力。本研究中,觀察組化療/放療療程結束后IL-4、IL-10及TNF-α水平均低于對照組(P<0.05),免疫功能CD3+、CD4+及CD4+/CD8+百分比高于對照組(P<0.05),CD8+百分比低于對照組(P<0.05),說明調強放療能降低晚期胃癌根治術后淋巴結轉移患者炎癥因子,利于患者免疫水平提高。
綜上所述,調強放療用于晚期胃癌根治術后淋巴結轉移患者中能獲得較高的近期療效,能降低炎癥因子水平,提高患者免疫功能,值得推廣應用。

