層面解剖在后腹腔鏡腎癌根治術中的應用效果
王振譽,鄭兵,朱華,張冰,顧棟華,施春梅
(南通市第一人民醫院泌尿外科,江蘇 南通 226400)
腎癌是常見的泌尿系統惡性腫瘤,具有較高的發病率及死亡率[1]。臨床研究證實,腎癌患者對放射治療、化療或激素治療等治療方式較不敏感,外科切除一直是目前國內外公認的治療早期腎癌的首選方案[2]。隨著微創理念的提出、腹腔鏡技術不斷發展,自1991年首例腹腔鏡腎腫瘤切除術成功以來,后腹腔鏡腎癌根治術在治療腎癌患者中逐漸應用并取得了較好的臨床效果[3-5]。在進行常規腹腔鏡下腎癌根治術時,由于腫瘤的新生血管較為豐富,容易引起術中大量出血,并可能增加血管損傷等嚴重并發癥發生風險[6]。2009年,邱劍光等[7-8]首次提出“層面解剖”,即通過觀察腎周腹膜后隙腔鏡下解剖學特點,將手術入路方式改為無血管平面,并發現應用層面解剖可有效降低腹腔鏡上尿路手術術中出血量,減少對內臟、血管及神經等的副損傷,提高手術的安全性。本研究通過分析63例應用后腹腔鏡行腎癌根治術患者的臨床資料,以探究層面解剖技術在后腹腔鏡腎癌根治術中的應用效果。
1 資料與方法
1.1 一般資料
選取2016年9月至2018年5月于南通市第一人民醫院行后腹腔鏡腎癌根治術治療的63例腎癌患者為研究對象。根據手術方式,將63例患者分為觀察組(n=32)及對照組(n=31)。其中,觀察組男性14例,女性18例,年齡37~76歲,平均(53.63±9.50)歲;對照組男性19例,女性12例,年齡39~80歲,平均(54.26±9.65)歲,兩組患者性別、年齡等一般資料差異均無統計學意義(P>0.05)。本研究經醫院倫理委員會批準,患者自愿參加試驗并簽署知情同意書。
納入標準:(1)符合診斷標準的腎臟惡性腫瘤患者;(2)單側腎癌,對側腎功能正常;(3)無腎蒂淋巴結及遠處轉移;(4)符合手術及麻醉指征;(5)臨床資料完整。排除標準:(1)嚴重凝血功能障礙者;(2)雙側腎癌患者;(3)既往腹腔手術史患者;(4)合并其他惡性腫瘤患者;(5)臨床資料不全。
1.2 方法
1.2.1 手術方式 兩組患者均采用全麻,完全健側臥位,術前12 h禁食,8 h禁飲,對照組患者采取常規腹腔鏡下腎癌根治術治療,具體操作如下:術中沿腹壁背側Gerota筋膜外向上進行分離,依次分離顯露腎臟背側、腎上級、腹側、下級、腎動靜脈及輸尿管上段,完整切除腎周圍脂肪囊。觀察組患者應用層面解剖技術進行后腹腔鏡下腎癌根治術治療,具體操作如下:清理后腹膜脂肪,使Gerota筋膜顯露,將Gerota筋膜縱向切開,確保腎旁前間隙分離顯露;分離腎臟背側,處理腎蒂;將腎動脈鞘縱向切開,采用直角鉗游離出腎動脈,以Hem-o-lok夾閉后離斷;隨后向深面游離,將腎靜脈及其屬支找出,以Hem-o-lok夾閉后離斷;將側椎筋膜切開,進入腎筋膜前葉和融合筋膜間的無血管間隙,分別將腎臟腹側下極、上極游離出;隨后進入腎周脂肪和腰大肌筋膜間的無血管平面,分別將腎臟背側下極、上極游離出;于腎臟下極游離出輸尿管,在近髂血管水平以Hem-o-lok夾閉輸尿管,采用超聲刀將近端處切斷;將腎下極筋膜和膈下筋膜相連處切斷。對照組與觀察組均放置引流管,縫合關閉各切口,術后給與抗生素,預防切口感染。
1.2.2 觀察指標 (1)搜集兩組患者性別、年齡、腫瘤直徑、腫瘤位置等基線資料并進行比較。(2)記錄并比較兩組患者手術時間、術中出血量。(3)采用VAS評分評估兩組患者術后24 h疼痛程度,記錄鎮痛劑使用情況。(4)從術后排氣時間、術后下床時間、拔除引流管時間、住院天數等方面評估兩組患者術后恢復情況。(5)比較兩組患者術中并發癥發生情況,包括腹膜損傷、皮下氣腫、腸管損傷及腎靜脈、下腔靜脈損傷。
1.3 統計學分析
2 結果
2.1 兩組患者治療前基線資料比較
兩組患者年齡、性別、腫瘤直徑、腫瘤位置等基線資料差異均無統計學意義(P>0.05)。見表1。

表1 兩組患者治療前基線資料比較
2.2 兩組患者手術時間、術中出血量比較
觀察組患者手術時間較對照組縮短,術中出血量較對照組減少,差異有統計學意義(P<0.05)。見表2。
2.3 兩組患者術后疼痛程度及鎮痛劑使用情況比較
觀察組患者術后VAS評分及鎮痛劑使用率均低于對照組,兩組間差異有統計學意義(P<0.05)。見表3。
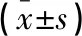
表2 兩組患者手術時間、術中出血量比較

表3 兩組患者術后疼痛程度及鎮痛劑使用情況比較
2.4 兩組患者術后恢復情況比較
觀察組患者術后排氣時間、下床時間、拔除引流管時間及住院天數均較對照組縮短,兩組間差異有統計學意義(P<0.05)。見表4。

表4 兩組患者術后恢復情況比較
2.5 兩組患者術中并發癥發生情況比較
觀察組患者術中并發癥總發生率均低于對照組,差異有統計學意義(P<0.05)。見表5。

表5 兩組患者術中并發癥發生情況比較 [n(%)]
3 討論
在世界范圍內,腎癌是第九大最常見的癌癥,也是起源于腎臟的最常見惡性腫瘤和最致命的泌尿生殖系腫瘤[9]。腎癌的發病與基因、職業和環境暴露等多種因素有關,患者通常無典型癥狀,且預后較差,部分或根治性腎切除術是治療腎癌的金標準[10]。隨著對腎癌流行病學的深入研究、顯微技術、解剖學的不斷發展,腹腔鏡手術方案的提出,為外科醫生提供了更大的手術視野,很大程度上增加了患者預期壽命[11]。腹腔鏡手術入路方式可分為經腹入路和經腹膜后入路[12]。胚胎學上,腹膜后結締組織分為三層,分別形成體壁內筋膜內襯、腎筋膜和胃腸道臟器覆蓋層,位于后腹壁上的所有器官、血管和神經,連同它們的組織以及周圍的結締組織和筋膜平面,統稱為腹膜后[13]。由于腹膜后隙空間狹窄且充滿大量脂肪,在進行后腹腔鏡腎癌根治術時可能對層面造成破壞,且分離層面時可能發生解剖迷失從而增加醫源性并發癥發生風險[6]。
傳統的解剖學以臟器大小、形態、毗鄰、血管神經淋巴分布、變異等為主要研究任務,適合指導傳統的開腹手術。然而在腹腔鏡下可以看到更多的層次與結構,且部分層次與結構不同于傳統的解剖學描繪,故而傳統的解剖學描繪不能很好的指導腹腔鏡手術[7]。2004年,國外研究團隊首次提出可通過建立寬敞的手術操作空間、進入正確的解剖層面,降低術中的副損傷的發生風險[14]。近年來,我國學者通過觀察腎周腹膜后隙腔鏡下解剖特征,提出層面外科的理念及無血管平面的手術技術,并將層面外科技術應用于腹腔鏡膀胱根治性切除術中取得了較好的臨床效果。梅傲冰等[15]指出,腎癌根治術中沿腎前筋膜間平面游離能夠有效避免解剖迷失,解剖層次更佳清晰;吳廣圳等[16]通過總結腹膜后腔筋膜間隙層面解剖相關研究,在后腹腔鏡根治性腎切除術中尋找安全正確的解剖層面,并將其應用于腎臟切除手術中,取得較好的效果;高玉仁[17]將層面解剖應用于腹腔鏡下膀胱癌根治性切除術,降低了術中出血量、減輕了手術創傷,由于手術操作復雜性低,縮短了手術時間。本研究將層面解剖技術應用于后腹腔鏡腎癌根治術以治療腎癌患者,發現相較于對照組,觀察組患者手術時間縮短、術中出血量減少,術后VAS評分及鎮痛劑使用率降低,術后恢復時間短、術中并發癥發生率降低,提示利用腹膜后的層面結構及間隙,可準確安全地到達手術區域,提高手術安全性,避免醫源性損傷,有利于患者的術后恢復。
本研究將層面解剖技術應用于后腹腔鏡腎癌根治術以治療腎癌患者的體會如下:(1)進入腹膜后腔后刷墻式快速游離筋膜外脂肪,腹側游離時避免打破腹膜,小的裂隙會使CO2氣體持續不斷進入腹腔,造成腹腔內高壓,壓迫后腹腔空間,影響暴露,妨礙后續手術操作,理論上側錐筋膜和側腹膜之間有層面,實際操作中我們極少能解剖進入該層面,側錐筋膜多與側腹膜緊密融合;(2)距腰大肌1~2 cm縱行打開側錐筋膜,理想的情況是進入側錐筋膜和腎筋膜后頁間隙,實際上腎筋膜后葉與側錐筋膜間隙菲薄,一般直接打開腎后筋膜進入腎筋膜后葉下層面,顯露腎周脂肪,即使順利進入了該間隙,往背側較易層面間分離,而逆行想沿層面分離至腹側卻非常困難,容易造成層面錯亂;(3)為了避免損傷腹膜縱行切開線總是偏向腎周筋膜背側,導致背側的腎周筋膜下層面游離容易,而腹側的腎周筋膜下層面游離稍有困難,主要是筋膜遮擋住腎臟的顯露,操作區域平面與器械垂直,容易使操作發生誤差,腹側分離鉗提起筋膜并牽向腹側保持一定張力,背側能量器械精細進入腎筋膜前葉下層面,可于腎筋膜前葉、腎前脂肪間見到疏松白色纖維,提示層面正確,再沿該層面快速擴大游離直至腔靜脈外緣,鮮有出血;(4)腎周筋膜腔容納腎臟并參與維持腎臟位置,其形態似梭形,重力作用下上半部分張力較下半部分張力高,組織更菲薄,容易造成損傷,在游離上半部分尤其是腹側時要遵循這一特點,避免層面混亂,損傷腹膜等組織,影響手術進程。此外,值得注意的是,由于本研究樣本量偏少,故研究結論存在一定的局限性。
綜上所述,應用層面解剖技術進行后腹腔鏡腎癌根治術可降低腎癌患者術中出血量、縮短手術時間,減輕患者疼痛程度、降低鎮痛劑使用率,降低術中并發癥發生率,術后恢復效果優于常規腹腔鏡下腎癌根治術,值得在臨床中推廣應用。

