X射線測定蛋白質結構的技術進展與研究現狀
熊 強,丁立新,姜曉燕,丁庫克*
(中國疾病預防控制中心輻射防護與核安全醫學中心放射生態研究室,北京 100088)
蛋白質是生命活動的主要執行者之一,正確且完整的結構是保證其正常功能發揮的前提,因此蛋白質結構的研究是目前最熱門的研究領域之一。對蛋白質三維結構的研究,一方面對于深入了解生物體內的生命過程有重要意義,另一方面對于重大疾病的預防和治療、新型高效藥物和疫苗的研發等有重要的作用。目前測定蛋白質三維結構的實驗方法主要有X射線晶體衍射技術(X-ray crystalline diffraction)、多維核磁共振(nuclear magnetic resonance,NMR)和低溫冷凍電鏡等[1](表 1)。NMR 對于相對分子質量很大的生物大分子的分辨能力有限,導致其結構無法解析,同時制備同位素置換樣品是一件昂貴且費時的工作;低溫冷凍電鏡方法近年來在解析膜蛋白和大型蛋白質復合物結構方面受到很多研究者的青睞,但是由于獲得足夠大小的晶體比較困難,電子與蛋白質相互作用,發生多重散射使得其內部結構分辨率較低等,目前最常用和最準確的測定蛋白質三維結構的手段仍是X射線晶體衍射技術[2]。截至2017年12月31日,蛋白質結構數據庫(protein data bank,PDB)中儲存了126 690條蛋白質結構數據,其中114 421條是通過X射線測得的,約占90%。
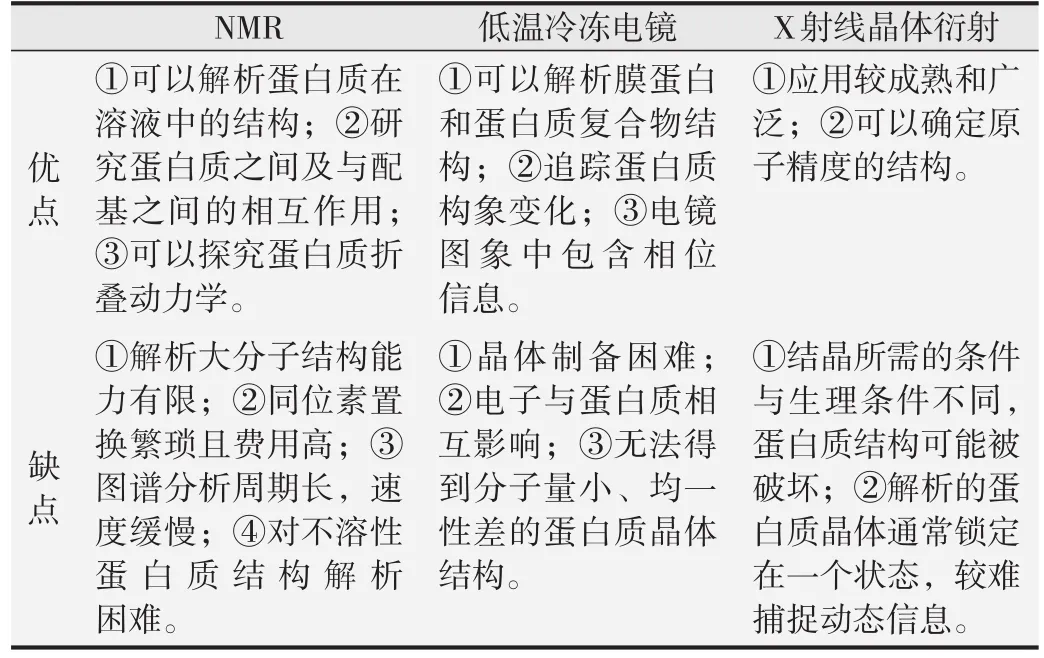
表1 3種測定蛋白質結構方法的比較
1 X射線測定蛋白質結構的原理
在解析蛋白質三維結構中應用的是波長在1?左右的X射線,由于該波長與蛋白質晶體內原子間距離的數量級相同,且晶體結構內分子規律性排列,當X射線入射到晶體上時,晶體中的每一個原子都發射出次生的X射線相互干涉迭加,并產生強X射線衍射[3]。這個過程與光學顯微鏡成像有相似之處:顯微鏡物鏡匯聚從被觀測物體表面反射的散射光而成像。對于X射線來說,雖然沒有一種材料可以直接作為物鏡匯聚散射光形成物像,但是晶體的衍射現象與晶體內部的結構有一定的關系,即衍射方向與晶體內晶胞的形狀、大小有關,而衍射的強度與重金屬原子在晶胞中的排列方式、周期等特點有關[4]。
與人的指紋相似,晶體衍射圖譜衍射線的分布位置和強度有著特征性規律。通過分析晶體內衍射點的排列方式和點間距離的大小來推算分子在晶體結構中的排列方式和重復周期的長短;通過測量衍射強度,借助電子計算機,結合一系列數學方法,可算出分子內每個原子在空間的坐標,從而測定整個分子的晶體結構[5]。
2 X射線應用于蛋白質結構測定的發展
自Rontgen發現X射線以后,越來越多的物理學家開始探索其性質和應用。1934年,Bemal和Crowfoot獲得了第1張蛋白質晶體的X衍射照片,但是當時理論比較局限,無法解決蛋白質大分子晶體衍射的相位問題。直到1953年英國的晶體學家Perutz和他的同事提出將重金屬原子引入蛋白質晶體中,通過多對同晶置換法(multiple isomorphous replacement,MIR)解決相位問題,才從理論上實現測定蛋白質大分子晶體結構的可能性。后來Kendrew和Perutz分別利用這種方法得到了鯨肌紅蛋白和馬血紅蛋白的低分辨率晶體結構[6-7],自此X射線晶體衍射技術在蛋白質結構測定中得到了實際應用。事實上,第1個用X射線晶體衍射技術測定蛋白質晶體結構并解釋分子機制的是溶菌酶,Blake和Phillips分別在1965和1966年測出其三維結構并詳細闡明了其作用機制[8-9]。
3 同步輻射
1961年,美國國家標準局在同步加速器真空盒切線方向上附加了一個真空裝置,建造了第1個用于紫外輻射的同步輻射裝置,該裝置的成功建設引起了在世界范圍內將同步輻射作為X射線光源的興趣。1981年美國的第2代同步輻射裝置(NSLSII)建成了世界上第1條用于測定蛋白質等生物大分子晶體結構線站,此后世界各地的同步輻射裝置紛紛建立了蛋白質晶體學線站。同步輻射因為擁有極高的強度、很好的準直性和方便可調的入射X射線等優點,在蛋白質晶體解析方面有巨大的應用潛能。
3.1 相位問題
解決相位問題是蛋白質晶體分析過程中最重要的步驟之一,同時也是最困難的地方。由于同步輻射能夠靈活改變X射線波長,為解決相位問題提供了一種有力的工具——反常散射。Venkatraman Ramakrishnan,Thomas A.Steitz和Ada E.Yonath 3位科學家因在核糖體結構和功能方面作出杰出貢獻而被授予2009年諾貝爾化學獎,在公告材料中指出,由于同步輻射可調波長的特性,可以利用反常散射來確定相位。Doutch等[10]在研究三聚類裂環無色桿菌亞硝酸還原酶(achromobacter cycloclastes nitrite reductase,AcNiR)時,利用蛋白質固有元素硫的單波長反常衍射(single-wavelength anomalous diffraction,SAD)來解決相位問題,發現用較短的波長就可以得到比較理想的結構。Harada等[11]研究含血紅素鐵的虹螺桿菌的原生細胞色素C時,利用晶體中鐵的多波長反常衍射(multiwavelength anomalous diffraction,MAD)來確定相位。SAD和MAD是目前最常用的解決相位問題的方法,但是由于晶體內部結構紊亂、輻射損傷和其他能引起反常衍射的原子等原因,單個晶體的反常衍射常常有一定的誤差。2011年Liu等[12]利用多個晶體的反常衍射數據解決相位問題,在結構建立、電子密度圖和精化等方面都有所提高。
3.2 小角X射線散射
20世紀70年代之前,小角X射線散射(small angle X-ray scattering,SAXS)由于光源的原因發展非常緩慢。直到80年代以后,同步輻射作為SAXS的光源,提供了極高的入射光強度,有效減小了光斑,實現對樣品的快速曝光,使得SAXS在蛋白質溶液結構和動態變化中得到廣泛的應用。Li等[13]利用SAXS研究玉米醇溶蛋白(zein)時,觀察到了該蛋白在不同溶劑中的尺寸形狀和分散狀態,從而得到了蛋白質在溶液中的構象等信息。蛋白質復合物結構十分復雜,用SAXS解析蛋白質復合物結構時需要聯合其他手段。Zhang等[14]研究細菌的四型酰胺酶效應因子(type VI amidase effector,Tae4)和免疫因子(type VI amidase immunity,Tai4)形成的復合物時,利用SAXS和分析超速離心,觀察到該復合物是一個四聚體,同時還發現了這4個單體之間相互結合的機制。Sonderby等[15]研究了38對蛋白質復合結構,通過聯合SAXS和網絡對接模擬數據,更加便利地得到蛋白質復合體在溶液中的構象和三維結構。近幾年,SAXS的飛速發展也使得一大批針對SAXS的實驗設備隨之產話生[16]。
3.3 串行晶體學
串行飛秒晶體學(serial femtosecond crystallography,SFX)是在X射線自由電子激光(X-ray free-electron laser,XFEL)出現后發展起來的一種新型解析蛋白質結構的方法。但是由于目前世界上僅有5臺XFEL裝置能開展SFX,而現在最先進的第三代同步輻射光源已經超過了20臺,所以基于同步輻射的串行晶體學(serial synchrotron crystallography,SSX)逐漸被重視,且發展迅速。SSX用于蛋白質結構解析上具有可在室溫下收集衍射數據、能解析微小晶體結構等優點。Stellato和Botha的團隊在室溫下用SSX分別照射油脂相中的膜蛋白和毛細管中流動的晶體獲得了衍射數據[17-18]。Coquelle等[19]通過掃描固定域薄硅片上隨機取向的晶體,獲得母雞卵白溶解酵素(hen egg-white lysozyme,HEWL)微小晶體高分辨率結構信息。在SSX的各種研究方法中,最常用的是將晶體固定在微流體芯片等基片上,從而收集基片上每個晶體的衍射數據,這對蛋白質微小晶體的解析有重要意義[20]。
4 X射線自由電子激光
2009年,美國SLAC國家實驗室建成了世界上第1臺X射線自由電子激光裝置LCLS。XFEL是一種新型的、完全相干的X射線,其工作原理和同步輻射完全不一樣,它的出現,為解析物質結構提供了一種全新的方法。因為XFEL擁有高強度、超短時間脈沖,可用于解析微小晶體或者無法結晶蛋白質的結構,同時也可以在晶體受到輻射損傷之前獲得衍射圖案。
4.1 微小晶體
傳統的X射線晶體衍射技術需要增大入射強度來記錄微小晶體的衍射數據,這樣對晶體的損害較大。現在通過將懸浮有大量微小晶體的溶液約束成射流,不斷傳送到光照區,SFX同步監控收集衍射數據[21]。Chapman和他的同事用硬XFEL的飛秒脈沖收集了300萬張衍射圖案,使用脈沖頻率比絕大多數輻射損害的時間尺度要短,減輕了輻射損傷的問題[22]。牛細胞色素c氧化酶(cytochrome c oxidase,CcO)是一個高輻射敏感的蛋白,Hirata等[23]通過對比XFEL和同步輻射對CcO中過氧化物配體的輻射損傷,發現XFEL對CcO基本無損傷。
4.2 膜蛋白
膜蛋白由于其疏水特性,與生物膜結合成穩定的自然構象,難以形成足夠大和高純度的晶體。在XFEL基礎上發展起來的SFX使得膜蛋白的結構解析成為可能,其中最熱門和最早解析的是G蛋白偶聯受體(G-protein-coupled receptors,GPCRs)[24]。SFX解析膜蛋白結構時,一般是通過收集膜蛋白在脂立方相(lipidic cubic phase,LCP)中晶體的衍射數據來解析膜蛋白結構,例如K+通道[25]、Na+/Ca2+泵[26]等膜蛋白結構的解析。然而,受限于XFEL的發展,SFX并不是作為膜蛋白結構解析的常規方法。
4.3 時間分辨測量方法
在生物學分子結構和功能關系的研究中只有提及功能,結構的變化才顯得有意義。隨著XFEL的發展,延伸出來了通過時間維度和時間分辨收集數據的方法來解析蛋白質結構,了解大分子的快速動力學。該方法是通過一種叫“泵-探針”的實驗來實現的,在這個實驗中,光敏感分子通過一束激光(泵)觸發時間依賴的變化,在一定的時間間隔內,結構變化通過X射線脈沖(探針)來檢測。這項技術被用在觀察一氧化碳的光解作用來探索肌紅蛋白(myoglobin)和血紅蛋白(hemoglobin)結構變化[27-28]。Schotte等[29]在觀察光敏感黃蛋白(photoactive yellow protein,PYP)順式-反式的光異構化的轉變時,觀察到了一個順式中間體。這個中間體存在的時間極其短暫,只有600 ps,而這個實驗最短能觀察到100 ps的變化。不僅如此,XFEL也可以實現fs級別的檢測范圍。一個研究一氧化碳肌紅蛋白的實驗觀察到了ps級別的螺旋運動,這也揭示XFEL在探測超快運動現象中的潛能[30]。
5 總結與展望
如上所述,在過去的幾十年中,高分辨率結構分析的X射線工具已大量涌現,讓我們可以在原子水平上解決生物分子相互作用及其機制。同步輻射和XFEL從某種程度上說是互補的兩種光源。目前同步輻射主要解析的是靜態或微動態的蛋白質結構,XFEL則可以提供ps量級甚至fs量級的動態結構。而且二者都擁有相對高能量、短脈沖的特點,能夠解析微小晶體和膜蛋白結構,甚至能實現“不需要晶體的結構解析”。不難看出,今后X射線光源會朝著更高強度更短脈沖的方向發展,我們相信隨著第三代同步輻射、XFEL的發展,甚至新光源的出現,目前存在的難題會迎刃而解,對蛋白質結構的解析也會上升至一個新的高度。

