重組大腸桿菌全細胞合成D-苯基乳酸
鮑志偉,蘇曉,楊柳婷,陳耀,羅希,付永前,孫小龍
(臺州學院 生物質資源研究所,浙江 臺州,318000)
苯基乳酸(phenyllactic acid, PLA)即2-羥基-3苯基丙酸,分子式為C9H10O3,相對分子質量為166,第2位碳原子為手性碳原子,因此具有2種對映異構體,包括D-和L-苯基乳酸[1]。

圖1 D-苯基乳酸(a)和L-苯基乳酸(b)
Fig.1 D-phenyllactic acid (a) and L-phenyllactic acid (b)
苯基乳酸是一種天然有機酸,廣泛存在于蜂蜜和乳酸菌發酵品干酪中,對人和動物無毒無害。對酸和熱的穩定性好,熔點為121~125 ℃,且親水性大,能在食品體系中均勻擴散[1]。苯基乳酸有著明顯的抑菌作用,抑菌譜廣,對大多數微生物均有抑制作用,尤其是多種食源性致病菌[2-5]。苯基乳酸不僅是一種理想的新型食品防腐劑[6],還在飼料添加劑[7]、醫藥[8-11]、化妝品[12]等領域有著廣泛應用。
有研究表明D型苯基乳酸抑菌效果強于L型苯基乳酸[1]。并且在很多細菌內包括乳酸菌內(例如植物乳桿菌)存在2種乳酸脫氫酶,D-乳酸脫氫酶(D-LDH)和L-乳酸脫氫酶(L-LDH),其中D-LDH對苯丙酮酸鈉(sodium phenylpyruvat, PPA)的比活力是L-LDH比活力的3倍[13]。RODRIGUEZ等[14]以植物乳桿菌CECT-221為生產菌株,以苯丙氨酸為底物生產苯基乳酸,對培養條件進行優化,在2 L的發酵罐中發酵培養158 h,產量由原來的0.23 g/L上升到0.7 g/L。由植物乳桿菌轉化苯丙氨酸生產苯基乳酸周期長、產量低、發酵液成分復雜,不利于后續分離純化;而大腸桿菌代謝路徑清晰,培養周期短,因此選擇重組大腸桿菌,以苯丙酮酸鈉(PPA)為底物,利用全細胞轉化合成D-苯基乳酸。
1 材料和方法
1.1 菌種
重組大腸桿菌BL21(DE3)/pET28a-ldhD,臺州學院生物質資源研究所保藏。
1.2 材料與試劑
葡萄糖、NaCl、KH2PO4、K2HPO4購于廣東汕頭市西隴化工廠;酵母膏、蛋白胨購自英國Oxoid公司;苯基乳酸、苯丙酮酸鈉購于阿拉丁試劑公司。
1.3 實驗設備與分析儀器
CHA-SA氣浴恒溫振蕩器(上海江星儀器有限公司);SBA-40C生物傳感儀(山東微生物研究所);BSA224S 電子天平(賽多利斯公司);高效液相色譜儀(島津LC-20A)。
1.4 實驗方法
1.4.1 重組大腸桿菌的培養及誘導
按1%的接種量接種重組大腸桿菌,LB培養基(酵母膏5 g/L,蛋白胨10 g/L,NaCl 10 g/L,pH值7.0,121 ℃,滅菌20 min,250 mL搖瓶分裝50 mL),37 ℃、200 r/min培養至OD600=0.8,加誘導劑IPTG至終濃度1.0 mmol/L,25℃誘導培養2 h;誘導后的菌液4 ℃、6 000 r/min離心10 min,再用生理鹽水洗滌2次,最后重懸于轉化液(含9 g/L底物PPA、50 mmol/L磷酸緩沖液)中,置于37 ℃、200 r/min搖床中反應2 h后取樣,利用高效液相色譜檢測苯基乳酸含量。
1.4.2 誘導條件的優化
分別考察不同誘導劑濃度及誘導時間對全細胞轉化合成苯基乳酸的影響。重組大腸桿菌基礎誘導條件如下:培養至OD600=0.8時,添加IPTG至終濃度為1 mmol/L,25 ℃誘導2 h。
1.4.3 全細胞轉化條件的優化
在優化后的最佳誘導條件下,進一步探索并優化全細胞的轉化條件。分別考察葡萄糖濃度、溫度、菌體量、底物濃度、金屬離子、表面活性劑、是否進行超聲破碎和有機溶劑處理等因素,對全細胞轉化合成苯基乳酸的影響。重組大腸桿菌基礎轉化條件如下:收集15 g/L菌體(干重)重懸于含9 g/L PPA的轉化液中,置于37 200 r/min搖床中,轉化2 h。
1.4.4 補料分批添加對轉化的影響
在最佳誘導條件下,培養后離心得菌體,取30 g/L菌體重懸于轉化液中。轉化液中初始底物PPA質量濃度為5 g/L,葡萄糖質量濃度為5 g/L。分別以不同方式分批補加葡萄糖和PPA。
1.5 分析方法
苯丙酮酸鈉和D-苯基乳酸的檢測:色譜柱為Agilent Zorbax SB-C18柱;1 mmol/L H2SO4-乙腈(V(H2SO4)∶V(乙腈)=85∶15),流速0.7 mL/min;檢測波長為210 nm;柱溫為30 ℃;進樣體積20 μL[15]。
葡萄糖濃度的測定采用SBA-40D傳感分析儀檢測。
菌體干重(DCW):將培養物抽濾,60 ℃烘干至恒重,稱重。
2 結果與分析
2.1 誘導條件的優化
本實驗對不同誘導劑濃度和誘導時間的影響進行了考察,由圖2-A可知,當IPTG終濃度小于0.2 mmol/L時,苯基乳酸的產量隨IPTG濃度的增加而增加,當IPTG終濃度達0.2 mmol/L時,苯基乳酸的產量最高達到3.56 g/L,但隨著誘導劑濃度的增加,苯基乳酸產量下降。圖2-B可知,隨著誘導時間的增加,苯基乳酸產量逐漸上升,苯基乳酸產量在誘導4 h時達到最大;當誘導時間大于4 h后,苯基乳酸的產量開始下降。原因可能是隨著誘導劑量的增加、誘導時間的延長,重組大腸桿菌地生長受到了抑制。
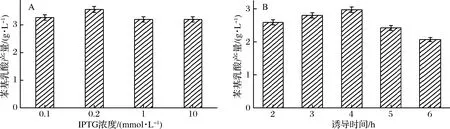
圖2 不同誘導條件對苯基乳酸轉化合成的影響
Fig.2 Effects of different induction conditions on the conversion and synthesis of phenyllactic acid
最終選取誘導劑ITPG的最佳終濃度為0.2 mmol/L,最佳誘導時間為4 h。
2.2 轉化條件的優化
2.2.1 轉化體系的優化
本實驗還分別考察轉化體系中葡萄糖濃度、轉化溫度、菌體量、底物PPA濃度、金屬離子及表面活性劑等因素對全細胞轉化合成苯基乳酸的影響,結果見圖3。由圖3-A可知,與未添加葡萄糖相比,添加葡萄糖后的苯基乳酸產量提高了12倍,原因是菌體對葡萄糖的代謝,可以為轉化反應提供大量的能量和NADH,使反應可以持續進行。但隨著葡萄糖濃度的升高,超過5 g/L時,苯基乳酸產量呈下降趨勢。在轉化結束時,轉化液pH值都有不同程度的下降,推測可能是葡萄糖在代謝中產生了酸性副產物,如乙酸、乳酸等,從而抑制了菌體的活性。因此最終選取的最佳葡萄糖濃度為5 g/L。
由圖3-B可知,當轉化溫度由32 ℃升高至37 ℃時,苯基乳酸的產量也隨之提高;當轉化溫度從37 ℃提高至42 ℃,產量無明顯變化。乳酸脫氫酶的最適溫度為37 ℃,采用全細胞轉化法的優勢在于細胞結構對酶具有一定的保護作用,溫度的變化使酶不容易失活,故最終選取37 ℃作為最佳轉化溫度。
由圖3-C可知,菌體量對苯基乳酸產量也有一定影響,與初始菌體量(15 g/L)相比,當使用30 g/L菌體量進行轉化時,產量有所提升,原因可能是由于菌體的增多從而增加了乳酸脫氫酶的總量,提高了苯基乳酸產量;而當菌體量大于30 g/L時,產量呈現明顯下降的趨勢,可能是由于菌體繼續增加,菌體與底物間接觸面積減小,同時增加了葡萄糖的消耗,減少了反應時間,使得苯基乳酸的產量下降。故本實驗選取30 g/L菌體量作為最佳菌體量。
由圖3-D可知,當底物質量濃度小于13 g/L時,苯基乳酸的產量隨著底物質量濃度的增加不斷提高,但在底物質量濃度9~13 g/L之間,變化不明顯;當底物質量濃度超過13 g/L時,產量開始呈現下降趨勢,原因可能是隨著底物質量濃度的不斷提高,酶的活性部位被抑制,使產量也隨之下降。最終選取最佳底物質量濃度為13 g/L。
由圖3-E可知,相比較不加金屬離子的對照組,添加金屬離子Na+、Mg2+、K+對產量有一定的提升,原因是金屬離子可以作為酶的激活劑從而提高酶的轉化率。實驗采用了同1種金屬離子1 mmol/L和100 mmol/L 2種濃度進行比較,從圖中可知,與1 mmol/L金屬離子濃度相比,100 mmol/L金屬離子對產量提升效果更加明顯。縱向比較3種離子的效果,可以得出Mg2+效果最佳。
由圖3-F可知,各類表面活性劑的添加對產量均有一定的提升作用,但需要控制好添加濃度,否則會使菌體破裂,使酶活下降,導致產量大幅度降低,如0.1%的Triton X-100會使產量大幅度降低。實驗結果可知PEG-200、PEG-400和吐溫-80都可添加至轉化液中提高產量。
最終選取最佳轉化條件:5 g/L葡萄糖,13 g/L PPA,轉化溫度為37 ℃,30 g/L菌體量。單批次苯基乳酸最大產量可達5.2 g/L,產率為40%。
圖3 不同全細胞轉化體系對苯基乳酸合成的影響
Fig.3 Effects of different whole cell transformation systems on the synthesis of phenyllactic acid
2.2.2 菌體處理對合成苯基乳酸的影響
本實驗采用超聲功率為120 w,超聲3 s、停3 s的破碎方法,對菌體進行超聲處理,結果見圖4,隨著超聲破碎的時間延長,產量大幅下降,可能是因為超聲致使菌體的破裂,胞內NADH無法再生,并且在超聲過程中會產生大量的熱量,酶易變性失活,使得反應終止,產量下降。由圖4-B可知,菌體經10%濃度乙醇浸泡后,產量比原來提高了約15%。菌體經1%丙酮浸泡后,產量提升了22.6%,而經10%丙酮浸泡后,產量下降29.2%,低濃度乙醇和丙酮等有機溶劑可以提高細胞膜的通透性,增加了底物在胞內的濃度,提高了酶與底物的接觸幾率。但高濃度的有機溶劑易使大腸桿菌細胞溶解,造成NADH無法再生,并可能使酶變性失活,造成反應無法正常進行,苯基乳酸的產量降低。初步判斷大腸桿菌菌體經1%丙酮浸泡處理后,具有較好提高苯基乳酸產量的作用。
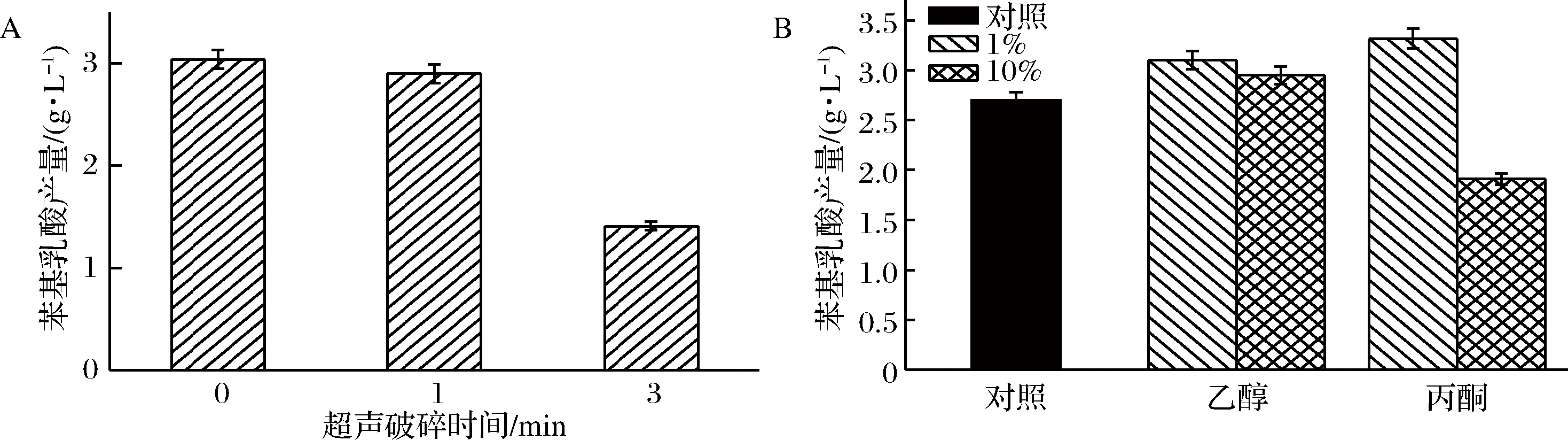
圖4 不同菌體處理方式對苯基乳酸合成的影響
Fig.4 Effects of different bacteria treatments on the synthesis of phenyllactic acid
2.2.3 補料分批添加對產量的影響
對底物和葡萄糖分批添加底物的初步探索,底物PPA按圖5中所示3種方式添加,對比3種底物添加方式,圖5-A中方式最好,通過表1數據可知,補料添加后產率提高至52.7%,產量為7.38 g/L. 分批添加底物與葡萄糖,可不斷提供能量和還原型輔酶NADH,有效解除高濃度底物的抑制,提高產量和產率。

A-每隔20 min,固定補加3 g/L PPA,共補加3次;B-每隔20 min,PPA補加至5 g/L,共補加3次;C-每隔30 min,PPA補加至5 g/L,共補加2次
圖5 底物(PPA)與葡萄糖分批添加方式對苯基乳酸合成的影響
Fig.5 Effects of substrate and glucose batch addition on the synthesis of phenyllactic acid
表1 苯基乳酸產量對比
Table 1 Comparison of phenyllactic acid Production

文獻報道產率[11]優化前優化后單批發酵補料發酵PLA產量/(g·L-1)0.70.255.27.38生產率/%/2.7840.052.7
3 結論
通過一系列實驗,本文探索并優化了重組大腸桿菌全細胞轉化合成D-苯基乳酸的條件,最終確定了最佳誘導及轉化條件。同時以苯丙酮酸鈉作為底物,在最佳條件下,苯基乳酸產量達到7.38 g/L,產率為52.7%,與優化前相比,產量提高了近30倍。通過添加不同金屬離子、表面活性劑及菌體有機溶劑處理的研究,發現這些因素對產量都有不同程度的提高。并且底物分批添加的方式能有效解除高濃度底物的抑制,從而有效提高苯基乳酸的產量和產率,為進一步提高苯基乳酸的全細胞轉化合成苯基乳酸的產量和產率奠定了基礎。
在苯丙酮酸鈉轉化為苯基乳酸的酶促反應中,伴隨著NADH的消耗,有文獻報道輔酶再生系統的構建,即通過將2個酶反應偶聯使得NADH再生,實現胞內NAD+/NADH的循環,對產率提高具有明顯作用[15]。可以看出重組大腸桿菌全細胞轉化合成D-苯基乳酸的產率仍有較大提升空間,具有廣闊的前景。

