胰腺癌組織中PSAT1表達及其介導的細胞增殖 侵襲作用機制研究*
聶釗 李嵐 楊蘭群 崔德軍 錢利 葉麗敏 楊倩 張德林 褚明亮 曾憲春
胰腺癌是一種惡性程度較高的消化系統腫瘤,根據中國國家癌癥中心發布的最新數據,我國胰腺癌發病率居惡性腫瘤第10位,死亡率居第5位[1]。盡管近20年癌癥診療技術得到了快速發展,但是胰腺位置較深,加之起病隱匿,早期診斷胰腺癌仍然是臨床的難題之一。當出現臨床癥狀時往往已是中晚期,患者5年生存率低于8%[2-3]。因此研究胰腺癌的發病機制,尋找可靠的早期診斷和預后評估標志物,是改善胰腺癌預后的關鍵。高糖酵解水平(Warburg效應)是惡性腫瘤的重要特征[4],腫瘤細胞通過Warburg效應為細胞生長和增殖提供足夠的能量。研究證實[5],Warburg效應能誘導一系列編碼糖酵解代謝酶的基因表達,進而促進細胞生物量累積和腫瘤細胞增殖。磷酸絲氨酸轉氨酶1(phosphoserine aminotransferase 1,PSAT1)是絲氨酸合成的限速酶,在3-磷酸甘油酸酯轉化為絲氨酸過程中發揮關鍵作用[6]。在這一轉化過程中,絲氨酸能為腫瘤細胞異常生長和增殖提供充足的能量供應,因此PSAT1與腫瘤細胞的發生和進展密切相關。PI3K/Akt/mTOR通路是細胞物質、能量代謝主要信號通路,在腫瘤細胞生長和增殖中發揮重要作用,PI3K/Akt/mTOR通路也被認為是腫瘤發生的主調節器[7-8]。本研究通過檢測胰腺癌組織和細胞PSAT1表達水平,并從PI3K/Akt/mTOR通路角度出發,初步探討PSAT1在胰腺癌增殖、侵襲中的作用及機制。
1 材料與方法
1.1 材料
1.1.1 組織樣本 采集2013年7月至2017年7月在貴州省人民醫院行手術切除的98例胰腺癌患者組織樣本,包括癌組織和配對的癌旁組織(距腫瘤切緣≥1 cm);樣本組織取出后立即置于液氮中冷凍,-80℃保存供后續實驗使用。所有患者術前完善雙源CT胰腺增強掃描,并經病理學證實為胰腺腺癌。術前未進行化療、放療或其他抗癌治療,排除轉移性胰腺癌、伴有其他惡性腫瘤或自身免疫性疾病者。本研究經醫院倫理委員會批準(編號:GZRY20130513),所有患者術前均簽署知情同意書。
1.1.2 細胞來源與培養 人胰腺癌細胞系BxPC-3、PANC1、SW1990細胞購自美國典型培養物保藏中心(ATCC),正常胰腺腺泡細胞AR42J購自中國科學院上海細胞庫。BxPC-3、SW1990、PANC1細胞接種于DMEM培養基,AR42J細胞接種于RPMI-1640。DMEM培養基和RPMI-1640培養基均含有10%胎牛血清(FBS)、100 U/mL青霉素和鏈霉素,在細胞培養箱中以37℃、5%CO2條件培養。
1.1.3 實驗試劑 DMEM培養液、胎牛血清(美國Gibco公司),RPMI-1640培養液、Lipofectamine 2000脂質體、Opti-MEM、TRIzol試劑(美國Invitrogen公司),PSAT1-siRNA(上海吉瑪制藥技術有限公司),Cell Counting Kit-8(Dojindo公司),Transwell小室(康寧公司),RIPA裂解液、BCA試劑(碧云天生物技術研究所),ECL檢測試劑盒(Thermo scientific公司),鼠抗人PSAT1單克隆抗體、鼠抗人Akt、mTOR、p-Akt、pmTOR單克隆抗體(美國Abcam公司),辣根過氧化物酶標記山羊抗鼠IgG(武漢博士德生物工程公司)。
1.2 方法
1.2.1 免疫組織化學染色檢測組織PSAT1表達 石蠟包埋的樣本組織經二甲苯脫蠟,梯度乙醇水化;加入檸檬酸鹽緩沖液(pH=6.0)加熱30 min修復抗原,3%H2O2孵育10 min消除內源性過氧化物酶,加入5%山羊血清封閉2 h。樣本組織加入PSAT1抗體4℃孵育過夜,次日再加入二抗孵育1 h,光學顯微鏡下觀察染色結果。結果判定:按照染色強度和陽性細胞染色面積對PSAT1表達進行綜合評價,染色強度:0分,陰性;1分,弱染色;2分,中等染色;3分,強染色。染色面積:0分,0~5%;1分,6%~25%;2分,26%~50%;3分,>50%;最終評分為染色強度評分×染色面積。參考 De Marchi等[9]報道,最終評分≥3 分為PSAT1表達陽性,<3分為PSAT1表達陰性。
1.2.2 臨床資料整理與術后隨訪 收集患者臨床資料,包括性別、年齡、手術時腫瘤大小、分化程度、腫瘤位置、淋巴結轉移、TNM分期、神經侵犯情況等。患者術后進行規律隨訪,本研究隨訪截止日期為2018年4月30日,隨訪時間5~53個月,中位隨訪時間17.3個月。記錄患者總生存期和無病生存期,定義總生存期為術后第2 d至死亡或末次隨訪的時間,無病生存期為術后第2 d至胰腺癌首次復發或轉移的時間。
1.2.3 小干擾RNA(siRNA)瞬時轉染 利用siRNA技術敲低細胞PSAT1表達,同時以轉移無義序列的細胞作為陰性對照(NC-siRNA)。轉染前24 h將細胞以1×105個/孔接種于6孔板,待細胞50%~70%融合時,根據Lipofectamine 2000說明書,siRNA和Lipofectamine 2000分別加入250 μL Opti-MEM培養液稀釋,室溫靜置5 min后輕輕混勻,再將500 μL混合物滴加至6孔板,轉染48 h后進行后續實驗。PSAT1-siRNA序列:正義5′-CGC CAAGAAGTTTGGGACTATAT-3′,反義5′-TATAGTCCC AAACTTCTTGGCT-3′。
1.2.4 CCK-8檢測細胞增殖活性 取對數生長期細胞,以2×103個/孔接種于96孔板,37℃、5%CO2條件培養箱中培養。分別于細胞培養24、48、72、96 h時向每孔中加入10 μL CCK-8試劑,繼續培養1.5 h,酶標儀讀取波長為450 nm的吸光度值,并通過吸光度值繪制細胞生長曲線。每組平行設置5個復孔,實驗重復3次,取平均值。
1.2.5 細胞劃痕實驗 取對數生長期細胞,以5×105個/孔接種于6孔板,加入不含血清的DMEM培養基培養至100%融合。用10 μL移液槍頭在細胞層劃“一”字劃痕,PBS沖洗3遍,再加入含胎牛血清的DMEM培養基繼續培養24 h,顯微鏡下觀察細胞遷移的距離,并計算細胞遷移率。
1.2.6 Transwell侵襲實驗 細胞用不含血清培養基稀釋,計數,配成細胞懸液;將1×105個細胞溶于100 μL DMEM培養液,置于Transwell上室,下室中加入800 μL含有10%FBS的條件培養基。37℃孵育24 h,取出上室,用PBS洗2遍,5%戊二醛4℃固定。加入0.1%結晶紫染色,室溫染色10 min,PBS洗2次,用棉球擦去上表面細胞,顯微鏡下取5個隨機視野計穿過濾膜的細胞數,統計結果。
1.2.7 Western blot待細胞生長至80%~90%融合時,加入RIPA裂解液充分裂解細胞,提取總蛋白,并利用BCA試劑盒進行蛋白定量。30 μg總蛋白用SDS-PAGE凝膠電泳分離,電轉至PVDF膜,然后加入含有5%脫脂奶粉的TBST液室溫封閉1.5 h,PBS沖洗 2 遍,加入 PSAT1(1:200)、Akt(1:500)、mTOR(1:300)、p-Akt(1:1 000)、p-mTOR(1:1 000)、GAPDH(1:1 000)一抗,4℃孵育過夜。次日PBS沖洗3遍,加入辣根過氧化物酶(HRP)標記山羊抗鼠二抗(1:1 000)室溫孵育1h,PBS洗滌后ECL顯影,以GAPDH為內參,Image J掃描蛋白灰度值。目的蛋白相對灰度值=目的蛋白灰度值/GAPDH灰度值,結果以實驗組相對灰度值/正常對照組相對灰度值表示實驗組蛋白相對表達量。
1.3 統計學方法
使用SPSS 19.0軟件、GraphPad Prism 7.0軟件和和Adobe Photoshop CS 6軟件進行數據和圖形處理。計數資料用百分比表示,χ2檢驗分析PSAT1表達與胰腺癌患者臨床資料的關系。計量資料用x±s表示,多組間比較采用單因素方差分析(One-way ANOVA),兩組間比較采用Student′st檢驗。Kaplan-Meier法繪制胰腺癌患者生存曲線,各組間生存率比較采用Log-rank法;多因素采用Cox比例風險模型。以P<0.05表示差異具有統計學意義。
2 結果
2.1 胰腺癌組織和癌旁組織PSAT1表達
PSAT1表達主要定位于細胞質或細胞漿,PSAT1在胰腺癌組織中陽性表達率為69.4%(68/98),明顯高于癌旁組織5.0%(5/98),兩者比較差異具有統計學意義(χ2=86.638,P<0.001,圖1)。
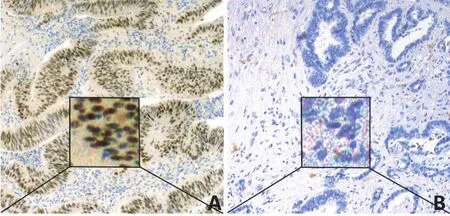
圖1 胰腺癌組織和癌旁組織中PSAT1表達
2.2 PSAT1表達與胰腺癌臨床資料的關系
98例胰腺癌患者中,PSAT1表達陽性率與淋巴結轉移、TNM分期有關(P<0.05),與年齡、性別、分化程度、腫瘤位置、神經侵犯等無關(P>0.05,表1)。
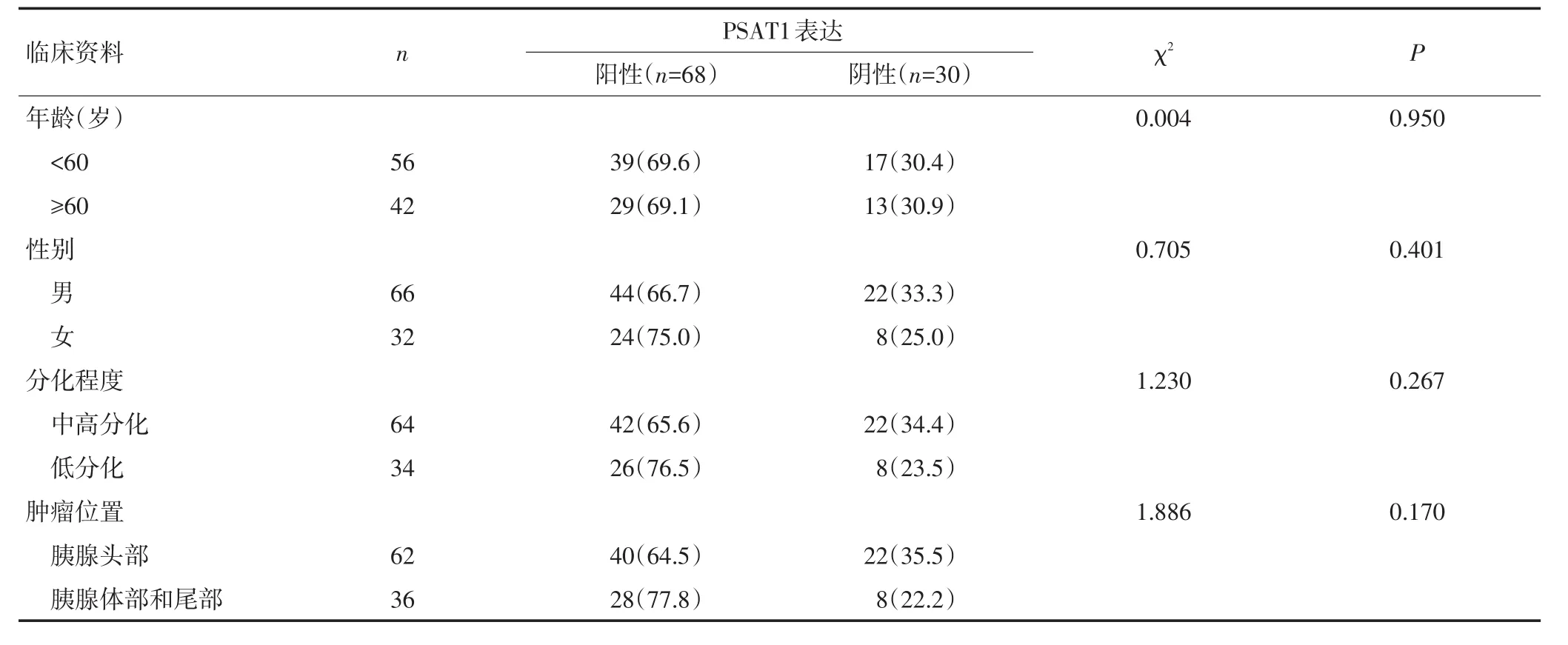
表1 PSAT1表達與胰腺癌臨床資料的關系 n(%)
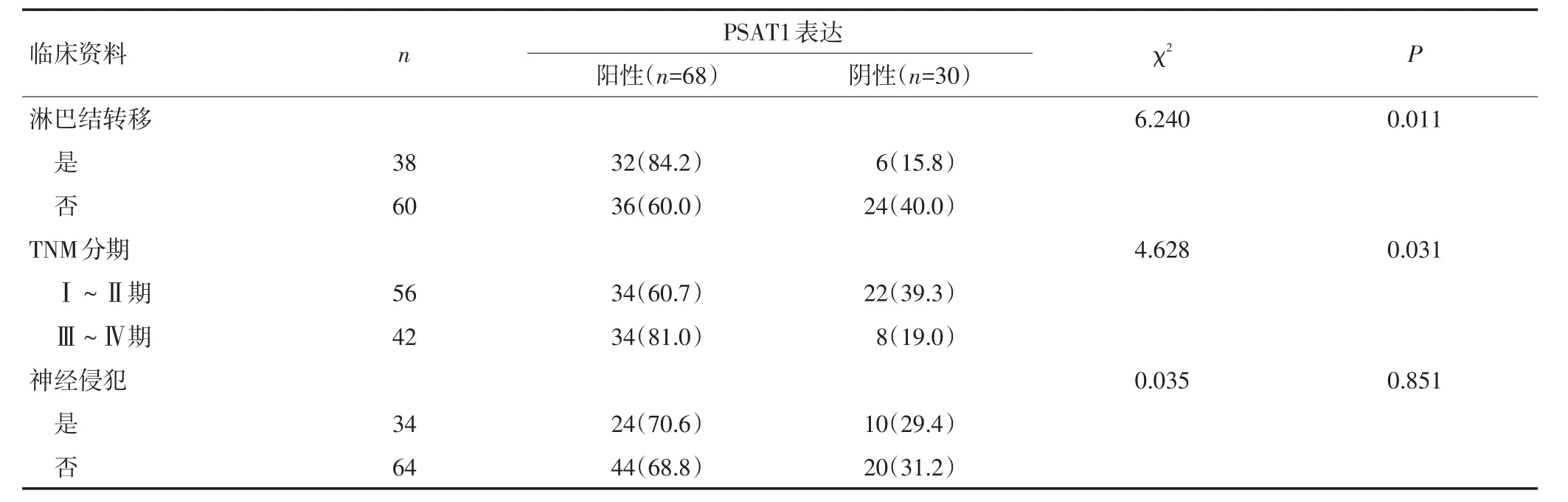
表1 PSAT1表達與胰腺癌臨床資料的關系 n(%)(續表1)
2.3 PSAT1表達與胰腺癌預后的關系
生存分析結果顯示,PSAT1高表達的胰腺癌患者總生存期和無病生存期明顯低于PSAT1低表達患者(P<0.05,圖2)。Cox多因素回歸顯示,PSAT1表達是影響胰腺癌總生存的危險因素(P<0.05),PSAT1表達同時也是影響胰腺癌無病生存的危險因素(P<0.05,表2)。
2.4 抑制PSAT1表達對胰腺癌細胞增殖的影響
由圖3A可見,胰腺癌細胞系BxPC-3、PANC1、SW1990中PSAT1蛋白表達明顯高于AR42J細胞(P<0.05);其中PSAT1蛋白在BxPC-3、SW1990細胞中表達最高(2.17±0.18和2.28±0.20),因此選擇BxPC-3、SW1990細胞進行后續功能學實驗。向BxPC-3、SW1990細胞轉染PSAT1-siRNA后,PSAT1-siRNA組PSAT1蛋白表達顯著低于NC-siRNA組(P<0.05,圖3B,3C),說明siRNA可以顯著降低BxPC-3、SW1990細胞PSAT1表達。CCK-8實驗結果顯示,隨著實驗的延長,PSAT1-siRNA組細胞增殖速度減慢,在第72 h和96 h時,PSAT1-siRNA組細胞增殖率明顯低于NC-siRNA組(P<0.05,圖3D,3E),
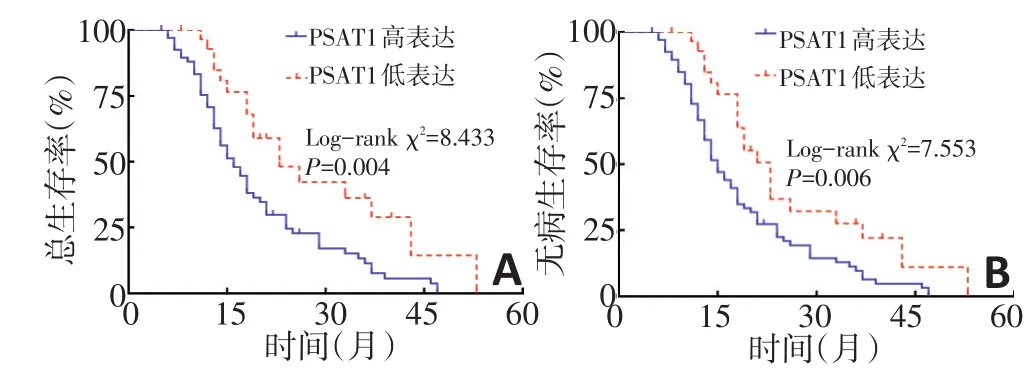
圖2 不同PSAT1表達胰腺癌患者總生存曲線和無病生存曲線
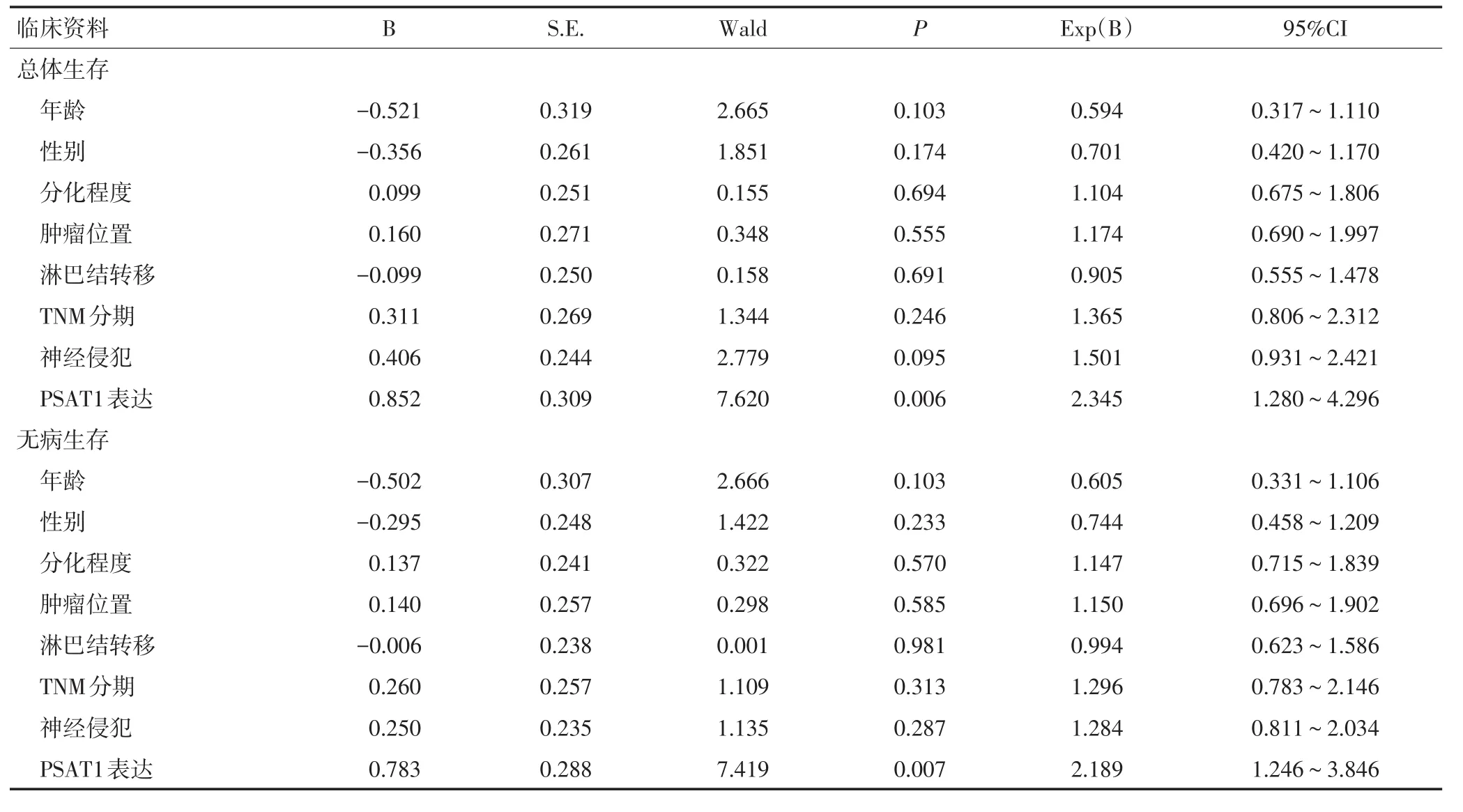
表2 Cox多因素分析影響胰腺癌總生存期和無病生存期的獨立危險因素
2.5 抑制PSAT1表達對胰腺癌細胞遷移和侵襲的影響
細胞劃痕實驗結果顯示,與NC-siRNA組比較,轉染PSAT1-siRNA后BxPC-3、SW1990細胞相對遷移距離顯著縮短,差異具有統計學意義(P<0.05,圖4A,4B)。Transwell侵襲實驗結果顯示,PSAT1-siRNA組侵襲細胞數明顯低于NC-siRNA組,差異具有統計學意義(P<0.05,圖4C,4D)。
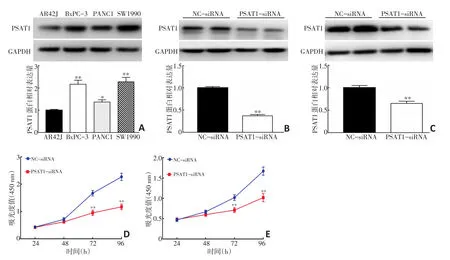
圖3 抑制PSAT1表達對胰腺癌細胞增殖能力的影響
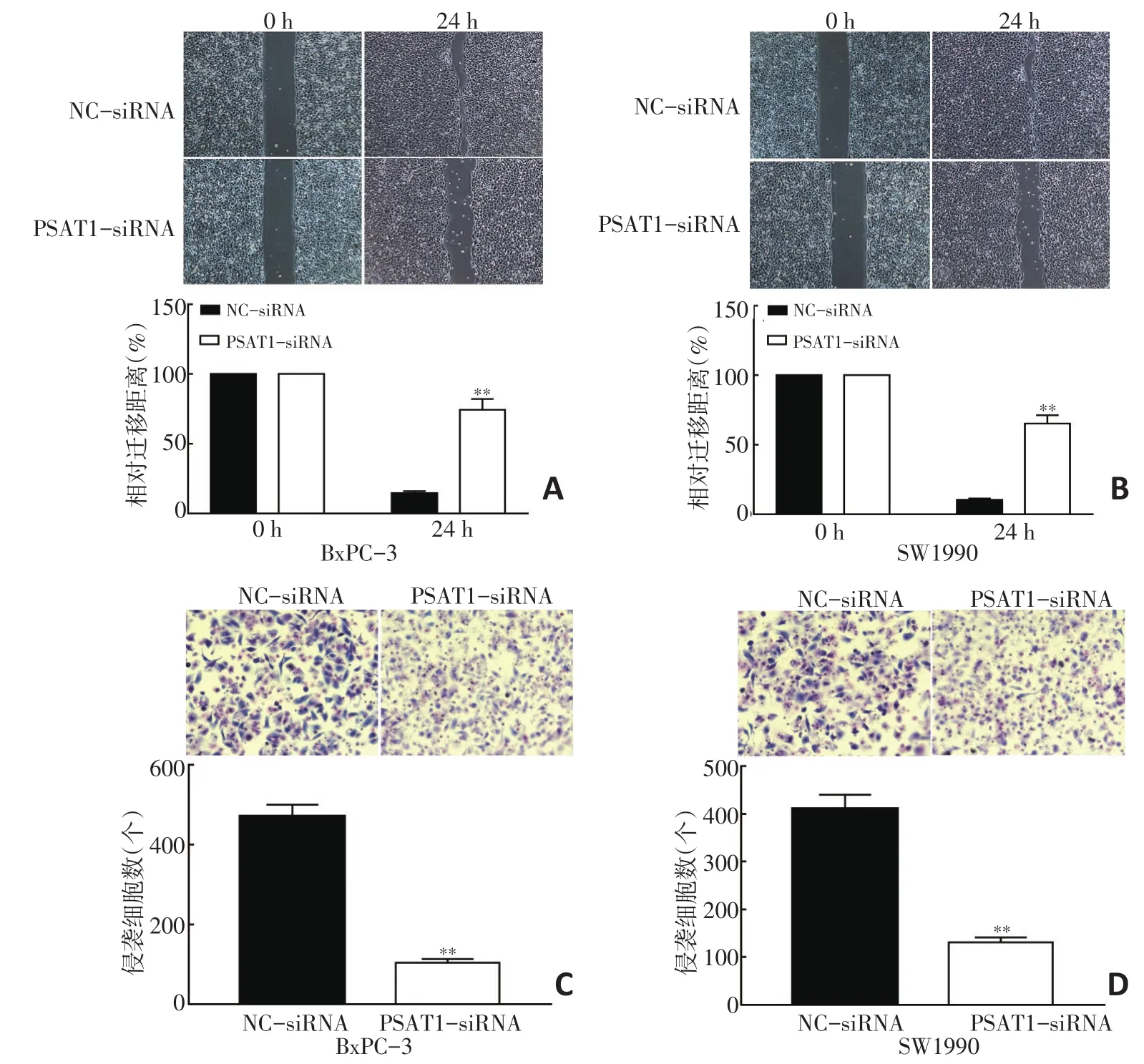
圖4 抑制PSAT1表達降低胰腺癌細胞遷移和侵襲能力
2.6 抑制PSAT1表達對胰腺癌細胞PI3K/Akt/mTOR通路相關蛋白表達的影響
本研究利用Western blot檢測BxPC-3和SW1990細胞PI3K/Akt/mTOR通路重要蛋白:Akt、mTOR蛋白及其活化形式p-Akt、p-mTOR的變化,結果顯示,與NC-siRNA組相比,PSAT1-siRNA組p-Akt、p-mTOR蛋白表達顯著降低(P<0.05,圖5)。
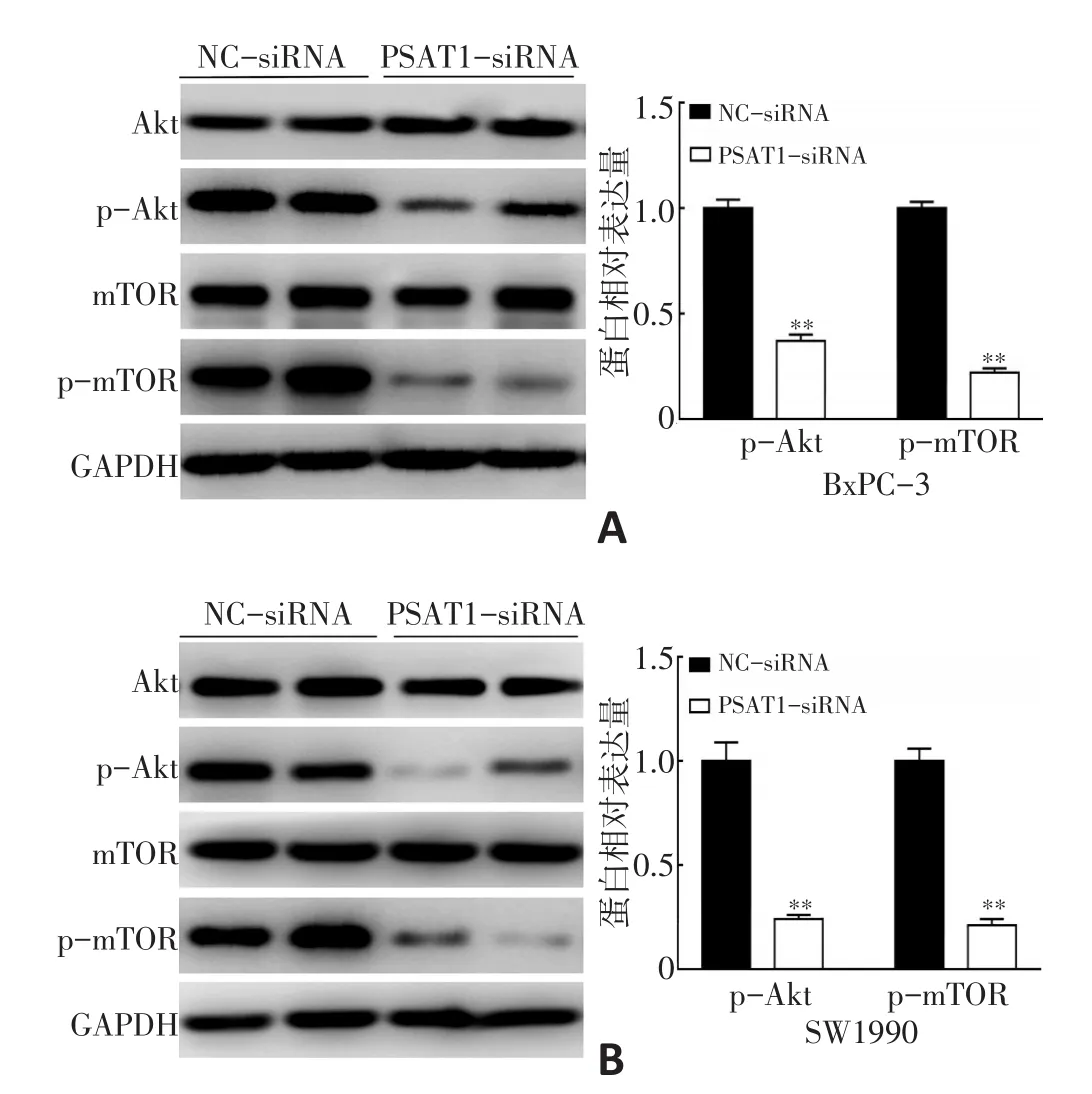
圖5 抑制PSAT1表達對胰腺癌細胞Akt、mTOR蛋白表達的影響
3 討論
代謝變化是腫瘤細胞典型特征之一,低效能的糖酵解途徑(Warburg效應)為腫瘤細胞提供了大量的碳源,從而滿足腫瘤快速生長的需要[10]。糖酵解途徑還可以避免產生自由基,使腫瘤細胞逃避凋亡。因此,在糖酵解過程中發揮關鍵作用的代謝酶有望成為腫瘤診療的潛在靶點。PSAT1是磷酸丙酮酸氨基酸轉移酶編碼基因,在糖酵解中發揮重要作用。PSAT1是催化磷酸絲氨酸合成的限速酶,通過糖酵解3-磷酸甘油酸酯生成3-磷酸丙酮酸,將糖酵解產物引入絲氨酸合成途經,并為細胞提供原料和能量[11]。Qian等[12]報道PSAT1在結直腸癌組織中高表達,并且與腫瘤細胞對伊立替康、5-氟尿嘧啶和亞葉酸鈣的敏感性有關。Gao等[13]也證實PSAT1通過調節ATF4促進乳腺癌細胞增殖,且高表達PSAT1與雌激素受體陰性乳腺癌不良預后有關。
Song等[14]證實糖酵解途徑中另外一個關鍵酶磷酸甘油酸脫氫酶(PHGDH),與胰腺癌異常增殖和不良預后有關。基于此,推測PSAT1可能也參與了胰腺癌的多種生物學行為。為了驗證此假設,本研究首先利用免疫組織化學染色檢測胰腺癌組織和癌旁組織PSAT1表達,結果顯示PSAT1在胰腺癌組織中陽性表達率明顯高于癌旁組織,同時胰腺癌細胞PSAT1表達也高于胰腺細胞,說明胰腺癌中PSAT1異常表達。進一步分析發現,高表達PSAT1與胰腺癌腫瘤體積、淋巴結轉移和TNM分期有關,提示PSAT1有作為早期診斷胰腺癌的價值。Liu等[15]報道PSAT1表達升高常提示發生食管鱗狀細胞癌風險升高,并且PSAT1持續高表達可以作為患者不良預后的預測指標。Liao等[16]研究發現PSAT1表達與鼻咽癌瘤體體積、TNM分期、分化程度有關,與PSAT1低表達者比較,PSAT1高表達鼻咽癌患者局部無復發生存率、無遠處轉移生存率、疾病特異生存率和總體生存率均顯著縮短。本研究對胰腺癌患者進行隨訪,結果發現SAT1高表達的胰腺癌患者總生存期和無病生存期明顯低于PSAT1低表達患者,PSAT1表達是胰腺癌總體生存和無病生存的危險因素。上述結果說明胰腺癌組織PSAT1表達與胰腺癌發生和不良預后有關,PSAT1有望成為胰腺癌診斷和預后的評估指標。
Singh等[17]研究發現,復發性乳腺癌中PSAT1的高表達與細胞內絲氨酸水平呈正相關,沉默PSAT1表達可以降低絲氨酸水平,進而抑制細胞的生長和增殖。本研究利用siRNA技術沉默胰腺癌BxPC-3、SW1990細胞PSAT1表達,結果發現PSAT1基因沉默后,胰腺癌細胞增殖速度明顯減慢,遷移和侵襲能力明顯減弱,說明PSAT1與胰腺癌生長和遠處轉移有關。Hwang等[18]報道腫瘤細胞依靠絲氨酸生物合成途經為細胞快速增殖提供原料,抑制PSAT1可以阻斷絲氨酸合成,導致細胞能量和原料供應不足,細胞分裂周期阻滯,最終引起細胞凋亡。Yang等[19]證實PSAT1基因沉默可以使非小細胞肺癌細胞周期調節蛋白cyclin D1降解,細胞分裂被阻滯于G0/G1期,最終抑制細胞增殖。
目前對PSAT1的研究尚處于起始階段,其對腫瘤生物學行為的調控作用及相關機制仍未闡明。PI3K/Akt/mTOR通路是一條經典信號通路,在調節糖原代謝、細胞增殖中發揮重要作用[20]。研究顯示[21],激活PI3K/Akt/mTOR通路能顯著提高細胞的糖酵解水平,而PI3K抑制劑LY294002呈濃度、時間依賴性的抑制胃癌細胞增殖。在PI3K/Akt/mTOR通路中,活化的PI3K能激活下游關鍵蛋白Akt,使Akt作用其底物mTOR作用,完成調控細胞代謝、增殖和凋亡等作用[22]。Sharma等[23]報道胰腺癌細胞p-PI3K、p-Akt和p-mTOR蛋白表達明顯上調,Mitofusin2可以通過抑制PI3K/Akt/mTOR信號通路誘導胰腺癌細胞自噬和線粒體融合。本研究對轉染PSAT1-siRNA的BxPC-3、SW1990細胞PI3K/Akt/mTOR通路相關蛋白表達進行分析,結果顯示與NC-siRNA組相比,PSAT1-siRNA組p-Akt、p-mTOR蛋白表達顯著降低,提示沉默PSAT1可以抑制PI3K/Akt/mTOR通路的活性,PSAT1可能通過調節PI3K/Akt/mTOR通路參與胰腺癌細胞的增殖和侵襲。
綜上所述,PSAT1在胰腺癌組織和細胞中呈高表達,PSAT1可能通過調節PI3K/Akt/mTOR通路參與胰腺癌細胞的增殖和侵襲。胰腺癌發病機制復雜,本研究僅單純觀察了PSAT1的變化,是否同時存在其他代謝基因改變尚不清楚。另外本組研究的樣本量偏少,特別是分層之后更少,使得在臨床觀察中存在偏倚結果的可能。接下來的工作中,我們將進一步研究PSAT1對胰腺癌診療的意義以及相關的調控機制。

