產油脂微藻的分離、鑒定及篩選
涂澤敏,吳芳燕,羅劍飛,林煒鐵
(華南理工大學生物科學與工程學院,廣東廣州 510006)
生物質能是可再生能源的重要組成部分。隨著世界經濟的快速發展,能源緊缺問題和環境污染問題日益嚴峻,研究生物質能源開發利用可以緩解環境壓力,對解決能源、生態環境問題將起到十分積極有效的作用[1]。微藻是制備生物柴油的理想原料,具有生長迅速、能夠實現大規模養殖的優點[2]。伴隨著燃料乙醇和生物柴油等第一代生物質能被不斷消耗利用,以及以麥稈等農林廢棄物為主要原料的第二代生物燃料面臨開發技術成本較高等問題,以微藻為原料的第三代生物質能將是更加有效的理性選擇,也是生物燃料未來必然的發展方向[3]。
微藻細胞中含有豐富的蛋白質、維生素和礦物質等,其細胞一些獨特的初級或次級代謝產物是生產藥品、精細化學品和新型燃料的潛在資源[4]。某些微藻中富含的多不飽和脂肪酸(PUFA)是合成機體內多種功能物質的前體,如微擬球藻中的EPA具有降血脂、降血壓、促進脂肪代謝等作用,可用于防治心血管疾病,對人體健康具有重要的作用[5~7]。然而由于微藻培養及其在制備生物柴油的過程中存在著資源消耗高、回報低,單一培養容易被害蟲和病原體入侵等問題,這些都大大限制了微藻生物燃料的商業化應用。當前能源微藻想要實現規模化培養,總的來說主要面臨著生物質資源供應不足和生產成本過高的困難,尤其是高成本問題,嚴重制約著其大規模開發應用[8]。因此研究提高微藻產油能力,提高光生物反應器效率,通過基因工程改造微藻提高產油能力等仍然是研究者們努力的方向[9,10]。
本研究從廣州東湖自然水體中篩選鑒定出一些微藻,并研究其生長及油脂積累特性,期望篩選出油脂積累較高的藻類以便后續進一步研究,同時也為該水域是否潛在富油微藻提供一定依據。
1 材料與方法
1.1 實驗材料
主要試劑與儀器:二甲基亞砜(DMSO)、尼羅紅溶液(2 g/L尼羅紅母液,稀釋 100倍使用)、DL2000Marker,購于Zomanbio公司;植物基因組提取試劑盒,TAKARA;LRH-150生化培養箱、Infinite?200多功能酶標儀、Eppendorf 5804R冷凍離心機。
樣本采集:含藻種的樣本采自廣州華南理工大學校內東湖,共設置2個采集點,采集水樣用采樣瓶裝好,分離純化在實驗室中進行。
培養基:培養分離均采用BG-11培養基,其中分離在BG-11固體培養基中進行,分離后純培養及后續培養在液體BG-11中進行。
1.2 試驗方法
1.2.1 藻株富集與分離純化
分別采集東湖兩側表面、底部水樣各一份,將采集水樣在布氏漏斗中用中速定性濾紙進行抽濾,然后將表層濾液及底層濾液分別以7%和5%接種量接種于BG11培養基中。一周后將培養基中的藻液再次轉接至BG11培養基中培養。
取少量梯度稀釋藻液接種于BG11固體培養基中劃線培養,待平板中長出不同形態單菌落后將其分別接種于新的固體平板中培養,直至平板中長出單一穩定的菌落,后挑取單菌落接種于液體培養基中培養用于后續實驗。
1.2.2 藻株顯微觀察
取純培養的藻液20 μL置于無菌載玻片上,用結晶紫染色固定后在光學顯微鏡下觀察微藻形態特征。參考《中國淡水藻類-系統、分類及生態》對微藻進行初步分類鑒定。
1.2.3 藻株18S rDNA測序與進化樹構建
18S rDNA基因提取與測序:離心收集對數期藻細胞,用植物基因組試劑盒提取基因組總DNA,電泳跑膠驗證后進行PCR擴增。PCR反應體系(25 μL)為:基因組DNA 1 μL,上下游引物各0.5 μL,2×Taq MasterMix 12.5 μL,ddH2O 10.5 μL。PCR反應程序為94 ℃預變性5 min,94 ℃變性1 min,53 ℃退火1 min,72 ℃保留1 min,程序共設置30個循環,最后72 ℃延伸10 min。
用于擴增18S rDNA的引物序列為:18s-F:5’-GTA GTCATATGCTTGTCTC-3’;18s-R:5’-TCCGCAGGTT CACCTACGGA-3’。PCR產物測序由廣州艾基生物技術有限公司完成。
藻株進化樹的構建:將測序序列在NCBI數據庫中進行BLAST同源性比對分析,下載相關序列,使用MEGA7.0軟件,采用鄰接法構建藻株進化樹。
1.2.4 藻株生物量的測定
培養過程中生物量變化情況以葉綠素含量及光密度-干重曲線來反應。培養條件為溫度(30 ℃),光照強度(~4000 lux),光照周期(12 h:12 h)。培養過程中,小球藻采用細胞計數法與葉綠素含量測定來衡量生物量積累情況,柵藻則通過葉綠素含量測定來衡量。
葉綠素含量測定:取1 mL藻液,12000 r/min離心棄上清,加入200 μL蒸餾水混勻,再加入1800 μL 95%無水乙醇,混勻后75 ℃水浴5 min,冷卻后在波長649 nm、665 nm、750 nm處測量吸光度。葉綠素含量計算公式如下:
葉綠素a和b=5.24×(A664-A750)+22.24×(A649-A750)
OD-干重關系:取不同濃度的藻液,測定其在680 nm處的吸光度值,然后取10 mL藻液分次置于2 mL已烘干至恒重的EP管中離心,后置于60 ℃烘箱中烘干至恒重,轉移至干燥器內冷卻,準確稱量記錄重量。以波長680 nm處測得OD值為橫坐標,測量得到的細胞干重為縱坐標建立OD680-細胞干重關系,得到6株藻回歸方程如表1:

表1 微藻OD680-細胞干重相關性方程Table 1 Correlation equation between OD680 and dry weight of algal
1.2.5 微藻油脂含量的測定
油脂測量標準曲線的建立:采用尼羅紅熒光染色法[11],以三油精為標準品,以三油精含量為縱坐標,平均檢測熒光值為橫坐標建立三油精-熒光值標準曲線如圖 1。該圖呈較好的線性關系,表明可以通測量尼羅紅染色熒光值來間接測定藻細胞胞內中性油脂含量。

圖1 三油精含量-熒光值標準曲線Fig.1 The standard curve between triolein content and fluorescence value
微藻油脂含量測定:取適量藻液稀釋,調節使體系OD680=0.1。然后取1.5 mL稀釋藻液,加入480 μL DMSO,20 μL 150 μg/mL 尼羅紅染液,混勻后于 45 ℃水浴3 min,以480 nm為激發波長,580 nm為吸收波長測定熒光值。由標準曲線計算得到油脂含量。油脂百分比及油脂產量計算公式如下:

1.2.6 數據統計分析
標準曲線制作,細胞生物量及油脂含量測定均進行三次平行重復,數據匯總后以SPASS 22.0(IBM Co.Ltd)軟件進行相關性分析,后利用Origin Pro 2016對數據進行整理作圖。
2 結果與討論
2.1 微藻的分類鑒定
光學顯微鏡觀察:光學顯微鏡下觀察藻細胞形態,結合參考《中國淡水藻類-系統、分類及生態》對微藻進行初步分類鑒定。顯微觀察下觀察到藻株 DH1、DH2、DH6呈綠色球狀,DH3、DH4、DH5則為橢圓狀,且均不同程度上伴有叢生現象,由圖2可看到DH3明顯伴有對生現象。
分子鑒定:提取藻株基因組DNA,利用特異性引物進行PCR擴增得到微藻18S rDNA片段,由圖3可得,該片段大小約為1800 bp。
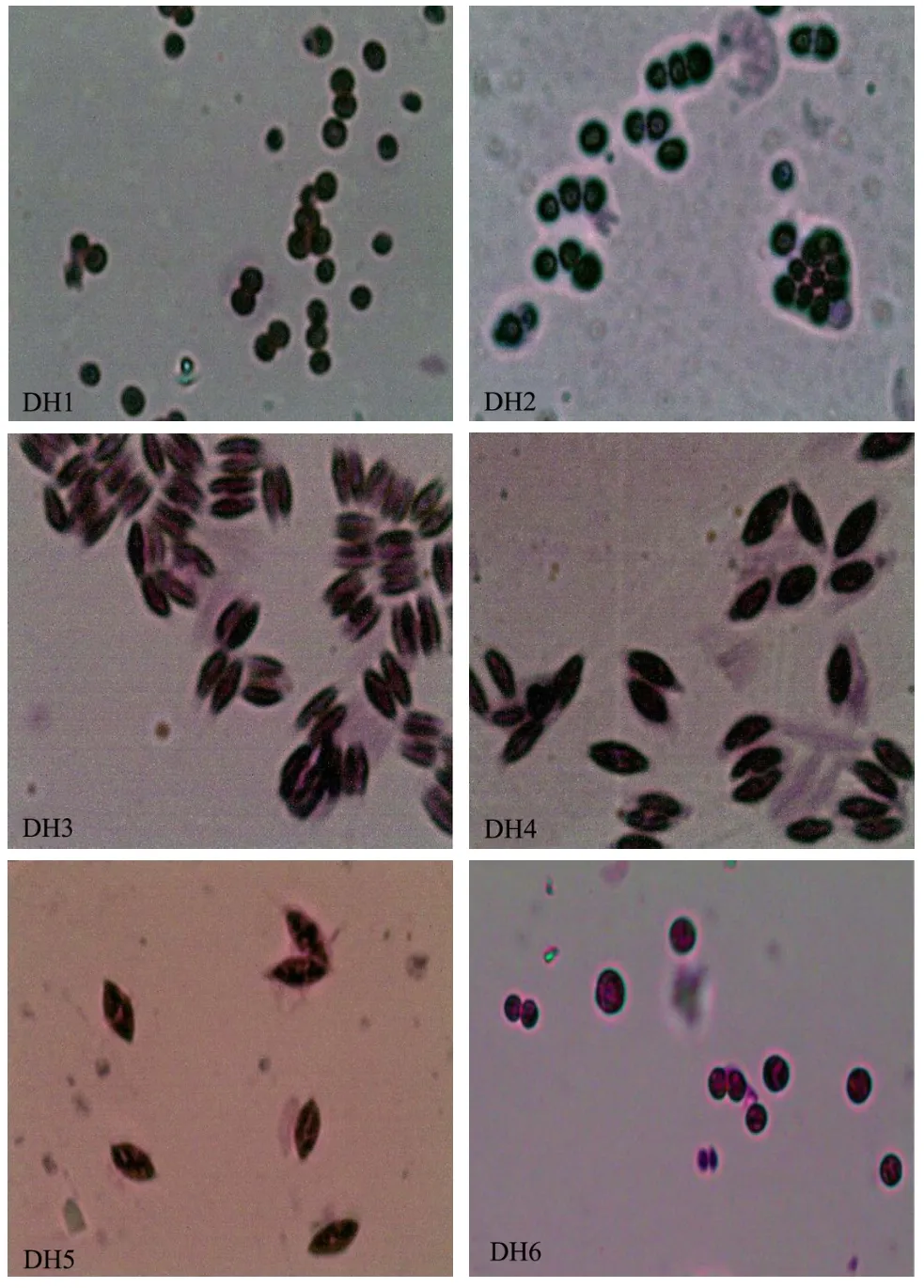
圖2 光學顯微鏡下微藻形態特征(x100)Fig.2 Morphology of six algae in optical microscope (x100)
對 PCR產物測序,并在 NCBI數據庫中進行BLAST同源性比對分析,進一步構建系統發育樹如圖4。結果表明DH1、DH2、DH6與Chlorellasp.18S rDNA同源性達到99%,DH3、DH4、DH5與柵藻屬親緣關系最近,其與多株柵藻的18S rDNA的序列同源性達到99%,確定其都為柵藻屬。

圖4 藻株18S rDNA序列系統發育樹Fig.4 18S rDNA sequencephylogenetictreeofalgae
張翼等從青島海水和武漢南湖水中篩選分離出11株小球藻和1株膠網藻[12],黃秋婷等從吉林工學院荷花池中篩選分離出4株柵藻和1株小球藻[13]。本研究從華南理工大學校內東湖中篩選分離到6株綠藻,18S rDNA鑒定結合采樣點篩選分離結果表明這6株微藻分別屬于小球藻屬與株柵藻,其中 DH1、DH6和DH3分別篩自采樣點1表層水樣和底層水養,DH4和DH2、DH5分別篩自采樣點2表層和底層水養,不同取樣點的篩選結果差異可能與不同藻株的生長習性有關。
2.2 微藻生長及油脂積累特性研究
2.2.1 微藻生物量的測定
生物量是衡量微藻產業化的重要條件之一。而葉綠素是海洋微藻光合作用的基礎,是描述海洋微藻將無機物質轉變為有機物質能力的一個重要指標,可以作為衡量生物量積累的參考[14]。6株微藻的生長情況如圖5所示。
從圖中可知,小球藻和柵藻都能很好地在 BG11培養基中適應并快速生長,在最初的1~3 d內沒有明顯的生長停滯現象,SPASS統計學分析顯示小球藻之間(DH1、DH2、DH6)、柵藻之間(DH3、DH4、DH5)生物量差異顯著(p<0.05)。三株小球藻細胞數基本在12~15 d達到最高,之后開始出現下降,其中DH6細胞濃度相對于DH1和DH2來說在培養15 d后達到最高,為 2.74×107/mL,之后出現明顯下降。小球藻葉綠素含量均在培養至15 d后達到最高,然后開始下降,同樣地,DH6葉綠素含量15 d后達到最高,為10.97 mg/L。15 d后細胞數與葉綠素含量均呈現下降,此時微藻細胞逐漸進入衰亡期,生長代謝緩慢。三株柵藻葉綠素含量在18 d后達到最高,且葉綠素含量普遍高于小球藻,最高的柵藻DH5可達16.16 mg/L。

圖5 藻細胞生物量積累曲線Fig.5 Biomass curves of microalgae species
2.2.2 微藻油脂積累研究
油脂積累量是衡量篩選微藻能否大規模應用于微藻柴油開發的最重要指標,本文通過對東湖水體中微藻的培養,希望可以篩選出潛在的富油微藻,以便進一步研究探討。BG11培養基中培養25 d后收集藻細胞,測量OD680及尼羅紅染色熒光值得到胞內中性油脂含量,整理如圖6。
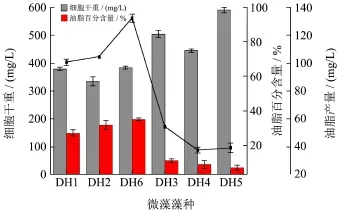
圖6 微藻油脂產量比較Fig.6 Comparison of microalgae oil yields
由圖6可知,小球藻細胞干重普遍低于柵藻,然而油脂產量及藻細胞油脂百分含量卻比柵藻高,SPASS統計學分析顯示6株微藻細胞干重與油脂產量之間均差異顯著(p<0.05),其中油脂產量及油脂百分比最高的為DH6,其產量達到131.69 mg/L,其次為DH2,油脂產量達到103.89 mg/L,且這兩株藻細胞油脂百分比均在30%以上,分別為34.54%和31.33%。DH1產量低于DH2和DH6,其油脂產量為100.06 mg/L,油脂百分比為 26.60%。柵藻中,DH3油脂產量及油脂百分比均高于另外兩株,其數值分別為58.73 mg/L和10.73%,另外兩株柵藻藻細胞油脂百分比均低于10%,最低的為DH5,僅為6.56%。由此可知,微藻生物量的積累與油脂積累并沒有直接的關系,生物量積累較高不一定積累大量油脂,生物量低卻反而可能較好地積累油脂。與其他一些研究工作相比,本研究篩選出的2株小球藻產油能力處于中等水平,如孫漫等從海南島周圍水域篩選出105株海洋微藻,其中33株微藻油脂產量較高,最高的藻株XG01油脂產量達到221.9 mg/L,油脂百分含量達到38.93%[15];郭建東等人在淮坊不同生境中篩選出19株產油微藻,其中有8株超過30%,兩株超過40%[16];王玉榮等人從東北地區篩選分離出 14株產油微藻中有兩株高于40%[17,18]。本研究篩選得到的小球藻DH2及DH6在普通BG11培養基中可積累一定的油脂,后期通過營養條件及培養條件的優化有可能進一步提高其油脂產量,兩者可以選作為微藻柴油研發的潛在藻種。
3 結論
3.1 作者通過對廣州華南理工東湖自然水體的篩選,共得到6株綠藻。6株綠藻通過光學顯微鏡觀察及基因檢測得知它們分別為3株小球藻和3株柵藻。培養得知該6株藻種均能在BG11培養基中較好生長。
3.2 一般來說,微藻生長與油脂積累存在矛盾關系,油脂大量積累通常發生在細胞分裂受阻即藻細胞生長收到抑制時,而生物量的積累通常與藻種、培養基營養條件、培養模式等有關[19~21]。以增加微藻生物量為基礎提高藻細胞油脂含量,即同時提高微藻生物量與油脂產量,這是微藻生物柴油發展必須解決的問題[22]。分析本研究中微藻生物量及油脂積累情況可知,有些微藻生物量雖高卻不能很好地積累油脂,如DH5,其葉綠素含量培養21 d后在所有微藻中最高,達到16.16 mg/L,且25 d藻細胞干重也為最高,達到587.71 mg/L,然而其油脂百分比僅為6.56%;有些藻種雖然生物量低,卻能有效地積累油脂,如DH2,葉綠素含量最低,僅為9.54 mg/L,油脂百分含量卻能達到31.33%。因此應該綜合考慮生物量與油脂產量來權衡微藻的生長產油效率微藻產油能力與培養基營養條件和培養環境,以及缺氮等有關,不同條件下產油效果都會有所不同[23]。后續擬展開相關工作進一步研究提高其產油效率。該研究取樣于華南理工校內東湖,之前未有人做過該水體微藻相關研究,因此本結果將為也為該水體微藻研究以及中國湖泊微藻研究提供一定參考和借鑒。

