遠隔缺血適應干預對動脈瘤性蛛網膜下腔出血患者凝血功能的影響
齊猛,徐躍嶠,王寧,蔣麗丹,陳文勁,曲鑫,程瑋濤
缺血預適應(ischemic preconditioning,IPC)由Charles E. Murry等[1]于1986年提出,指預先給予一個器官短暫、非致死性的輕度缺血處理后,會對以后致死性的缺血產生耐受。1993年,Karin Przyklenk等[2]提出了遠隔器官缺血預適應(remote ischemic preconditioning,RIPC),即一個器官的短暫缺血會誘導另一個器官的缺血適應。近年來動物實驗及臨床研究發現,遠隔缺血適應(remote ischemic conditioning,RIC)對包括心臟和腦在內的缺血性卒中具有保護作用,目前已成為卒中治療的研究熱點[3-4]。本研究擬探討RIC對動脈瘤性蛛網膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)患者凝血功能的影響。
1 研究對象與方法
1.1 研究對象 本研究通過首都醫科大學宣武醫院倫理委員會審核,前瞻性設計連續納入本院神經外科重癥監護病房2017年11月-2018年5月收治入院的24例aSAH患者,對患者進行RIC干預,并在干預前后抽取靜脈血行凝血功能檢驗,包括凝血酶原活動度(prothrombin activity,PTA)、凝血酶原時間(prothrombin time,PT)、活化部分凝血活酶時間(activated partial thromboplastin time,APTT)、國際標準化比值(international normalized ratio,INR)、纖維蛋白原(fibrinogen,Fib)、D-二聚體及血栓彈力圖(thromboelastogram,TEG)(包括R、K、Angle、MA、EPL、LY30、A、CI、G、A30),血管超聲評估RIC干預側深靜脈血栓(deep venous thrombosis,DVT)是否發生。
1.2 納入和排除標準 納入標準:①年齡18~75歲;②腦血管造影證實顱內動脈瘤,Hunt-Hess分級≤Ⅳ級;③本人或法定代理人同意參加本研究;④在發病48 h內入院,通過栓塞和(或)夾閉治療了責任動脈瘤;⑤納入時間在發病72 h內。排除標準:①未針對破裂的動脈瘤進行治療或無法治療;②伴有嚴重心血管疾病;③發病48 h后入院;④既往有腦梗死或術后24 h內計算機斷層掃描顯示腦梗死;⑤伴有肢體血管閉塞性疾病及其他無法耐受治療的疾病或狀況;⑥治療動脈瘤需要放置支架。
1.3 干預方式和數據采集 所有RIC干預均在患者常規治療下進行,在aSAH后72 h內接受動脈瘤夾閉和栓塞治療后至10 d內,7 d內進行5次RIC干預(注:所有干預均在aSAH后10 d內進行,但均在7 d內完成干預),采用血壓袖帶加壓,給予肢體180 mm Hg壓力(若患者收縮壓>180 mm Hg,則加壓為患者收縮壓以上20 mm Hg),每次干預5個周期,每周期包括5 min加壓充氣,直至遠端動脈搏動消失,5 min放氣再灌注。干預期間常規監測患者血壓、心率、呼吸變化,對于意識清楚患者進行疼痛視覺模擬評分,如患者不能耐受,則終止干預,患者退出該治療干預方案。
1.4 統計學處理 使用SPSS 17.0統計軟件進行數據處理與分析,計數資料采用百分率(%)表示,計量資料以表示,組間比較采用配對t檢驗,以P<0.05為差異有統計學意義。
2 結果
24例aSAH患者中男9例,女15例,年齡36~73歲,平均(55.5±9.0)歲;根據Hunt-Hess分級,Ⅱ級11例,Ⅲ級9例,Ⅳ級4例;責任動脈瘤包括后交通動脈瘤7例,前交通動脈瘤6例,大腦中動脈瘤5例,脈絡膜前動脈瘤4例,小腦后下動脈瘤1例,大腦前動脈瘤1例;根據治療方式,開顱手術12例,介入治療12例,所有患者圍手術期均未使用抗血小板藥物或抗凝治療。
凝血檢驗結果顯示,RIC干預前后,患者APTT和D-二聚體無顯著性變化,PTA在干預后下降(t=3.171,P=0.004),PT(t=-2.581,P=0.017)、INR(t=-3.309,P=0.003)和Fib(t=-2.304,P=0.031)在干預后略有升高,但其平均值均在正常參考值范圍內(表1)。RIC干預前后,患者TEG參數中僅MA略有升高(t=-2.173,P=0.040),但仍在正常參考值范圍內,其他參數R、K、Angle、EPL、LY30、A、CI、G、A30均無顯著性變化(表2)。RIC干預前后,患者均未見加壓肢體DVT發生。
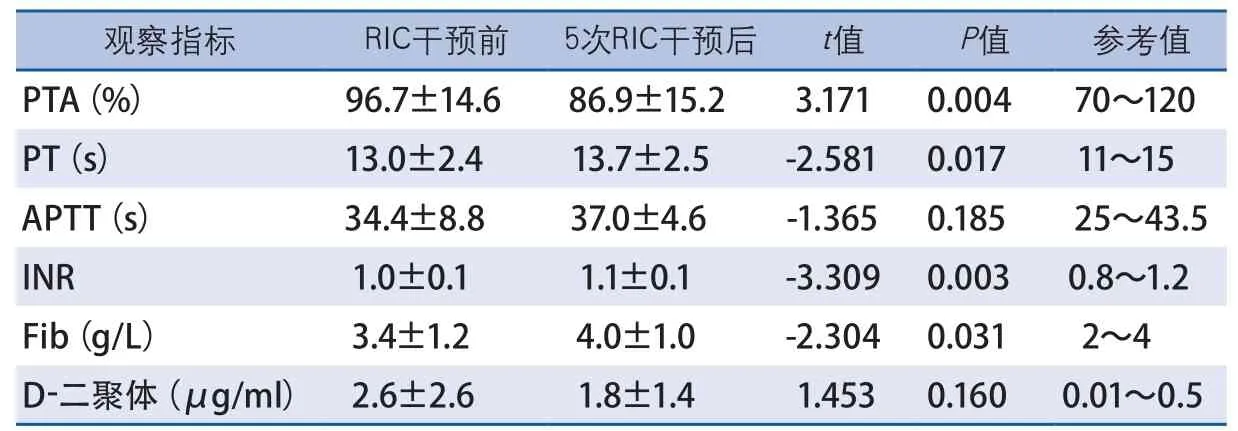
表1 RIC干預對aSAH患者凝血功能的影響
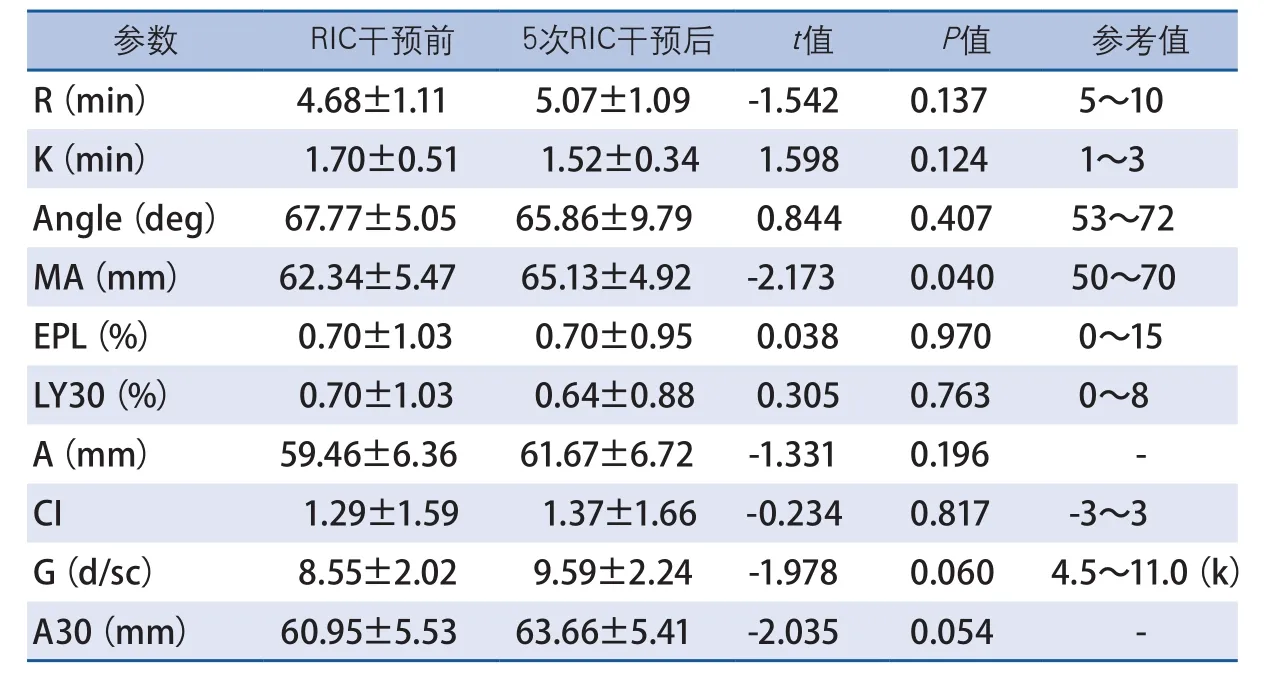
表2 RIC干預對aSAH患者TEG的影響
3 討論
有研究提示,RIC對遠隔組織器官的保護作用可能涉及多種機制、介質-受體-基因表達等多個環節[5]。近年來諸多基礎及臨床研究證實,RIC對心臟、肺、腎臟、肝臟、腸等多個靶器官具有保護作用[6-10],亦對缺血性腦損傷及缺血性脊髓損傷有神經保護作用,為缺血性腦與脊髓損傷提供了一種有前景的治療方式[11]。在缺血性腦血管病研究方面,Wenbo Zhao等[12]對重度動脈粥樣硬化性頸動脈狹窄患者在行頸動脈支架置入術前給予RIC治療,可通過改善機體炎性反應降低術后相關栓塞發生率,為進一步提高頸動脈支架置入術的安全性、降低遠期不良事件發生率提供了新的治療措施。對于顱內動脈粥樣硬化患者,使用血壓計加壓行短暫重復雙上肢缺血,可以改善腦灌注,減少卒中復發[13]。
RIC在出血性腦血管病中的研究尚不多,因蛛網膜下腔出血的研究起步較晚,需要深入探索。aSAH是一種臨床常見的急危重腦血管病,盡管只占卒中的5%[14],但發病年齡相對較輕(40~60歲為發病高峰),病情較其他類型卒中更加嚴重,是神經外科基礎和臨床研究的熱點之一。隨著影像診斷技術、顯微神經外科手術技術和介入治療技術及材料的不斷進步,aSAH的病死率在過去20年內下降近50%,并且仍在以每年0.9%的速度下降[15]。然而存活者的神經功能缺損卻沒有同步改善,約有2/3的患者遺留神經功能缺損。盡管單純解決了動脈瘤的再出血問題,但并不能徹底改善臨床預后。早期腦損傷是造成蛛網膜下腔出血患者不良結局的主要原因,蛛網膜下腔出血后繼發的腦血管痙攣、腦血管自動調節功能損傷、微血栓等多種因素造成的遲發性腦缺血損傷也是影響預后的重要因素。約30%的aSAH患者出現缺血性卒中癥狀,15%~20%的患者發生致殘性的腦梗死[16-17]。溶血產物、炎性反應、內皮細胞損傷等各種因素均參與aSAH后的病理過程,aSAH后腦血管痙攣、早期腦損傷及遲發性腦缺血的作用越來越受到重視[18]。而RIC在蛛網膜下腔出血后缺血性腦損傷發生前有治療的窗口期。有報道顯示,既往存在慢性缺血性腦血管病與aSAH后出現腦血管痙攣的關系,即既往存在“自然IPC”的患者造影顯示腦血管痙攣發生率下降。IPC對人確實存在保護急性缺血性腦損傷的作用[19]。而在不同疾病中RIC干預對患者的安全性需要進行相應的多方面評估,如本研究中對aSAH患者進行凝血功能的評估,RIC是否會增加患者加壓肢體DVT的發生率。只有在安全性得以保證的前提下,才有利于進一步開展有效性的評估,以及本干預措施在臨床中的推廣應用。
既往Fernando Mayor等[20]報道監測RIC對aSAH患者凝血功能影響的情況,21例aSAH患者在出血后2~12 d,每24~48 h接受1次RIC干預,所有患者均皮下注射低分子肝素預防DVT,監測每次RIC干預前后的PTT、PT、INR及出血并發癥,結果顯示每次干預前后差異均無統計學意義(9例),但在21例患者中至少4次RIC干預后,PTT和INR明顯延長,且與干預次數直接相關,但仍在正常參考值范圍內,且未引起再出血、腦實質內新發出血等出血并發癥,而年齡、性別相仿的對照組患者(同樣接受皮下注射低分子肝素治療)的PTT和INR相同隨訪期內無明顯變化。因此,該治療雖可直接作用于aSAH患者的外源性凝血途徑,但應用于aSAH患者時,對凝血功能的影響至少是安全的,而且這種輕度的抗凝作用可能通過抑制患者的高凝狀態發揮保護作用。該研究納入了Hunt-Hess Ⅴ級的蛛網膜下腔出血患者,為RIC在各個級別蛛網膜下腔出血患者中的應用提供了初步的經驗和凝血安全性的基礎。本研究結果顯示,即使患者在干預前后部分參數出現變化,但整體凝血功能仍大致在正常范圍內。此外,TEG檢測結果也進一步證實在干預前后RIC對患者的凝血功能無明顯影響。
Nestor R. Gonzalez等[21]發表了Ⅰ期臨床觀察研究,結果顯示76次RIPC干預期間,患者均未出現RIPC相關的癥狀性下肢靜脈血栓形成或肢體青腫損傷,2例患者在RIPC完成后的11 d和18 d出現癥狀性DVT,但該2例患者在RIC完成后及DVT出現前,曾因高熱行同側股靜脈導管置入,提示患者安全性和耐受性良好,而且參與試驗的患者中未出現遲發性腦缺血。Azim N. Laiwalla等[22]報道的一項臨床對照研究發現,在年齡、性別、動脈瘤位置、動脈瘤干預方式(夾閉或栓塞)、Fisher分級及Hunt-Hess分級差異均無統計學意義的情況下,患者RIC干預前后未見DVT發生。在本研究中,RIC干預后肢體超聲監測均未發現DVT發生,提示RIC應用于aSAH患者未促進DVT的發生,這可能是因為RIC是一種加壓裝置,其作用于肢體深靜脈,有預防DVT的效果,但RIC是否會預防并減少肢體DVT的發生率,尚需進一步對照研究證實。

