福建養殖仿刺參抗氧化多肽的酶解工藝優化及其對過氧化氫誘導的血管內皮細胞EA.hy926損傷的保護作用
,,,, , ,,,*
(1.福建省水產研究所,福建省海洋生物增養殖與高值化利用重點實驗室,福建廈門 361013; 2.福建省海洋生物資源開發利用協同創新中心,福建廈門 361013; 3.華僑大學生物化工學院,福建廈門 361021; 4.寧德師范學院生物系,福建寧德 352100)

抗氧化多肽具有減緩或防止生物大分子過氧化以及清除體內自由基的功效,其活性與特定氨基酸組成、序列排布和空間構象密切相關[6-7]。利用蛋白酶水解有利于大分子蛋白質中抗氧化氨基酸的暴露,同時蛋白來源、蛋白酶類型、水解程度和預處理工藝等因素亦決定了酶解多肽的抗氧化活性[8-9]。研究發現,海參體壁酶解多肽具有顯著的體外抗氧化活性[10-12],然而目前尚未有對養殖刺參,特別是南方新興規模化養殖刺參的酶解多肽工藝優化及抗氧化活性研究。
因此,本研究以福建養殖仿刺參(Apostichopusjaponicus)體壁為原料,選擇水解度、體外DPPH自由基清除率為評價指標,從6種蛋白酶中篩選出制備仿刺參抗氧化多肽的最適蛋白水解酶;以單因素法、Box Behnken響應面設計法優化酶解工藝;測定仿刺參酶解多肽的體外抗氧化活性;進一步探討仿刺參抗氧化多肽對H2O2誘導人臍靜脈內皮細胞EA.hy926氧化應激損傷的保護效應,以期為仿刺參營養價值開發與商業增值轉化提供理論參考。
1 材料與方法
1.1 材料與儀器
仿刺參(Apostichopusjaponicus) 重量在200~300 g之間,福建省寧德市霞浦縣利豐達水產有限公司;DMEM液體培養基、胎牛血清、杜氏磷酸鹽緩沖液(D-PBS)、青-鏈霉素、胰酶細胞消化液 美國Hyclone公司;DMSO、MTS、HAT培養基添加劑 美國Sigma公司;中性蛋白酶(5萬U/g)、堿性蛋白酶(5萬U/g)、風味蛋白酶(2萬U/g)、木瓜蛋白酶(8萬U/g)、動物蛋白水解酶(10萬U/g) 南寧龐博生物工程有限公司;胃蛋白酶(1200 U/g) 國藥集團化學試劑有限公司;其他化學試劑(分析純) 國藥集團化學試劑有限公司;色譜柱OHpak SB-802.5HQ(8.0 mm×300 mm,6 μm) 日本昭和電工集團;人臍靜脈內皮細胞株EA.hy926 用含10%胎牛血清、1%青-鏈霉素、2% HAT添加劑的DMEM培養基在37 ℃、5% CO2、100%飽和濕度條件下培養,細胞鋪滿培養瓶底70%~80%時,用1 mL胰酶細胞消化液消化1 min左右,按1∶3傳代培養 中國科學院細胞庫;總抗氧化能力(T-AOC)檢測試劑盒(FRAP法)微板法、抑制與產生超氧陰離子自由基測定試劑盒(比色法)、羥自由基測試試劑盒、細胞丙二醛(MDA)測定試劑盒(微板法)、總超氧化物歧化酶(SOD)測定試劑盒(WST-1 法) 南京建成生物工程研究所;研磨玻璃珠 德國Qiagen公司。
臺式多功能切肉機TJ-85 廣東樂創電器有限公司;恒溫水浴鍋HH-6 常州國華電器有限公司;臺式離心機5810R 德國Eppendorf公司;凝膠色譜儀ELEOS System 美國Wyatt公司;生物安全柜AC2-4S1 新加坡ESCO公司;CO2培養箱Galaxy 170S 德國Eppendorf公司;倒置顯微鏡和照相系統DMi8 德國Leica公司;酶標儀InfiniteM200 瑞士TECAN公司;組織破碎儀TissueLyser II 德國Qiagen公司。
1.2 實驗方法
1.2.1 仿刺參的預處理 新鮮仿刺參去泥、去除內臟,蒸餾水洗凈體壁,過水煮沸5 min,濾紙瀝干表體水分后切塊,絞肉機攪碎,真空包裝,實驗前-20 ℃保存。
1.2.2 最適酶類型的選擇 酶解前,將真空包裝原料置流水至解凍。在固定料液比1∶20 g/mL和加酶量5000 U/g底物條件下,選擇各蛋白酶說明書最適酶解溫度、pH進行酶解(中性蛋白酶:50 ℃、pH7.5;胃蛋白酶:40 ℃、pH2;堿性蛋白酶:50 ℃、pH8;風味蛋白酶:50 ℃、pH7;木瓜蛋白酶:50 ℃、pH7;動物蛋白水解酶:50 ℃、pH7.5),在酶解20、40、60、120、180、240、300、360 min時移取酶解液,酶解完成后,將酶解液放置于100 ℃水浴鍋中,滅酶10 min。10000 r/min離心10 min,取上清液分別測定各酶解液的水解度、體外DPPH自由基清除率,選取酶解6 h酶解液,測定相對分子質量分布情況,綜合評價篩選出最適用蛋白酶。
1.2.3 指標測定
1.2.3.1 水解度的測定 水解度的測定參照文獻[13]操作,采用比色法測定游離氨基酸態氮質量濃度[14],采用微量凱氏定氮法測定總氮質量[15],按照公式(1)計算。

式(1)
式(1)中:N2為仿刺參蛋白酶解后溶液中游離總氨基態氮質量(g);N1為仿刺參蛋白酶解前溶液中游離總氨基態氮質量(g);N0為仿刺參蛋白中總氮質量(g)。
1.2.3.2 體外DPPH自由基清除率測定 體外DPPH自由基清除率的測定參照文獻[10]操作,按照公式(2)計算:

式(2)
1.2.3.3 相對分子質量分布的測定 移取樣品溶于流動相中,用流動相定容至50 mL,經0.22 μm孔徑濾膜過濾后,進樣20 μL,樣品流經凝膠色譜柱進行分離純化,再流經激光檢測器(LS)和示差檢測器(DRI)中進行檢測。進樣條件:色譜柱OHpak SB-802.5HQ(8.0 mm×300 mm,6 μm);流速0.500 mL/min;流動相NaNO3(0.2 mol/L的硝酸鈉溶液過0.22微米孔徑濾膜并超聲波脫氣15 min);柱溫25 ℃,檢測波長220 nm。
1.2.4 單因素實驗
1.2.4.1 加酶量對酶解效果的影響 根據酶類型篩選結果,選用動物蛋白水解酶在料液比(1∶20)、酶解2 h、酶解溫度50 ℃、pH7.5條件下,探討加酶量(1000、3000、5000、7000、9000、11000、13000 U/g)對酶解產物的水解度體外清除DPPH自由基能力的影響。
1.2.4.2 酶解溫度對酶解效果的影響 選用動物蛋白水解酶在料液比(1∶20)、酶解2 h、加酶量5000 U/g、pH7.5條件下,探討酶解溫度(30、40、50、60、70 ℃)對酶解產物的水解度與體外清除DPPH自由基能力的影響。
1.2.4.3 pH對酶解效果的影響 選用動物蛋白水解酶在料液比(1∶20)、酶解2 h、加酶量5000 U/g、溫度50 ℃條件下,探討pH(5.5、6.5、7.5、8.5、9.5)對酶解產物的水解度與體外清除DPPH自由基能力的影響。
1.2.5 響應面試驗 使用Design Expert軟件進行Box-Behnken試驗設計,以單因素試驗結果為基礎,以溫度(A)、加酶量(B)和pH(C)為自變量,以體外清除DPPH自由基率為響應值,設計3因素3水平實驗,確定酶解工藝最佳條件。實驗因素及其水平的取值見表1。

表1 響應面試驗因素水平表Table 1 Factors and levels table for respond surface methodology
1.2.6 酶解多肽體外抗氧化活性的測定 根據1.2.5響應面法獲得的酶解優化工藝制備仿刺參多肽,滅酶后10000 r/min離心10 min,取上清液凍干,獲得仿刺參體壁酶解多肽(Apostichopusjaponicusbody wall enzymolysis polypeptide,AJEP)凍干粉。采用DPPH法、Fenton法、黃嘌呤法、FRAP法,分別按照文獻[10]、羥自由基測試試劑盒、超氧陰離子自由基測定試劑盒、總抗氧化能力(T-AOC)檢測試劑盒說明書操作,按照公式(3~6)計算仿刺參酶解多肽的體外抗氧化活性。
DPPH自由基清除率(%)
式(3)
式(4)
超氧陰離子自由基清除率(%)
式(5)
式(6)
1.2.7 H2O2氧化應激損傷EA.hy926細胞模型的建立 取對數生長期的EA hy.926細胞,以2.5×104/mL細胞數接種于96孔板,每孔200 μL,在37 ℃、5% CO2條件下培養16~24 h貼壁后,棄原培養基,按梯度加入用DMEM培養基配制的H2O2溶液(50、100、150、200、300、400、500、600、700、800、900 μmol/L),設空白對照組。培養4 h后,小心吸去孔內液體,加入100 μL MTS應用液,培養2 h后,用酶標儀(490 nm)測定各孔吸光值。按照公式(7)計算細胞抑制率,使用Graphpad prism 6.0軟件非線性回歸分析,計算獲得H2O2誘導EA.hy926氧化應激產生50%損傷的半抑制濃度IC50。

式(7)
1.2.8 抗氧化多肽對H2O2誘導血管內皮細胞氧化損傷的保護作用 稱取一定量AJEP,使用DMEM培養基配制成不同濃度梯度的酶解多肽(低劑量組:0.05 mg/mL、中劑量組:0.5 mg/mL、高劑量組:5 mg/mL)。采用1.2.7方法,接種細胞貼壁后,棄原培養基,按梯度加入樣品組,設空白對照組、H2O2組。不同組處理情況為:空白對照組:原DMEM培養基;樣品組:低劑量組:0.05 mg/mL AJEP,中劑量組:0.5 mg/mL AJEP,高劑量組:5 mg/mL AJEP;H2O2組:0.05 mg/mL AJEP+200 μmol/L H2O2,0.5 mg/mL AJEP+200 μmol/L H2O2,5 mg/mL AJEP+200 μmol/L H2O2。預處理24 h后,加入用DMEM培養基配制的H2O2(半數抑制濃度)處理4 h,小心吸去孔內液體,加入100 μL MTS應用液,培養2 h后,檢測各孔吸光值。按照公式(8)計算細胞存活率。

式(8)
1.2.9 細胞氧化及抗氧化水平測定 取對數生長期的EA hy.926細胞,以2.5×104/mL細胞數接種于60 mm培養皿,每皿4 mL,分組及處理如1.2.8所述,終止培養后,棄原培養基后用D-PBS清洗2次,用細胞刮刀刮下細胞,D-PBS清洗2次,離心、棄上清,4 ℃進行細胞破碎,離心、取上清液,分別按照細胞丙二醛(MDA)測定試劑盒、總超氧化物歧化酶(SOD)測定試劑盒說明書操作,按照公式(9~10)計算MDA和SOD含量。

式(9)

式(10)
1.3 統計學分析

2 結果與分析
2.1 最適蛋白酶類型的篩選
采用中性蛋白酶、胃蛋白酶、堿性蛋白酶、風味蛋白酶、木瓜蛋白酶、動物蛋白水解酶等6種酶在相同的初始底物濃度、酶濃度、各自適合的酶解溫度、pH條件下對仿刺參體壁進行酶解,水解度、體外DPPH自由基清除率結果見圖1~圖2,選取6 h酶解液測定其相對分子質量分布情況,結果見表2。不同酶的活性部位和底物特異性不同,水解能力存在差異。由圖1可知,隨著時間增加,動物蛋白水解酶、風味蛋白酶酶解液水解度逐漸大于其余酶類型,說明這兩種酶與仿刺參可酶解肽鍵結合能力較好,具有較強的水解仿刺參蛋白的能力。酶解初始,仿刺參表面可溶性蛋白較易擴散到溶液中與酶接觸,肽鍵不斷水解,游離氨基酸、寡肽含量增多,水解度迅速增大;隨著反應進行,可酶解肽鍵濃度下降,產物濃度增加對酶解反應起反饋抑制作用,水解速率趨緩,水解度趨于平衡。由圖1可知,6種酶酶解液水解速率均在初始60 min內增速較快,之后隨時間延長、水解度增加而減緩,在反應進行240 min之后,水解度趨于穩定。

圖1 仿刺參酶解過程中不同種類酶酶解產物水解度的變化Fig.1 Change of hydrolysis degree of hydrolysates of Apostichopus japonicus by different enzymes during enzymolysis
不同蛋白酶與底物的作用位點不同,酶解產物的肽鏈結構不同,功能活性亦不同。由圖2可知,在考察時間內中性蛋白酶和動物蛋白水解酶酶解產物對DPPH自由基清除活性均大于其余酶類型,說明中性蛋白酶和動物蛋白水解酶對仿刺參蛋白具有較好的抗氧化活性酶切位點與特異性。6種蛋白酶的酶解產物體外DPPH自由基清除率均隨酶解時間的延長而增加,在最初的60 min內迅速增加,后隨時間延長而增速變緩,于酶解120 min后趨于平穩。

圖2 仿刺參酶解過程中不同種類酶酶解產物體外DPPH自由基清除率的變化Fig.2 Change of DPPH free radical scavenging abilities in vitro of hydrolysates of Apostichopus japonicusby different enzymes during enzymolysis
酶解產物的功能活性與其氨基酸組成有直接關系,近年來研究發現,特定功能活性肽多是小分子多肽[16]。由表2可知,不同蛋白酶酶解產物相對分子質量分布存在差異,風味蛋白酶、動物蛋白水解酶酶解產物中相對分子質量小于1000 Da的組分占比明顯高于其余4種酶解物,含量分別為95.64%和90.13%,說明風味蛋白酶、動物蛋白酶酶解產物中2~6個氨基酸組成的小分子多肽比例較高,這兩種酶有較好的水解仿刺參蛋白制備小分子多肽或氨基酸的能力。風味蛋白酶酶解產物中100~300 Da組分含量最高,占比為62.78%,說明風味蛋白酶酶解物中游離氨基酸、二肽較多;動物蛋白水解酶酶解產物中300~600 Da組分占比最高,占比為45.81%,說明動物蛋白水解酶酶解物中小分子短肽較多。

表2 仿刺參酶解過程不同酶解產物分子量分布Table 2 Relative molecular weight distribution of different enzymatic hydrolysates of Apostichopus japonicus
綜上可知,與其余5種蛋白酶相比,動物蛋白水解酶能較好地水解仿刺參體壁,酶解120 min時,其產物的體外DPPH自由基清除活性較高且趨于穩定,其中相對分子質量小于1000 Da的小分子多肽含量達90.13%,因此,選擇動物蛋白水解酶作為最適蛋白酶,進一步優化酶解工藝。
2.2 單因素實驗結果
2.2.1 溫度對酶解效果的影響 由圖3可知,在30~70 ℃范圍內,酶解產物的水解度和體外DPPH自由基清除率隨著溫度的遞增呈現先升后降的趨勢。當溫度在30~50 ℃時,水解度和清除率隨著溫度遞增而迅速增加;當溫度在50~70 ℃時,水解度和清除率隨著溫度遞增而迅速遞減。溫度對酶活力具有激活效應和失活效應,當溫度低于最適溫度時,隨著溫度升高,酶促反應加快;當溫度高于最適溫度,酶分子結構發生改變,酶活喪失,反應速度下降。考慮到實際生產成本等因素,最適溫度選擇50 ℃。

圖3 溫度對酶解產物水解度和體外DPPH自由基清除率的影響 Fig.3 Effects of temperatures on the hydrolysis degree and DPPH radical scavenging rate of the enzymatic hydrolysates in vitro
2.2.2 加酶量對酶解效果的影響 由圖4可知,酶解產物的水解度和體外DPPH自由基清除率隨著加酶量的增加而增加。當加酶量在1000~7000 U/g時,水解度和清除率隨著加酶量的增加而迅速增加;當加酶量在7000~13000 U/g時,水解度和DPPH自由基清除率增速漸緩,趨于極限。考慮到實際生產成本等因素,最適加酶量選擇7000 U/g。

圖4 加酶量對酶解產物水解度和體外DPPH自由基清除率的影響 Fig.4 Effects of enzyme dosage on the hydrolysis degree and DPPH radical scavenging rate of the enzymatic hydrolysates in vitro
2.2.3 pH對酶解效果的影響 由圖5可知,酶解產物的水解度和體外DPPH自由基清除率隨著pH的遞增呈現先升后降的趨勢。當pH在5.5~7.5時,水解度和體外DPPH自由基隨著pH的增加而增加;當pH在7.5~9.5時,水解度和體外DPPH自由基隨著pH的增加而減少。pH是酶促反應的重要影響因素,過高或過低將使酶活性結構發生不可逆轉的變化,同時改變底物解離程度,進而影響酶與底物結合,使酶解效率下降。因此,選擇最適pH為7.5。

圖5 pH對酶解產物水解度和體外DPPH自由基清除率的影響 Fig.5 Effect of pH on the hydrolysis degree and DPPH radical scavenging rate of the enzymatic hydrolysates in vitro
2.3 響應面優化試驗結果
2.3.1 響應面模型的建立和顯著性檢驗 以溫度(A)、加酶量(B)和pH(C)為試驗因素,以體外DPPH自由基清除率為響應值,進行三因素三水平的響應面分析試驗,試驗設計和結果分析見表3。
利用Design Expert 8.0軟件對表3進行二次多元回歸擬合,得到DPPH清除率對溫度、加酶量和pH的二次多項回歸方程:

表3 響應面試驗設計及結果Table 3 Design and results of response surface experiment
R1=68.25+0.90A+0.31B+0.16C+2.500E-0.05AB-0.13AC-0.082BC-3.29A2-0.62B2-1.63C2。
回歸模型方差分析(表4)表明,建立的回歸模型p值(0.0018)<0.01,極顯著;失擬項p值(0.9375)>0.05,不顯著,表明模型和試驗值擬合度良好。通過對p值的檢驗可見,對結果的影響大小為A>B>C,即溫度>加酶量>pH,二次項A2、C2對響應值DPPH清除率的影響極顯著(p<0.01),一次項A對響應值DPPH清除率的影響顯著(p<0.05),其余項影響不顯著(p>0.05),說明響應面主效應顯著,各因素之間交互作用較小。模型R2為0.9385,調整后R2為0.8595,Rsn2=9.816,說明該模型具有較好的預測作用。由上述分析可知,該模型很好地反映了DPPH清除率和酶解溫度、加酶量、pH之間的關系,可以使用此模型對動物蛋白水解酶制備仿刺參抗氧化多肽的酶解工藝進行優化分析和預測。

表4 方差分析結果Table 4 Variance analysis results
2.3.2 響應面交互作用分析 等高線圖和3D響應面可以直觀地展現酶解溫度、加酶量、pH之間的交互關系。從圖6中各個等高線可直觀發現,溫度的變化對DPPH清除率的影響明顯高于加酶量。溫度和pH的等高線形狀趨于圓形,表明其交互作用較弱,而pH的變化對DPPH清除率的影響明顯高于加酶量。
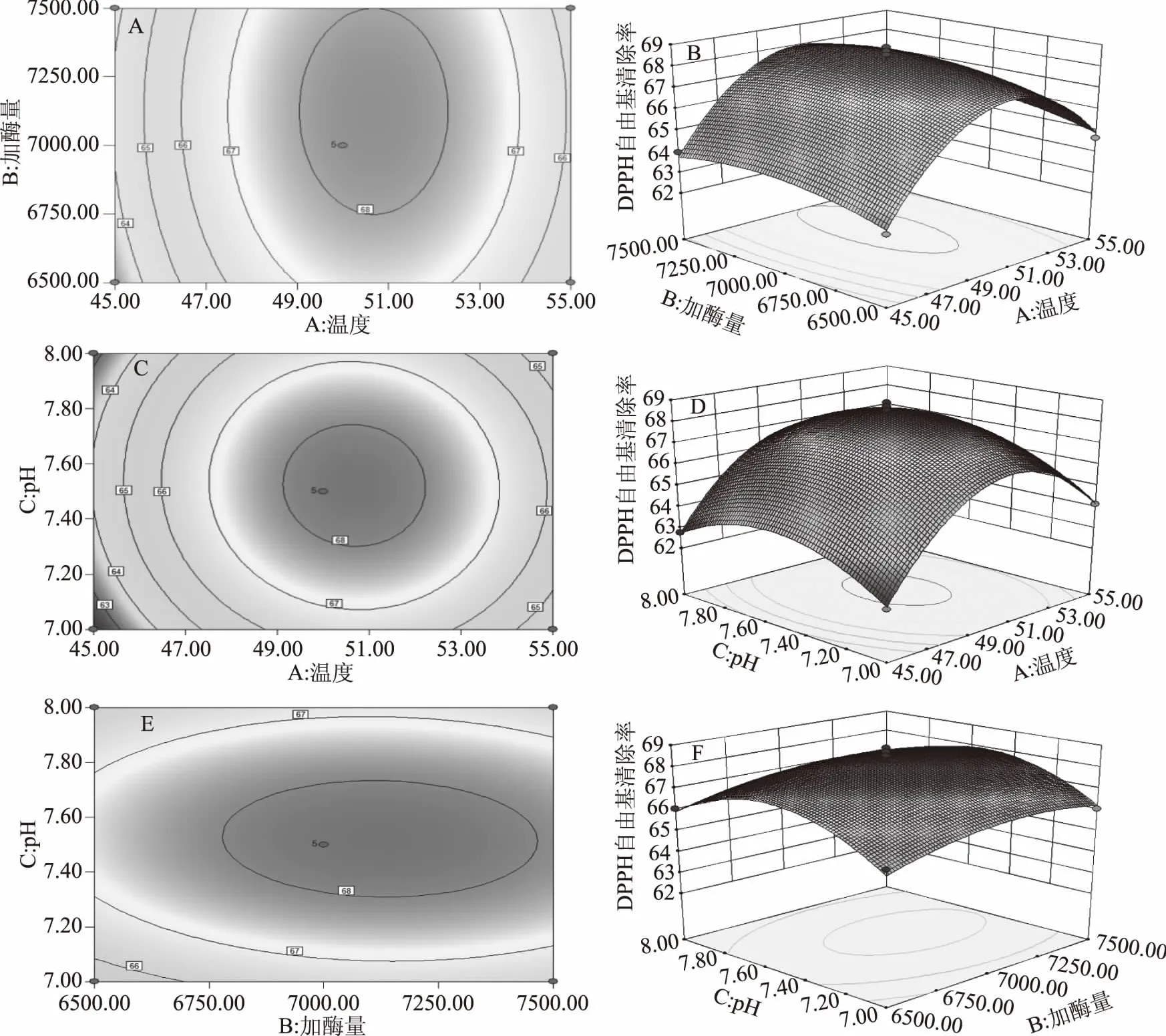
圖6 兩因素之間的交互作用對DPPH自由基清除率的影響Fig.6 Effect of two factors intercction on DPPH radical scavenging rate
通過Design Expert 8.0軟件對回歸方程的分析,得到各因素最佳條件為:溫度50.68 ℃、加酶量7123.19 U/g、pH7.52,此模型下,響應值為68.35。考慮到實際情況,結合表3進行調整后的最佳條件為:溫度50 ℃、加酶量7000 U/g、pH7.5。
2.3.3 最優條件的確定和驗證 為了驗證模型的準確性,以酶解溫度50 ℃、加酶量7000 U/g、pH7.5,反復試驗3次,得到響應值為68.81%,與模型預測值68.35%相對誤差為1%,表明回歸模型可以很好地預測動物蛋白水解酶制備仿刺參多肽的酶解工藝參數。
2.4 仿刺參酶解多肽的體外抗氧化活性

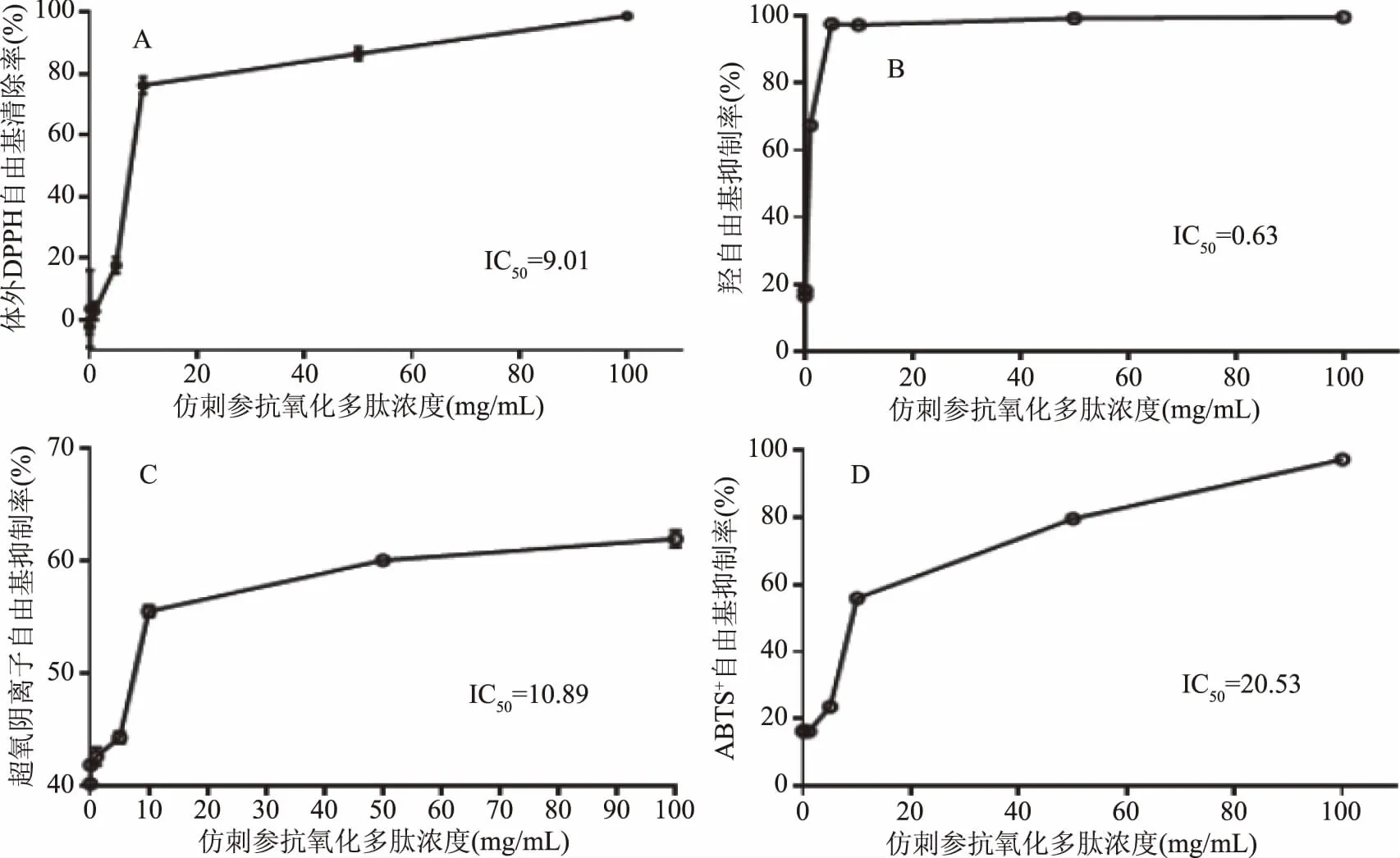
圖7 仿刺參體壁酶解多肽的體外抗氧化活性 Fig.7 Antioxidant activities of enzymolysis polypeptide of A.japonicus in vitro
2.5 仿刺參抗氧化多肽對H2O2誘導的人臍靜脈內皮細胞EA.hy926損傷的保護作用
2.5.1 H2O2對EA.hy926細胞活性的影響 采用0~900 μmol/L的H2O2構建EA.hy926氧化應激模型,以細胞抑制率作為細胞損傷評價指標。結果由圖8可知,H2O2濃度在0~150 μmol/L時,隨著劑量的升高,其對內皮細胞活力抑制作用增強,H2O2對細胞損傷相對緩和;濃度在150~900 μmol/L時,細胞抑制率快速升高,呈現顯著劑量-效應關系,H2O2對細胞損傷及反應更加強烈。若細胞抑制率過高,說明細胞損傷嚴重、難以逆轉,若細胞抑制率過低,說明細胞損傷不夠,均不利于開展損傷保護研究,因此選擇對細胞造成半數抑制率的濃度作為造模理想濃度。根據Graphpad軟件計算獲得H2O2的半數抑制濃度(IC50)值約為185.90 μmol/L,考慮到實際操作情況,選取200 μmol/L H2O2濃度建立損傷模型。
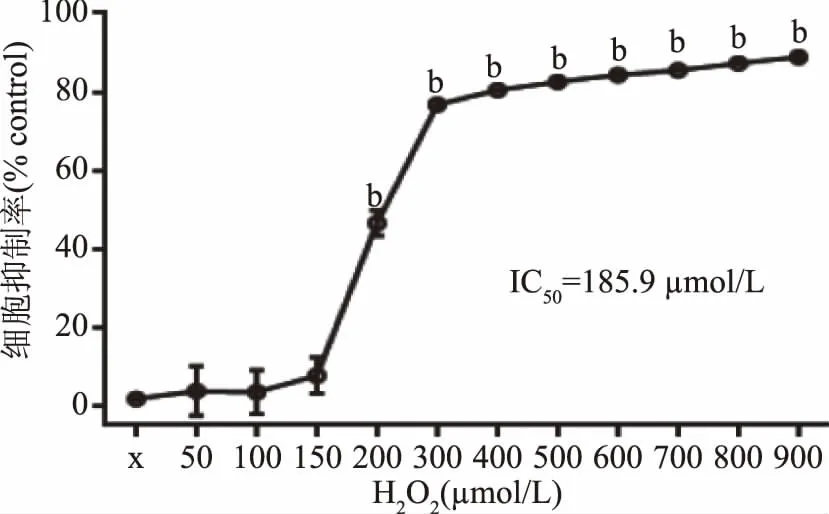
圖8 過氧化氫(H2O2)對人臍靜脈內皮細胞EA.hy926活性的影響(n=3)Fig.8 Effect of different concentrations of H2O2 on EA.hy926(n=3)注:a表示與空白對照組相比差異顯著(p<0.05),b表示與空白對照組相比差異極顯著(p<0.01)。
2.5.2 抗氧化多肽對EA.hy926細胞氧化應激損傷的保護作用 由表5可知,人臍靜脈內皮細胞EA.hy926中加入不同劑量濃度的仿刺參多肽AJEP,培養24 h后,與空白對照組相比,低、中、高劑量組細胞存活率均在90%以上,說明AJEP對EA.hy926細胞無明顯毒副作用。而后選擇200 μmol/L H2O2處理4 h,與空白對照組比較,H2O2組細胞存活率差異極顯著(p<0.01),為42.75%±1.27%,說明氧化應激損傷模型成功可靠。以低、中、高劑量AJEP處理EA.hy926細胞24 h后,200 μmol/L H2O2處理4 h后,與H2O2組相比,在0.05~5 mg/mL 濃度范圍內,隨著濃度的增加,AJEP對EA.hy926細胞的保護率明顯增加,死亡數量下降,中、高劑量組細胞存活率分別為57.33%±4.27%(p<0.05)和85.56%±2.23%(p<0.01),均在50%以上,說明中、高濃度仿刺參抗氧化多肽對H2O2誘導人臍靜脈內皮細胞的氧化應激損傷具有顯著保護效應。

表5 仿刺參抗氧化多肽對人血管內皮細胞氧化損傷的保護作用(n=3)Table 5 Effect of enzymolysis polypeptide of A.japonicuson EA.hy926 cells viability injured by H2O2(n=3)
2.5.3 抗氧化多肽對EA.hy926細胞氧化應激損傷MDA含量、SOD活性的影響 以MDA含量和SOD活性作為EA.hy926細胞氧化應激水平的氧化和抗氧化檢測指標。由表6可知,與空白對照組比較,H2O2誘導的氧化應激損傷EA.hy926細胞中MDA含量顯著升高(p<0.05),SOD活性極顯著降低(p<0.01);而經過仿刺參酶解抗氧化多肽預處理的EA.hy926細胞中,隨著AJEP濃度提高,MDA含量降低,SOD活性增強,呈劑量-效應關系;與H2O2損傷組比較,中劑量AJEP組SOD活性極顯著升高(p<0.01),而MDA含量差異不顯著(p>0.05),高劑量AJEP組MDA含量顯著降低、SOD活性顯著升高(p<0.05)。

表6 仿刺參抗氧化多肽對人血管內皮細胞氧化損傷的MDA、SOD的影響(n=3)Table 6 Effect of enzymolysis polypeptide ofA.japonicus on MDA and SOD expression in EA.hy926 cells injured by H2O2(n=3)
3 結論


