YY1基因對J82膀胱尿路上皮癌細胞增殖侵襲能力的影響
劉翔 耿和 吳宗林 施華娟 張濤
上海市普陀區人民醫院泌尿外科(上海 200060)
在世界范圍內,膀胱尿路上皮癌在泌尿系統惡性腫瘤中發病率最高[1],它具有復發率高、易向肌層侵潤等特點[2]。近年來該病在我國的發病率有進行性增高的趨勢[3],故對該病增殖、侵襲機制的研究能帶來明顯的科研及社會價值。 轉錄因子YY1(Yin?Yang1)是鋅指類核轉錄調節因子,通過結合不同的輔助因子,參與細胞周期的調控、腫瘤的形成等多種生物學進程[4]。多項研究顯示YY1在包括膀胱癌在內的多項惡性腫瘤中均有表達,并揭示YY1可能是導致正常細胞轉變為腫瘤細胞,并且促進腫瘤細胞增殖、轉移的關鍵因子[5-6]。故我們設計本研究來觀察YY1在不同表達水平下對J82膀胱尿路上皮癌細胞的增殖、侵襲能力的影響,以探索YY1的表達水平與膀胱尿路上皮癌進展的關系。
1 材料與方法
1.1主要材料和試劑本研究起止時間為2017年4月至2018年4月。J82人膀胱尿路上皮癌細胞購自美國Sciencell公司。細胞培養液采用購自美國Hyclone公司。轉染試劑盒購自美國Invitrogen公司。兔抗人多克隆抗體YY1購自美國ProteintechT公司。Transwell小室購自美國Corning公司。酶標儀購自瑞士TECAN Nanoquant公司。靶向YY1序列的shRNA由上海齊合生物技術有限公司合成,依篩選出來的709、827、1186三個靶標位點進行制備。
1.2細胞培養和轉染將J82細胞在含10%FBS的MEM培養基中于37℃、5%CO2培養箱中培養,轉染前1天將J82細胞接種到(不含抗生素的培養基)6孔板中,每孔2 mL。等到細胞生長到80%~90%融合度時,將細胞分為三組:(1)空白組未進行轉染操作。(2)YY1增強表達組在Opti?MEM 250 μL中加入脂質體核酸轉染試劑10 μL,在室溫下孵育5 min,加入Opti?MEM 250 μL和搭載YY1的pFLAG?CMV4載體4 μg,轉染后6 h后換成完全培養液,轉染完成48 h后收集蛋白。(3)YY1沉默組轉染時采用pLKO.1puro載體搭載的shRNA,轉染方法同YY1增強表達組。
1.3Western blotting檢測相關蛋白的表達分別將空白組、YY1增強表達組、YY1沉默組的細胞充分裂解后離心取上清液。配制凝膠置于電泳槽中,取各個處理組蛋白提取液,與緩沖液混合后煮沸、離心,加入孔中進行電泳,將PVDF膜浸泡于轉移緩沖液中,修膠后制備轉膜“三明治”,將轉移盒放入電轉儀中進行轉膜。封閉、洗膜后加入封閉液稀釋的YY1一抗和β?actin,孵育洗膜后加入辣根過氧化物酶(HRP)標記的二抗。膜于化學發光檢測試劑中反應后,在暗室中感光、顯影、定影。對膠片進行掃描,比較各組灰度值。
1.4MTT實驗檢測細胞增殖能力J82細胞在10%FBS的MEM培養基中于37℃、5%CO2培養箱中培養,經0.25%胰酶消化,離心后用完全培養基重懸細胞并計數。將空白組、YY1增強表達組、YY1沉默組的轉染混合物加到96孔板的孔底,然后每孔接種8 000個J82細胞。置于37℃、5%CO2培養箱中分別培養24、48和72 h,然后在96孔板的每個孔中加入10 μL MTT,于37 ℃、5%CO2培養箱中孵育3 h后,棄去MTT和完全培養基,再加入100 μL DMSO,孵育后于酶標儀中檢測各孔在490 nm處的吸光度,繪制細胞增殖曲線。
1.5Transwell實驗檢測細胞侵襲能力在24孔板和上室transwell insert中加入無血清培養液MEM,在37℃的培養箱里平衡一個h以增強細胞的粘附作用。將空白組、YY1增強表達組、YY1沉默組的細胞按3×104個接種在insert的上室內,6 h之后將上室培養基更換為無血清培養基,下室為完全培養基。Corning Polycarbonate Membrane Insert置于37℃、5%CO2的培養環境下培養,48 h后擦除未遷移跨膜的細胞,將小室置于干凈的24孔板中并加入0.6 mL 100%甲醇,室溫下固定10 min。固定完成后,在另外一個干凈的小孔中倒入一定量的0.1%的結晶紫進行染色30 min,清洗殘余染料,取膜后置于顯微鏡下拍照計數,計數小室中央10個隨機視野內穿透膜的細胞數取平均值。
1.6統計學方法應用SPSS 20.0軟件對實驗數據進行統計分析,實驗結果以x±s表示,采用獨立樣本t檢驗和單因素ANOVA分析,以P<0.05為差異有統計學意義。
2 結果
2.1YY1基因增強表達和沉默的效果對各組Western blotting蛋白印跡灰度值進行分析,使用β?actin作為內參,結果顯示空白組與YY1增強表達組對比時,YY1蛋白表達水平分別為(5.73±0.30)和(8.14± 0.37),增強組的YY1表達明顯升高,差異有統計學意義(P=0.001)。見圖1。對比709、827、1 186三個靶標位點制備的shRNA沉默YY1的表達效果,以1 186位點合成的shRNA效果最佳,故后續數據分析及實驗步驟均選取該位點shRNA轉染的J82細胞作為YY1沉默組。空白組和YY1沉默組對比時,YY1蛋白表達水平分別為(14.52±0.71)和(10.08±0.37),沉默組的YY1表達明顯降低,差異有統計學意義(P<0.05)。見圖2。
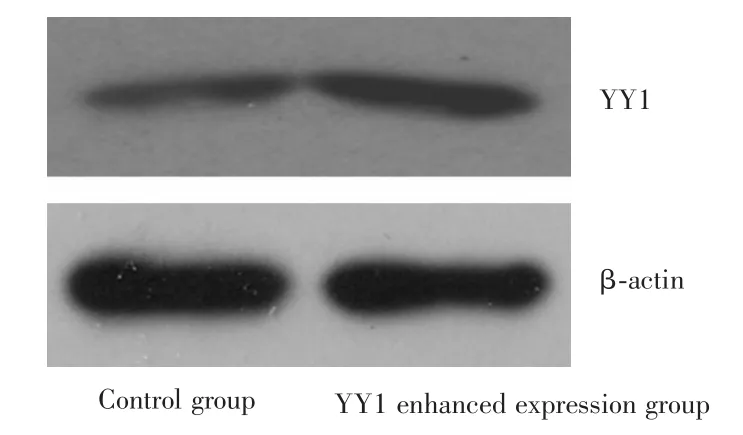
圖1 增強表達后的J82細胞中YY1表達水平的改變Fig.1 Expression level of YY1 in J82 cells after enhanced expression
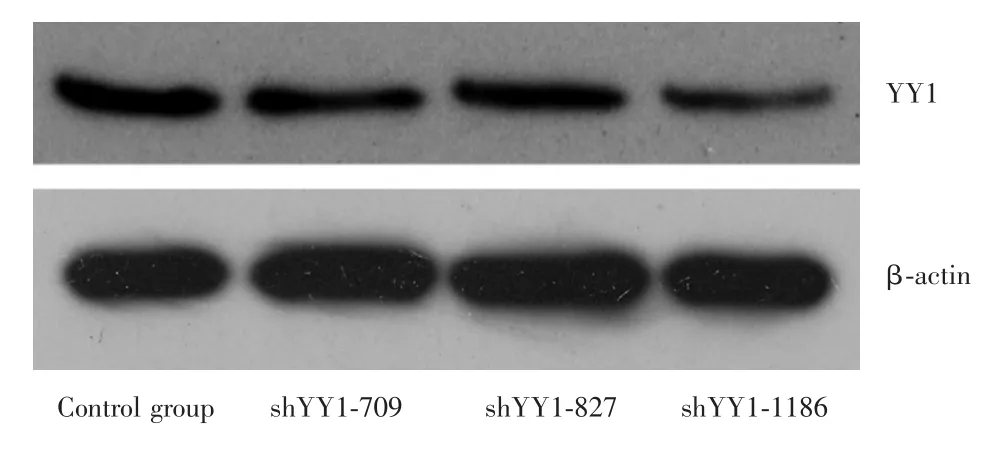
圖2 shRNA轉染后的J82細胞中YY1表達水平的改變Fig.2 Expression level of YY1 in J82 cells after shRNA transfection
2.2 MTT實驗依酶標儀檢測結果顯示,培養24 h后,YY1沉默組、空白組、YY1增強表達組在490nm處的吸光度分別為(0.105±0.014)、(0.106±0.009)和(0.142±0.009)。培養48 h后,三組吸光度分別為(0.124±0.009)、(0.153±0.010)和(0.246±0.013)。培養72 h后,三組吸光度分別為(0.163 ± 0.028)、(0.234 ± 0.011)和(0.382 ± 0.018)。YY1增強表達組在各個時間節點的吸光度均高于空白組和YY1沉默組(P<0.05)。培養24 h后空白組和YY1沉默組的吸光度無明顯區別(P>0.05)。培養48 h和72 h后空白組吸光度明顯高于YY1沉默組(P<0.05)。細胞增殖曲線顯示,YY1沉默組的增殖速率明顯低于YY1增強表達組。見圖3。
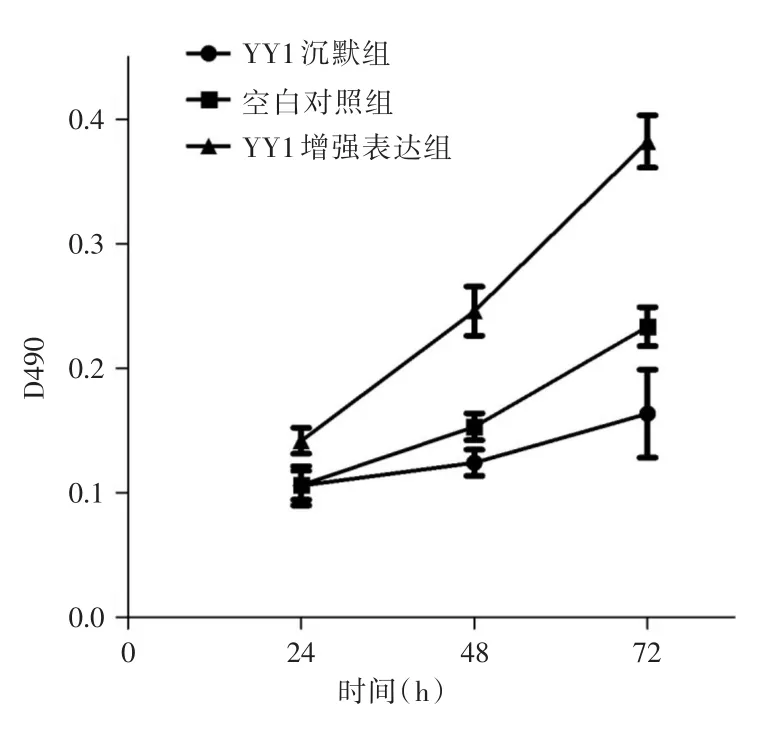
圖3 各組J82細胞增殖曲線Fig.3 J82 cell proliferation curve of each group
2.3 Transwell實驗隨機取10個小室中央視野,計數其內穿透膜的細胞數取平均值,顯示YY1沉默組、空白組、YY1增強表達組視野內的細胞計數分別為(7.2±3.6)、(54.4±6.7)和(56.6±10.7)。見圖4-7。樣本之間差異明顯(F=67.804,P<0.05),其中YY1沉默組的細胞計數明顯小于空白組和YY1增強表達組(P<0.05),空白組和YY1增強表達組之間無明顯差異(P>0.05)。

圖4 YY1沉默組中J82細胞的侵襲能力(×250)Fig.4 Invasion ability of J82 cells in YY1 silent expression group(× 250)
圖5 空白對照組中J82細胞的侵襲能力(×250)Fig.5 Invasion ability of J82 cells in control group(× 250)
圖6 YY1增強表達組中J82細胞的侵襲能力(×250)Fig.6 Invasion ability of J82 cells in YY1 enhanced expression group(× 250)
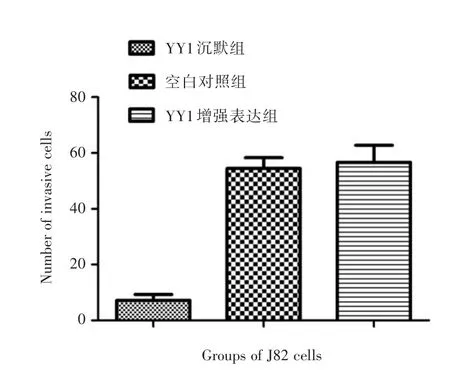
圖7 各組透膜細胞計數Fig.7 Number of invasive cells in each group
3 討論
腫瘤細胞增殖能力與細胞分裂周期密切相關。細胞分裂周期縮短,則在時間一定的條件下能分裂產生更多的細胞。而細胞周期的長短主要由合成前期(G1)決定,縮短合成前期,能有效地縮短細胞的整個分裂周期,從而促進細胞增殖能力的提升[7]。KANG等[8]研究者發現在體外沉默胃腺癌細胞中YY1的表達后,能使胃腺癌細胞停滯于G1期,同時引起胃腺癌細胞凋亡。此研究還提示敲除YY1的胃腺癌細胞的通過抑制Wnt通路從而表現為擴散能力受限制。同樣的現象被CHOW KH在乳腺癌中發現[9]。筆者應用ShRNA干擾技術這一高效、特異的基因沉默手段,成功制備了敲低YY1表達的J82細胞模型。通過對YY1增強表達、YY1正常表達和敲低YY1表達的J82細胞進行實驗比較各組的增殖能力,發現敲低YY1表達的J82細胞的增殖能力在各個時間節點均明顯弱于YY1增強表達的J82細胞,僅在培養24 h后與空白組的J82細胞達到相近水平,而在48 h和72 h后,亦被空白組明顯超越。此結果與上述研究者的研究結果相符,提示YY1被沉默后可能延長惡性腫瘤的G1期以減弱其增殖能力。YY1在膀胱尿路上皮癌中發揮作用的具體機制還有待進一步研究,受KANG等[8]作者研究結果的啟示,推測該機制與Wnt通路可能存在關聯。
腫瘤細胞的侵襲能力受多種因素影響。Tran?swell實驗反映的是腫瘤細胞降解細胞外基質的能力,該過程是腫瘤細胞通過分泌蛋白降解酶來完成。基質金屬蛋白酶家族(MMPs)是此類蛋白降解酶中具有代表性的一類,近年來大量研究顯示MMPs在人類多種惡性腫瘤的侵潤轉移過程中起到了重要的促進的作用[10-11]。我們通過分析Tran?swell實驗的結果,發現YY1沉默組中J82細胞的侵襲能力明顯弱于空白對照組和YY1增強表達組,而對比空白組和YY1增強組中J82細胞的侵襲能力則未發現明顯差異。聯想到MMPs在腫瘤細胞侵襲過程中的重要作用,筆者試圖尋找YY1與MMPs之間相互作用的證據以解釋上述結果。NIE等[12]在食管鱗狀細胞癌細胞中發現沉默YY1表達后可抑制該腫瘤細胞的擴散和侵潤,其過程與MMP2和MMP9的表達受抑制相關。ZHENG等[13]在胃癌細胞中發現沉默YY1后可以明顯減弱MMP14的作用,從而抑制胃癌細胞的轉移,同時取決于MMP14水平的不同,YY1在胃癌轉移的過程中可正向或負向調節MMP14的功能。故筆者推測膀胱尿路上皮的侵襲能力可能受到YY1調節后的MMPs表達的影響,同時MMPs的表達不一定總是隨著YY1表達的增強而同時增強,或許存在某種受MMPs水平所決定的反饋機制,導致本實驗結果中空白組和YY1增強組J82細胞的侵襲能力無明顯差異,這有待在膀胱尿路上皮癌細胞中對不同YY1表達水平下的MMPs作進一步的檢測來尋找線索。
前文中提到,筆者發現有關研究提示Wnt通路可能參與了腫瘤細胞的增殖過程,在腫瘤細胞的侵襲過程中,我們同樣發現了類似的線索。DU等[14]發現當人類膀胱癌細胞中Wnt通路被激活后,通路中的重要因子β?catenin水平升高,刺激MMP9水平也升高從而增強膀胱癌的侵襲能力。結合其他作者在他們的研究中發現YY1可影響MMPs表達水平的結論,推測Wnt通路很可能是YY1作用于MMPs的中間通路,有待進一步研究的證明。
膀胱尿路上皮癌的增殖和侵襲均是十分復雜的過程,我們的研究結果提示沉默YY1基因可減弱J82膀胱尿路上皮癌細胞的增殖和侵襲能力,對其進行進一步研究有利于揭示膀胱尿路上皮癌進展的機制,為針對該腫瘤的治療提供具有前景的作用靶點。

