食品用萜類化合物的生物合成研究進展
宗 朕,程 磊,陳卓靜,王 磊,汪 超,祁勇剛,柳志杰*
(湖北工業大學 工業發酵湖北省協同創新中心,湖北 武漢 430068)
1 萜類化合物生物合成系統研究的意義
萜類化合物是廣泛存在于動物、植物、微生物中的一大類天然化合物,以異戊二烯為基本骨架,在各種合成酶、修飾酶作用下生成,又稱為類異戊二烯(isoprenoid)。根據結構中異戊二烯數目,可將其分為半萜、單萜、倍半萜、二萜、三萜、四萜及多萜。在萜類化合物的合成過程中,由于合成所需的萜類合酶(terpene synthases,TPS)以及修飾酶的多樣性[1-2],使得最終生成的萜類化合物結構繁多,種類豐富,具有多樣的生物活性及理化性質,在醫藥[3-6]、農藥[7-8]、食品、日化用品[9-10]、能源[11]等多個領域擁有廣泛的應用及廣闊的發展前景,萜類化合物在食品中的應用見表1。
在半萜類化合物中,異戊醇和異戊烯醇在食品中應用較為廣泛,異戊醇可用于食品香料的配制[12],異戊烯醇可用于食品香料檸檬醛[13]的合成。
在單萜類化合物中,薄荷醇、紫蘇醇、月桂烯和芳樟醇作為植物精油中的主要成份,是植物花、果實香味的主要來源,因此常用于食品香精香料[14-15]。
倍半萜中α-金合歡烯可作為食品香精[12]。在二萜中,甜菊糖苷作為一種天然的甜味劑在食品行業中應用廣泛[16]。在三萜中,人參皂苷作為食藥兩用類化合物,在保健食品、醫藥中應用廣泛。

表1 各類型萜類化合物在食品及其他領域中的應用Table1 Application of various terpenoids in food and other fields
四萜和多萜類化合物在食品中應用較多,如四萜中的番茄紅素和蝦青素均具有很強的抗氧化活性[17-18],可作為功能食品的功能成分;多萜中的視黃醇對維持人體正常發育以及正常視覺功能具有重要作用,維生素K對正常凝血及骨骼代謝具有重要作用,因此兩者常用作食品營養強化劑。
綜上所述,萜類化合物在食品領域具有廣泛和重要的應用,對人體健康及日常生活都有重要的影響。目前萜類化合物的合成方法主要有:植物提取法、化學合成法及生物合成法。相比于其他兩種方法,生物合成法生產不受原料限制、過程綠色環保、產物單一、產量有較大的提升空間,有更大的發展潛力,實現萜類化合物的大規模生物合成對人類的健康、環保、可持續發展具有重要的意義。
2 萜類化合物的生物合成
萜類化合物從其前體物質到結構、功能各異的終產物的生物合成過程包括了三個階段(見圖1):第一階段為中間體異戊烯焦磷酸(isopentenyl pyrophosphate,IPP)和二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP)的合成;第二階段為香葉基焦磷酸(geranyl pyrophosphate,GPP)、法呢基焦磷酸(farnesyl pyrophosphate,FPP)、香葉基香葉基焦磷酸(geranylgeranyl pyrophosphate,GGPP)等直接前體物質的合成;第三階段為萜類化合物碳骨架的形成及修飾。
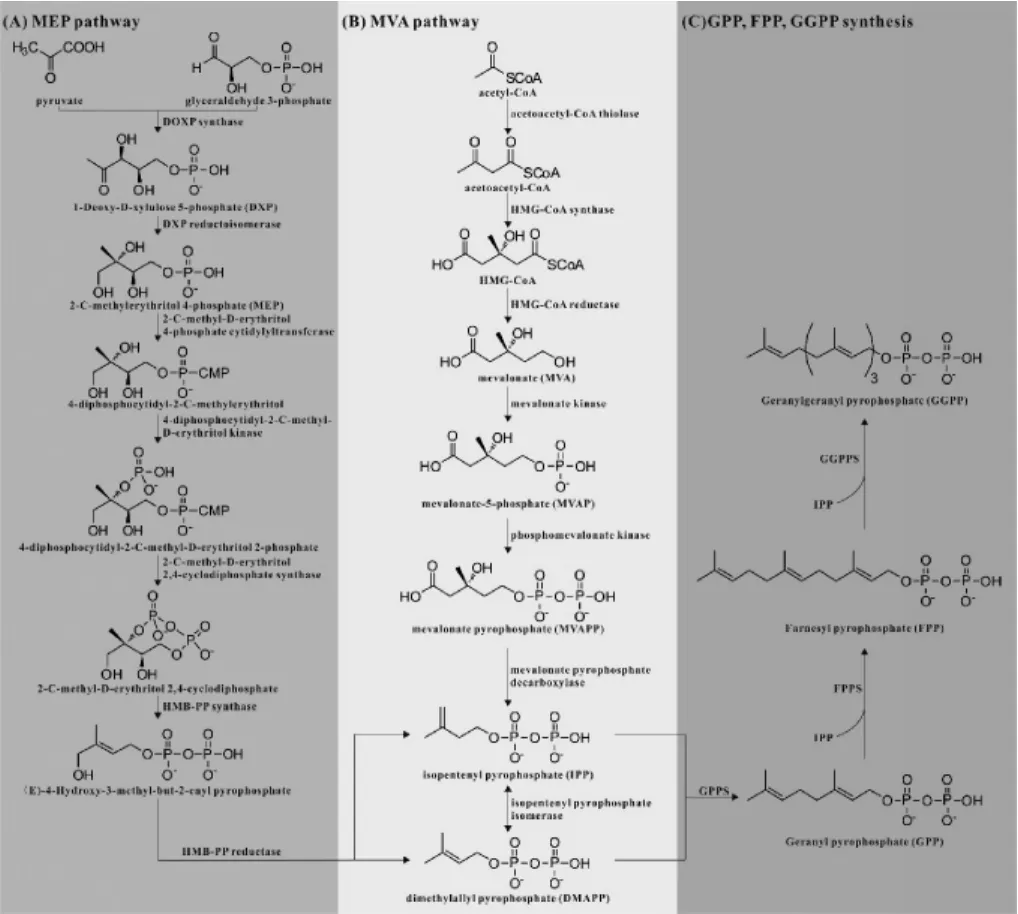
圖1 萜類化合物生物合成途徑Fig.1 Biosynthesis pathways of terpenoids
2.1 萜類化合物中間體IPP和DMAPP的生物合成途徑
目前已發現的萜類化合物中間體IPP和DMAPP的生物合成途徑有兩種:2-甲基-D-赤蘚糖醇-4-磷酸(2-methy-D-erythrito-4-phosphate,MEP)途徑和甲羥戊酸(mevalonic acid,MVA)途徑。兩種途徑的差異在于前體物質、酶以及反應所在的亞細胞空間位置[19],但最終都生成了萜類化合物的中間體IPP和DMAPP,而且兩途徑的產物還可以通過質體膜進行交換[20]。
2.1.1 MEP途徑
MEP途徑是在20世紀末發現的一條萜類化合物中間體生物合成途徑,主要存在于細菌、藻類和植物質體中,該途徑以丙酮酸和甘油醛-3-磷酸為前體合成萜類化合物中間體IPP和DMAPP,其過程見圖1(A)。
在MEP途徑中,前體物質一分子丙酮酸和一分子甘油醛-3-磷酸在1-脫氧-D-木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose 5-phosphate synthase,DXS)催化下生成1-脫氧-D-木酮糖-5-磷酸,該步驟是MEP途徑中第一個限速步驟,DXS也是該途徑中的限速酶之一[22]。之后1-脫氧-D-木酮糖-5-磷酸在1-脫氧-D-木酮糖-5-磷酸還原異構酶催化下生成MEP,該步反應是1-脫氧-D-木酮糖-5-磷酸流向的分支點,也是MEP代謝途徑調控的重要靶點,是MEP途徑的限速步驟,1-脫氧-D-木酮糖-5-磷酸還原異構酶也是MEP途徑中關鍵酶之一[23]。MEP再在2-甲基-D-赤蘚醇-4-磷酸胞苷酰轉移酶催化下生成4-二磷酸胞苷-2-C-甲基赤蘚醇;之后4-二磷酸胞苷-2-C-甲基赤蘚醇在4-焦磷酸胞苷-2-C-甲基赤蘚糖醇激酶催化下生成4-二磷酸胞苷-2-C-甲基-D-赤蘚醇-2-磷酸,生成的4-二磷酸胞苷-2-C-甲基-D-赤蘚醇-2-磷酸在2-甲基赤蘚糖-2,4-環二磷酸合酶催化下生成2-C-甲基-D-赤蘚醇2,4-環二磷酸,下一步,2-C-甲基-D-赤蘚醇2,4-環二磷酸在4-羥基-3-甲基-2-(E)-丁烯基-4-二磷酸合酶催化下生成4-羥基-3-甲基-2-(E)-丁烯基-4-二磷酸,最終4-羥基-3-甲基-2-(E)-丁烯基-4-二磷酸在4-羥基-3-甲基-2-(E)-丁烯基-4-二磷酸還原酶催化下轉化為IPP和DMAPP。
2.1.2 甲羥戊酸途徑
甲羥戊酸(mevalonate,MVA)途徑是發現較早的萜類化合物中間體生物合成途徑,主要存在于真核生物細胞質中,其以乙酰輔酶A為前體合成萜類化合物中間體IPP和DMAPP,其過程見圖1(B)。
在MVA途徑中,首先是兩分子乙酰輔酶A在乙酰輔酶A硫解酶催化下生成乙酰乙酰輔酶A,然后乙酰乙酰輔酶A與一分子乙酰輔酶A在3-羥基-3-甲基戊二酰輔酶A合成酶催化下生成3-羥基-3-甲基戊二酰輔酶A(HMG-CoA)。之后HMG-CoA在3-羥基-3-甲基戊二酰輔酶A還原酶催化下生成MVA,該步反應是不可逆過程,所參與的3-羥基-3-甲基戊二酰輔酶A還原酶是MVA途徑中第一個限速酶[21],對細胞質中萜類化合物的代謝起著重要的調控作用。MVA再在甲羥戊酸激酶催化下生成甲羥戊酸-5-磷酸(mevalonate-5-phosphate,MVAP),之后MVAP在磷酸甲羥戊酸激酶催化下生成甲羥戊酸-5-焦磷酸(mevalonate-5-pyrophosphate,MVAPP),最后MVAPP在甲羥戊酸焦磷酸脫羧酶催化下生成IPP。IPP在異戊烯焦磷酸異構酶催化下生成其雙鍵異構體DMAPP。
2.2 萜類化合物直接前體GPP、FPP、GGPP的生物合成
GPP、FPP、GGPP是不同分子數目的IPP與DMAPP在不同異戊烯焦磷酸合成酶作用下生成的[23],因此三者具有不同大小的分子量,作為不同類型萜類化合物的直接前體,用于不同類型萜類化合物的合成。GPP是一分子IPP與一分子DMAPP在香葉基焦磷酸合酶催化下縮合形成,用于單萜類化合物的合成;FPP是GPP與一分子IPP在法呢基焦磷酸合酶催化下形成,用于倍半萜和三萜的合成;GGPP是FPP與一分子IPP在香葉基香葉基焦磷酸合酶的催化作用下生成,用于二萜和四萜類化合物的合成(圖1C)。
2.3 萜類化合物碳骨架的形成與修飾
GPP、FPP、GGPP在TPS催化下形成萜類化合物碳骨架或最終萜類化合物,其中單萜、倍半萜和部分二萜可以分別以GPP、FPP、GGPP為前體在TPS催化下直接合成,但部分二萜、三萜、四萜及多萜以GPP、FPP、GGPP為前體在TPS催化下形成的是最終萜類化合物的碳骨架,還需在各種修飾酶的作用下對碳骨架進一步修飾,如環氧化、羥基化、異構化、糖基化等[24],形成具有不同結構功能的萜類化合物。3利用生物合成法生產食品用萜類化合物
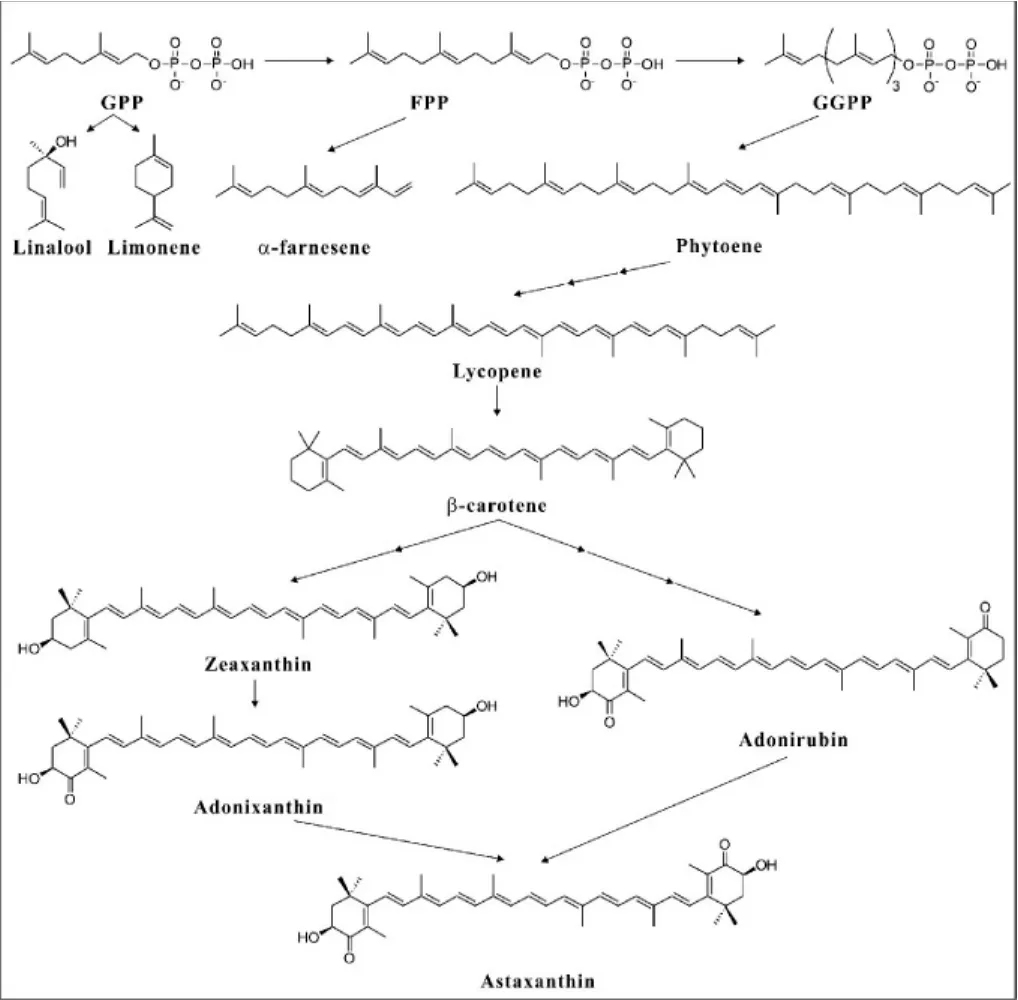
圖2 食品用萜類化合物合成過程Fig.2 Synthetic process of terpenoids for food
在萜類化合物的合成方法中,生物合成法因其所具有的特點而成為萜類化合物工業化大規模生產應用中最具潛力的方法。目前,人們研究最多的是運用基因工程、代謝工程以及合成生物學的方法,以微生物作為底盤細胞來生產萜類化合物,在原核微生物中主要是大腸桿菌,真核微生物中主要是釀酒酵母和近幾年備受關注的解酯耶氏酵母。此外,在畢赤酵母[25]、紅法夫酵母[26]、馬克斯克魯維酵母[27]、谷氨酸棒狀桿菌[28]、惡臭假單胞菌[29]中也有研究。主要用于合成的食品用萜類化合物有芳樟醇、檸檬烯、α-金合歡烯、番茄紅素、β-胡蘿卜素、玉米黃質、蝦青素等,這些物質生物合成過程見圖2。
3.1 原核微生物
大腸桿菌(Escherichiacoli)作為原核微生物中模式菌株,已對其有深入的研究,目前已作為底盤細胞用于多種食品用萜類化合物的合成。
利用E.coli內源的MEP途徑提供萜類合成所需的前體化合物,通過異源表達各萜類合酶編碼基因,可以實現E.coli對各種萜類的合成。THANASOMBOON R等[30]通過向E.coli中轉入編碼GPPS和LIS的基因,使芳樟醇在大腸桿菌中的合成量接近90 mg/L。為了增加E.coli中目標物質的產量,第一個策略是增加目標產物前體的供應。在不引入外源前體合成途徑的前提下,通過過表達MEP途徑中限速酶(DXS、IDI、GPPS、FPPS)編碼基因增加中間體和直接前體的供應以增加目的產物的產量。ZHOU Y等[31]通過敲除E.coli中編碼葡萄糖-6-磷酸脫氫酶的基因zwf,過表達MEP途徑中各限速酶(idi、dxs、ispDF)基因,使工程菌株番茄紅素產量達到6.85~7.55 mg/g菌體干質量。為了進一步增加目標產物的產量,僅依靠內源途徑來供應前體,這依然是不足的,越來越多的研究在E.coli中引入了異源MVA途徑并過表達該途徑中限速酶(tHMGR、IDI)編碼基因來提供更多的前體,使萜類化合物的產量進一步提高。ALONSOGUTIERREZ J等[32]在E.coli中構建異源MVA途徑并異源表達LS的編碼基因,在以葡萄糖為碳源的培養條件下,最終檸檬烯的產量達到435 mg/L。KIM EM等[33]通過在E.coli中引入異源MVA途徑,過表達GPPS和來自冬青棟的MS編碼基因,使得E.coli月桂烯產量達到(1.67±0.029)mg/L,再利用原位分離和以甘油作為碳源等手段對培養條件進行優化,使月桂烯最終產量達到(58.19±12.13)mg/L。SHENHJ等[34]利用可調的基因間隔區(thetunableintergenic regions,TIGRs)協調釀酒酵母(S.cerevisiae)中MVA途徑基因在E.coli中的異源表達,使用IPP/FPP響應啟動子動態調節TIGR介導的MVA途徑,防止有毒性代謝物的積累。通過代謝調控,在5L的發酵條件下,玉米黃質的產量達到722.46 mg/L。ZHU FY等[35]通過在E.coli中引入異源MVA途徑和密碼子優化后的番茄紅素合成基因crtE、crtB、crtI,并過表達idi基因,使得在100 L培養條件下,E.coli合成番茄紅素的產量達到34.3 mg/g菌體干質量。WANG CL等[36]在E.coli中引入異源MVA途徑和密碼子優化后的α-金合歡烯合成酶基因,并過表達內源MEP途徑中限速酶FPPS編碼基因IspA,使E.coli生產α-金合歡烯的產量達到380 mg/L。
第二個策略是截斷或抑制與目的產物利用共同前體的競爭途徑,使前體更多地用于目標產物的合成,如:敲除E.coli中gdh、zwf、iclR等基因。TAWORNSAMRETKIT I等[37]基于約束建模法中的通量分析法對合成E.coli[30]中芳樟醇合成的代謝網絡進行分析,并利用單基因敲除分析法來提高芳樟醇的產量,在分析后發現與未敲除gdh基因菌株相比,敲除gdh基因后,該合成E.coli中芳樟醇的產量提高了14倍。CHENY Y等[38]利用CIChE整合表達載體將番茄紅素合成基因整合到E.coli基因組中,并利用三氯生誘導異源基因拷貝數的增加,再通過過表達基因appY,替換其天然啟動子為T5,敲除E.coli中iclR基因等方法對E.coli合成番茄紅素的產量進行優化,使番茄紅素的產量達到33.43 mg/g菌體干質量。
3.2 真核微生物
與原核微生物相比,真核微生物中擁有內源MVA途徑,在前體供應上有天然的優勢,且從安全方面講,釀酒酵母、解酯耶氏酵母(Yarrowia lipolytica)也比E.coli有更高的安全性,故利用真核微生物,特別是酵母來生產食品用萜類化合物有更多的研究。
在真核微生物中,為增加異源萜類化合物的合成,第一個策略是過表達MVA途徑中限速酶(HMGR、IDI、GPPS、FPPS、GGPPS)編碼基因以增加MVA途徑提供的前體,可以通過使用強啟動子引導基因轉錄、增加基因拷貝數的手段實現基因過表達。第二個策略是對代謝途徑中關鍵酶進行修飾以增加酶的催化活力和穩定性,最終提高目標產物的產量,可以通過定點突變、定向進化、蛋白融合的手段來實現。第三個策略是通過抑制競爭途徑中基因的表達、外源增加競爭途徑的合成產物來減少競爭途徑對共同前體的利用,使共同前體更多地用于目標產物的合成。目前,越來越多的研究采用多策略協同實施來盡可能提高目的產物的產量。
3.2.1 釀酒酵母
釀酒酵母(Saccharomyces cerevisiae)作為酵母中的模式菌株,廣泛應用于各種化合物的異源合成,在芳樟醇、β-胡蘿卜素、番茄紅素等食品用萜類的合成中有研究。
AMIRIP等[39]在S.cerevisiae中異源表達LIS的編碼基因,通過過表達tHMG1,替換啟動子為阻遏型啟動子MET3抑制ERG9表達的方法增加了FPP向芳樟醇合成的通量,使S.cerevisiae中芳樟醇產量達到95μg/L。DENGY等[40]在S.cerevisiae中將異源芳樟醇合酶與內源FPPS以融合蛋白的形式表達,通過優化肽接頭長度、蛋白連接方式以及培養條件,最終LIS與FPPS的N末端相連且以(GGGGS)3連接的融合蛋白使菌株芳樟醇產量最高,達到(240.64±5.31)μg/L。SUN Y X等[41]利用逆代謝工程的方法對S.cerevisiae異源合成β-胡蘿卜素進行了研究。通過實驗發現,單獨過表達MVA途徑中基因不能高效提高β-胡蘿卜素的合成,通過外源添加不飽和脂肪酸,增加了(acetyl-CoA)合成β-胡蘿卜素的通量,最終在添加60 mg/L棕櫚油酸時,S.cerevisiae異源合成β-胡蘿卜素的產量達到2.83 mg/g菌體干質量。XIEW P等[42]利用定向進化和代謝工程的手段構建番茄紅素高產S.cerevisiae菌株。首先在S.cerevisiae中異源表達經修飾的雙功能酶CrtYB,通過定向進化的方法去除了該酶中的番茄紅素環化酶功能域,乃保留八氫番茄紅素合成酶的功能。第二步,將修飾后的CrtYB與來自發夫酵母的CrtE、CrtI以及釀酒酵母的tHMG1基因共表達。第三步,再通過定向進化對CrtE進行修飾和改變各Crt基因的拷貝數創造多個途徑變體對產量進行優化。最終通過補料分批發酵,番茄紅素產量達到1.61 g/L。
3.2.2 解酯耶氏酵母
解酯耶氏酵母屬于非傳統酵母,是油脂酵母中的模式菌株,近幾年針對解酯耶氏酵母在合成生物學中的研究越來越多,在食品用萜類,尤其是疏水性萜類的異源合成中也得到了廣泛的利用。
CAOX等[43]首先在Y.lipolytica中過表達異源LIS編碼基因,實現了芳樟醇的異源合成。之后在對LIS與MVA途徑中酶的編碼基因(HMG1、ERG8、ERG10、ERG12、ERG19、IDI1)分別共過表達的研究發現:LIS編碼基因與IDI1共過表達時芳樟醇產量最高。接下來將LIS、IDI1與定點突變后的ERG20F88W-N119W共過表達使芳樟醇產量進一步提高。最后通過以檸檬酸和丙酮酸作為碳源的搖瓶培養,使Y.lipolytica芳樟醇產量達到(6.96±0.29)mg/L。CAOX等[44]在Y.lipolytica中異源表達密碼子優化后的LS和橙花基焦磷酸合酶1(neryl diphosphate synthase 1,NDPS1)的編碼基因,實現了Y.lipolytica中檸檬烯的生產。通過過表達MVA途徑中HMGR和MK的編碼基因tHMG1和ERG12,向培養基中添加適量丙酮酸和十二烷對培養條件的優化,使得檸檬烯在解酯耶氏酵母中的產量達到23.56 mg/L。YANGX等[45]將密碼子優化后的α-金合歡烯合酶基因(optFS)在Y.lipolytica中異源表達,實現了Y.lipolytica中α-金合歡烯的合成。通過將optFS與ERG20以融合蛋白的形式表達,過表達tHMG1、IDI、ERG20的手段提高了α-金合歡烯的產量,最后通過補料分批發酵使Y.lipolytica中α-金合歡烯產量達到(259.98±2.15)mg/L。MATTH?USF等[46]將的來自菠蘿泛菌的crtB和crtI基因經密碼子優化后在Y.lipolytica中異源表達,并過表達類異戊二烯合成途徑中限速酶基因(GGS1、HMG1),以增加番茄紅素合成中前體的供應。隨后,通過敲除內源代謝中β-氧化第一步涉及基因(POX1、POX2、POX3、POX4、POX5、POX6)和編碼甘油醛-3-磷酸脫氫酶基因(GUT2)的方法增加胞內脂質體的含量,以提高胞內番茄紅素的積累。最后,補料分批發酵使Y.lipolytica中番茄紅素的產量達到16 mg/g菌體干質量。GAO SL等[47]敲除了DNA連接蛋白ku70的核心,提高了Y.lipolytica整合DNA長片段的效率,通過異源表達基因carRp和carB,實現了β-胡蘿卜素在Y.lipolytica中的合成。之后進行了β-胡蘿卜素合成所需的內源基因(ERG10、ERG13、tHMGR、ERG12、ERG8、ERG19、IDI、ERG20、GGS1)和外源基因(carRP、carB、carRP)在Y.lipolytica中的多拷貝整合試驗,發現在將多拷貝carRp、tHMGR整合到Y.lipolytica基因組中時,β-胡蘿卜素產量最高。最后通過補料分批發酵中對培養條件的優化,使β-胡蘿卜素在Y.lipolytica的產量達到4 g/L。
4 展望
目前,雖然有多種食品用萜類化合物實現了微生物的生物合成,但由于受合成量較低、復雜萜類化合物不能實現終產物的合成、工程菌株性狀不穩定等因素的制約,無法實現實際產業化的應用。針對存在的問題,一方面,隨著利用基因工程、代謝工程的手段對萜類化合物生物合成途徑更深入的研究,能夠進一步闡明復雜萜類化合物代謝途經,鑒定其中涉及的酶及相關基因,對目標物質的代謝進行更加精確、適當的調控,以提高產量,實現復雜萜類化合物完整合成。另一方面,通過基因組測序等手段,不斷增加對模式菌株性狀、功能的認識,根據不同微生物的特點來匹配其最適合生產的化合物,對微生物資源進一步挖掘和最適的改造,使之服務于食品用萜類的低成本、規模化合成。

