硼摻雜金剛石薄膜電極在酸堿鹽中的電化學性質研究
許青波,王傳新,代 凱,鐘 艷,王旭杰,王 濤,王升高
(武漢工程大學材料科學與工程學院 湖北省等離子體化學與新材料重點實驗室,武漢 430073)
0 引言
近年來,硼摻雜金剛石(BDD)電極由于其具有寬電化學窗口、低背景電流、高氧演化潛力、低表面吸附性、顯著的化學穩定性和較強的礦化能力等優勢而受到越來越多的關注[1-4]。因此,BDD電極已經應用于許多領域,如電分析和傳感器技術[5-6]、電合成[7]、廢水處理[2]。先前的研究已經證明,在電解水的過程中,BDD電極表面可以產生大量的羥基自由基(OH)[8-9],這是已知的第二強的氧化劑并且伴隨著一個非常高的氧化還原電位。生成的OH極活潑,無選擇性,能與大多數有機物發生強烈反應,產生脫氫、羥基化和羧化衍生物,最終被礦化成CO2、H2O和無機離子[10]。此外,利用BDD電極對有機物(R)的主要降解機理進行了研究。其反應過程可以表達為式(1)、式(2)。

廣闊的潛在電化學窗口使得BDD薄膜電極可以用于檢測具有高正或負氧化還原電勢的化合物,并且可以提供極好的微觀結構穩定性[11]。BDD薄膜電極還顯示了多氧化還原系統的可逆電子傳遞動力學的準可逆過程,從而為長期的穩定性提供了有利條件。迄今為止,BDD電極應用有效地降解多種有機廢物,如耐火材料有機廢水(苯酚、鄰苯二甲酸二甲酯、苯醌等)[12-15],高色度的染料廢水(剛果紅、黑五染料和橙G)[16-19],有潛在毒性的制藥廢水和生活污水[20-23]等,并且取得了良好的效果。
為了更好地制備硼摻雜金剛石器件,對不同丙酮流量下的BDD薄膜的生長特性以及在不同濃度的酸堿鹽溶液中的電化學特性進行了研究。采用掃描電子顯微鏡對BDD薄膜表面形貌進行了表征,結合XRD對金剛石薄膜的結構進行了分析,以及利用電化學工作站研究了BDD電極的電化學特性。
1 實驗條件及參數
在自制的熱絲化學氣相沉積(HFCVD)裝置中進行了硼摻雜金剛石薄膜實驗。工作氣體為高純H2,純度為99.999%;以丙酮為碳源、硼酸三甲酯((CH3O)3B)為硼源,通過氫氣鼓泡的形式分別將源氣體載入反應室中。為保證碳源和硼源的比例調控方便,分別將其置于冰水混合(0℃)條件下,控制源氣體的飽和蒸氣壓恒定。采用P型單晶硅片為實驗襯底,在實驗前需要去除樣品表面的有機雜質將樣品放在丙酮溶液中超聲處理3 min,隨后將硅片放在金剛石微粉懸濁液中進行超聲處理10 min,使襯底表面形成微劃痕以有利于形核,最后在丙酮溶液中清洗干凈。采用兩根直徑為0.5 mm的鉭絲作為熱燈絲,將熱絲溫度維持在約2 300℃;形核氣壓為1.5 kPa;形核階段設定氫氣流量為160 mL/min,設定(丙酮+氫氣)流量為70 mL/min;形核時長為10 min。生長階段試驗參數如表1所列,表中襯底溫度通過紅外光學高溫計測量。

表1HFCVD硼摻雜金剛石生長實驗參數Table1 Experimental parameters of growth of HFCVD boron-doped diamond
電解實驗中,采用制備的BDD薄膜電極為工作電極,鉑片為輔助電極,Ag/AgCl作為參比電極,三電極間距為1.0 cm,溫度為25℃,電解液為5×10-6~5×10-2mol/L的H2SO4、1×10-3~1×10-1mol/L的NaOH溶液和3×10-3~1×10-1mol/L的NaCl溶液。
2 實驗結果與分析
2.1 丙酮體積分數對金剛石薄膜表面狀態的影響
圖1為不同丙酮流量下BDD薄膜的表面和斷面SEM圖,(a)、(b)、(c)的碳源流量分別為40 mL/min、60 mL/min、80 mL/min。隨著碳源濃度的增加,金剛石薄膜的形貌出現了明顯的變化,在丙酮流量為40 mL/min時,金剛石表面呈現出大量的(111)和(110)晶面生長,晶粒粒徑較小約6.25 μm,二次形核量較少,并且生長速率緩慢約為2.78 μm/h;在丙酮流量為60 mL/min時,金剛石以(111)晶向生長為主,呈現出金字塔狀的八面體生長模式,金剛石顆粒大小均勻、結構致密晶型完整,成膜質量好,晶粒棱角清晰晶界明顯,晶粒粒徑約7.08 μm,二次形核量較多,生長速率約為4.86 μm/h;在丙酮流量升高到80 mL/min時,金剛石二次形核量出現明顯的升高,晶粒粒徑迅速減小到約4.16 μm,生長速率上升約為6.32 μm/h,從斷面可以看出金剛石生長缺陷增加,結構疏松多孔、非金剛石相含量升高。
圖2為不同丙酮流量下金剛石膜的XRD譜線圖,在圖中43.9°和75.3°附近存在尖銳的金剛石衍射峰分別對應為(111)晶面和(220)晶面。可以清晰地觀察到,隨著丙酮流量的增加,金剛石(111)晶面的峰值先增強后減小,(110)晶面先增多后減少。并且硼摻雜金剛石薄膜在低丙酮流量(40 mL/min)下金剛石(110)晶面的峰值強度大于(111)晶面的峰值強度,說明在低丙酮流量下金剛石(110)晶面的生長占主導作用。這與SEM圖中觀察到的結果相吻合。
實驗結果表明,丙酮流量對BDD薄膜的生長有重大的影響,當丙酮流量過低時H原子的濃度含量相對較高,不僅對sp2的石墨相具有良好的刻蝕作用,對sp3狀態的金剛石也出現了嚴重的刻蝕效果,導致在較高的丙酮流量下,金剛石薄膜的生長速率過慢,形核作用減弱,并且金剛石薄膜生長在過量硼源的影響下晶體結構變的不完整,薄膜質量變差電阻較高。隨著丙酮流量的提高,生成的含碳活性基團數量增多,形核密度提高,金剛石薄膜的生長速率增大,金剛石的晶型較完整,薄膜質量較高電阻降低。當丙酮流量過高時,H原子濃度相對較低,對金剛石生長過程中的非金剛石相的刻蝕作用減弱,導致金剛石薄膜生長雜質含量提高,缺陷增多生長速率明顯增大,由于含碳活性基團數量的大幅度提高,金剛石生長的二次形核現象明顯,晶粒粒徑較小,并且硼源比例減小薄膜電阻升高。所以采用在丙酮流量為60 mL/min時制備的硼摻雜金剛石薄膜作為電化學實驗的測試電極。

圖1 不同丙酮流量下BDD薄膜的表面和斷面SEM圖Fig.1 surface and section SEM of BDD film under different acetone flow
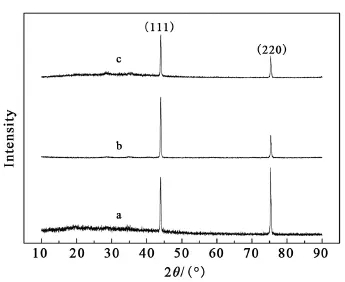
圖2 不同丙酮流量下金剛石膜的XRD譜線圖Fig.2 XRD pattern of diamond film under different acetone flow rates
2.2 不同濃度的電解質對電化學窗口的影響
電化學窗口是衡量電極材料的電催化能力的重要指標,電化學窗口越寬廣,尤其是陽極的析氧過電位越高,越有利于高電位下氧化反應的發生及強氧化性中間體的合成,BDD電極具有很寬的電勢窗口和很低的背景電流,但在不同的電解質中具有不同的電化學窗口。采用丙酮流量為60 mL/min下沉積的硼摻雜金剛石為電極,電解H2SO4、NaOH和NaCl溶液,對不同濃度的酸堿鹽電解質的電化學窗口(U)、氧化還原電位以及電極電流強度的影響進行了研究。
圖3為丙酮流量為60 mL/min下沉積的硼摻雜金剛石電極,電解不同濃度的H2SO4溶液的電化學循環伏安曲線,掃描速率均為100 mV/s。在電解濃度為5×10-2mol/L的H2SO4溶液(pH=1)時,電極的析氫過電位為-1.188 V,析氧過電位為1.896 V,所以對應電化學窗口為3.084 V,背景電流為50 μA;在電解濃度為5×10-4mol/L的H2SO4溶液(pH=3)時,電極的析氫過電位為-1.221 V,析氧過電位為1.791 V,所以對應電化學窗口為3.012 V,背景電流為50 μA;在電解濃度為5×10-6mol/L的H2SO4溶液(pH=5)時,電極的析氫過電位為-1.253 V,析氧過電位為1.772 V,所以對應電化學窗口為3.025 V,背景電流為50 μA;隨著H2SO4濃度的變化,電化學窗口的變化并不顯著,但電解質溶液的析氫析氧過電位隨H2SO4濃度的減小而減小,說明H+的濃度越高析氫反應越容易,析氧反應越困難。

圖3 不同濃度H2SO4溶液中的BDD薄膜電極的循環伏安特性曲線(掃描率:100 mV/s)Fig.3 Cyclic voltammograms of the BDD film electrodes in different concentrations of H2SO4solution(scan rate:100 mV/s)
圖4為丙酮流量為60 mL/min下沉積的BDD電極,電解不同濃度的NaOH溶液的電化學循環伏安曲線,掃描速率均為100 mV/s。在電解濃度為1×10-3mol/L的NaOH溶液(pH=11)時,電極的析氫過電位為-1.524 V,析氧過電位為1.141 V,所以對應電化學窗口為2.665 V,背景電流為50 μA;在電解濃度為1×10-2mol/L的NaOH溶液(pH=12)時,電極的析氫過電位為-1.683 V,析氧過電位為1.067 V,所以對應電化學窗口為2.750 V,背景電流為50 μA;在電解濃度為1×10-1mol/L的NaOH溶液(pH=13)時,電極的析氫過電位為-1.711 V,析氧過電位為0.834 V,所以對應電化學窗口為2.545 V,背景電流為50 μA;隨著NaOH濃度的變化,電化學窗口的變化并不顯著,但電解質溶液的析氫析氧過電位隨NaOH濃度的減小而減小,說明OH-的濃度越高析氧反應越容易,析氫反應越困難。

圖4 不同濃度NaOH溶液中的BDD薄膜電極的循環伏安特性曲線(掃描率:100 mV/s)Fig.4 Cyclic voltammograms of the BDD film electrodes in different concentrations of NaOH solution(scan rate:100 mV/s)
圖5為丙酮流量為60 mL/min下沉積的BDD電極,電解不同濃度的NaCl溶液的電化學循環伏安曲線,掃描速率均為100 mV/s。在電解濃度為3×10-3mol/L的NaCl溶液(pH=7)時,電極的析氫過電位為-1.526 V,析氧過電位為1.505 V,所以對應電化學窗口為3.031 V,背景電流為50 μA;在電解濃度為1×10-2mol/L的NaCl溶液(pH=7)時,電極的析氫過電位為-1.688 V,析氧過電位為1.567 V,所以對應電化學窗口為3.225 V,背景電流為50 μA;在電解濃度為1×10-1mol/L的NaCl溶液(pH=7)時,電極的析氫過電位為-1.737 V,析氧過電位為1.506 V,所以對應電化學窗口為3.243 V,背景電流為50 μA;隨著NaCl濃度從3×10-3mol/L增加到1×10-2mol/L,電化學窗口有明顯的增大;NaCl濃度從1×10-2mol/L增加到1×10-1mol/L,電化學窗口趨于穩定。并且氧化峰和還原峰的形狀基本呈現出對稱的形態,氧化峰電流和還原峰電流的比值近似等于1,表明BDD電極表面進行的是一個準可逆電化學反應,電極保持了高度的穩定性。

圖5 不同濃度NaCl溶液中的BDD薄膜電極的循環伏安特性曲線(掃描率:100 mV/s)Fig.5 Cyclic voltammograms of the BDD film electrodes in different concentrations of NaCl solution(scan rate:100 mV/s)
在標準液中水的理論分解電壓E理論為1.229 V,實驗所測得的電化學窗口遠大于理論分解電壓,這是因為在不同的電極材料上存在不同的H2和O2析出超電勢[24-25]。在實驗中發現NaOH溶液的電化學窗口相對于H2SO4溶液的電化學窗口,析氫過電位與析氧過電位出現了明顯的右移,這與電解水時的標準電極電勢[24]變化趨勢相吻合,在酸性介質中,陽極電極電勢為1.229 V(2H2O-4e-=O2↑+4H+),陰極電勢為0 V(4H++4e-=2H2↑);在堿性介質中,陽極電極電勢為0.401 V(4OH--4e-=O2↑+2H2O),陰極電勢為-0.828 V(4H2O+4e-=2H2↑+4OH-)。與中性的NaCl溶液電化學窗口相比較中性溶液的電化學窗口更寬,在其他報道[26]中有相似的結果,推測在中性介質中與酸性堿性介質中的電極反應機理均不相同所導致。在H2SO4溶液、NaOH溶液和NaCl溶液中研究了BDD電極的電化學窗口,得出BDD電極的電化學窗口大小在不同溶液中寬度是不一樣的,但是均表現出較寬的電化學窗口,雖然與電解液的濃度有關,但是電化學窗口差值并不明顯,說明BDD電極具有很強的電化學氧化性能。
3 結論
為了更好地制備硼摻雜金剛石器件,研究了丙酮流量對金剛石薄膜微觀結構及其在酸堿鹽介質中的電化學性質。隨著丙酮流量的提高,BDD薄膜的生長速率逐漸提高,在一定流量范圍內,BDD薄膜的致密性和晶粒粒徑隨丙酮流量的提高而提高。當丙酮流量超過一定范圍時,BDD薄膜的致密性降低、缺陷增多、非金剛石相含量提高。通過對比,當丙酮流量為60 mL/min時生長的BDD薄膜結構完整、晶粒粒徑較大、致密性良好、生長速率較快。與此同時,將制得的BDD薄膜在酸堿鹽介質中進行了電化學測試,測量了BDD電極在不同濃度的H2SO4溶液、NaOH溶液和NaCl溶液中的電化學窗口,結果表明不同溶液中的BDD薄膜電極的電化學窗口是不一樣的,相同溶液中電化學窗口的寬度隨溶液濃度的變化不大。在所有的溶液特別是在中性溶液中具有非常寬廣的電化學窗口,具有很強的電化學氧化性能。

