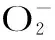甜瓜抵抗鏈格孢侵染能力差異 與活性氧相關(guān)代謝的關(guān)系
李 夢(mèng),馮作山,瑪爾哈巴·帕爾哈提,張明明,王海瑞,夏 璇,白羽嘉
(新疆農(nóng)業(yè)大學(xué)食品科學(xué)與藥學(xué)學(xué)院,新疆烏魯木齊 830052)
厚皮甜瓜為新疆特色經(jīng)濟(jì)作物,由于產(chǎn)期正值高溫夏季,加之缺乏有效保鮮處理和必要冷鏈貯運(yùn),使得采后腐爛頗為嚴(yán)重,造成巨大的經(jīng)濟(jì)損失[1]。多種真菌與厚皮甜瓜采后腐爛有關(guān),鏈格孢菌(Alternariaalternata)引起的黑斑病是導(dǎo)致采后甜瓜腐爛的重要原因[2]。
伽師瓜和86-1甜瓜是新疆特色厚皮甜瓜,前者為晚熟品種,耐貯運(yùn);后者為中晚熟品種,耐藏性一般[3]。兩種甜瓜肉質(zhì)松脆,甘甜爽口,果肉顏色相近,呈橘紅色;果皮存在較大差異,伽師瓜果皮致密無(wú)網(wǎng)紋或少網(wǎng)紋,為墨綠色;86-1甜瓜果皮富集網(wǎng)紋,為黃色,夾雜綠色條紋。研究發(fā)現(xiàn),鏈格孢侵染伽師瓜和86-1甜瓜第0~14 d,果實(shí)未出現(xiàn)明顯病斑,但在侵染中后期,病斑迅速擴(kuò)大,86-1甜瓜病斑大于伽師瓜[4]。兩種甜瓜對(duì)病原菌侵染的抵抗能力存在差異,果皮是果實(shí)抵御病原菌侵染的第一道防線[5],推測(cè)侵染前期果皮有效阻止了病原菌的侵染,中后期病原菌突破果皮的防御,果肉抵御能力較弱,病原菌在果肉中大量繁殖,病斑直徑迅速擴(kuò)大。
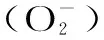
近年來(lái)對(duì)甜瓜采后病害的研究多有報(bào)道,但是主要集中在采用草酸、硅酸鈉、水楊酸、殼聚糖、苯并噻重氮、一氧化氮等處理研究甜瓜果肉的層面[7,11-15]。對(duì)甜瓜自身抵抗病原菌侵染的研究相對(duì)不足,且對(duì)甜瓜與甜瓜組織(果皮與果肉)抗病性差異研究較少。本研究以伽師瓜和86-1甜瓜果實(shí)為試驗(yàn)材料,接種鏈格孢,測(cè)量貯藏期間果皮與果肉病斑大小,分析活性氧相關(guān)代謝的變化規(guī)律,研究甜瓜與甜瓜組織抵抗病原菌侵染能力差異與活性氧相關(guān)代謝的關(guān)系,為甜瓜采后病害的控制研究提供理論依據(jù)。
1 材料與方法
1.1 材料與儀器
伽師瓜(卡拉克塞) 采摘于新疆喀什地區(qū)伽師縣,選取可溶性固形物≥14%,單果重(3.5±0.5) kg,無(wú)病蟲(chóng)害、無(wú)機(jī)械損傷的果實(shí);86-1甜瓜 采摘于新疆喀什地區(qū)伽師縣,選取可溶性固形物≥15%,單果重(3.8±0.5) kg,無(wú)病蟲(chóng)害、無(wú)機(jī)械損傷的果實(shí);鏈格孢菌 由新疆農(nóng)業(yè)大學(xué)食品科學(xué)與藥學(xué)學(xué)院微生物實(shí)驗(yàn)室提供,分離自伽師瓜自然發(fā)病的果實(shí),PDA(馬鈴薯葡萄糖瓊脂培養(yǎng)基)4 ℃斜面保存;冰醋酸、丙酮、無(wú)水醋酸鈉、聚乙二醇6000、聚乙烯吡咯烷酮(PVPP)、鄰苯二酚、愈創(chuàng)木酚、磷酸氫二鈉、磷酸二氫鈉、二硫蘇糖醇(DTT)、甲硫氨酸、氮藍(lán)四唑(NBT)、核黃素、濃氨水、硫酸、鹽酸、30% H2O2、Triton X-100、EDTA-Na2等 均為分析純(AR),購(gòu)自天津市光復(fù)精細(xì)化工研究所。
FA2104N型電子天平 上海民橋精密科學(xué)儀器有限公司;NBCJ-B型無(wú)菌操作臺(tái)、MHP-250型恒溫培養(yǎng)箱 上海鴻都電子科技有限公司;LDZX-50KBS型立式壓力蒸汽滅菌器 上海申安醫(yī)療器械廠;TGL-16G型高速冷凍離心機(jī) 上海安亭科學(xué)儀器廠;TU-1810型紫外-可見(jiàn)分光光度計(jì) 北京普析通用公司;FE20型pH計(jì) 梅特勒-托利多儀器有限公司;XSP-2C型顯微鏡 上海蔡康光學(xué)儀器有限公司。
1.2 實(shí)驗(yàn)方法
1.2.1 損傷接種與取樣 鏈格孢接種PDA固體培養(yǎng)基,28 ℃培養(yǎng)7 d,收集孢子。用含有0.01% Tween-80的無(wú)菌水配制濃度為1×106個(gè)/mL孢子懸浮液。整顆甜瓜用2%過(guò)氧化氫清洗表面,并浸泡30 s進(jìn)行消毒,清水沖洗干凈后晾干,7 ℃預(yù)冷。在甜瓜果實(shí)赤道等距刺孔6個(gè)(直徑3.5 mm),深度為5 mm,接種20 μL上述孢子懸浮液,對(duì)照組接入等量的無(wú)菌水。接種后,置于7 ℃、相對(duì)濕度85%~90%的冷庫(kù)貯藏。
分別于0、3、6、9、12、15、18、21、24、27、30 d取甜瓜病斑周圍5 mm處的果皮與果肉組織(對(duì)照取接種處周圍5 mm組織),每次隨機(jī)選取9個(gè)甜瓜進(jìn)行取樣,液氮速凍,-80 ℃保存。
1.2.2 病斑直徑的測(cè)量 在接種鏈格孢部位將甜瓜果實(shí)縱向剖開(kāi),測(cè)定果實(shí)過(guò)敏反應(yīng)組織,每次測(cè)定6個(gè)果實(shí),計(jì)算平均值,即為病斑直徑。
1.2.3 H2O2含量的測(cè)定 參照曹建康等[16]的方法,計(jì)算每克鮮質(zhì)量果蔬組織中過(guò)氧化氫的含量,結(jié)果以μmol·g-1FW表示。
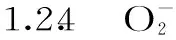
1.2.5 丙二醛(MDA)含量的測(cè)定 參照李合生等[17]的方法,結(jié)果以nmol·g-1FW表示。
1.2.6 PPO活性的測(cè)定 參照曹健康等[16]的方法,以每克鮮重果蔬樣品每分鐘吸光度變化值增加1時(shí)為1個(gè)活性單位(U),結(jié)果以U·g-1FW表示。
1.2.7 POD活性的測(cè)定 參照曹健康等[16]的方法,以每克鮮重樣品每分鐘吸光度變化值增加1時(shí)為1個(gè)活性單位(U),結(jié)果以U·g-1FW表示。
1.2.8 SOD活性的測(cè)定 采用NBT方法[16]。以每分鐘每克鮮重組織的反應(yīng)體系對(duì)氮藍(lán)四唑(NBT)光化還原的抑制為50%時(shí)為一個(gè)SOD活性單位(U),結(jié)果以U·g-1FW表示。
1.2.9 CAT活性的測(cè)定 參照Ren等[18]的方法,以每克鮮重組織每分鐘OD值變化0.01為1 U,用U·g-1FW表示。
1.3 數(shù)據(jù)分析與作圖
采用SPSS 19.0軟件對(duì)實(shí)驗(yàn)數(shù)據(jù)進(jìn)行處理分析,Origin 8.5軟件繪圖。
2 結(jié)果與分析
2.1 鏈格孢侵染甜瓜果實(shí)病斑直徑的變化
鏈格孢侵染甜瓜第9 d,果皮與果肉出現(xiàn)病斑,并隨貯藏時(shí)間呈不斷擴(kuò)大的趨勢(shì),果肉的病斑直徑大于果皮。第30 d,伽師瓜和86-1甜瓜接種果肉病斑直徑分別是伽師瓜和86-1甜瓜接種果皮的1.31、1.33倍,且差異極顯著(p<0.01)。并且86-1甜瓜接種果皮與接種果肉病斑直徑分別是伽師瓜接種果皮與接種果肉的1.28、1.30倍,且差異極顯著(p<0.01)(圖1A)。從第15 d開(kāi)始,86-1甜瓜接種果皮與接種果肉的病斑擴(kuò)展速度分別大于伽師瓜接種果皮與接種果肉(圖1B)。原因可能是,86-1甜瓜果皮與果肉的結(jié)構(gòu)與組分更適合鏈格孢菌的生長(zhǎng)繁殖。

圖1 鏈格孢侵染甜瓜果實(shí)病斑直徑(A) 和病斑直徑變化量(B)的變化Fig.1 Change in lesion diameter(A)and lesion diameter’s amount(B)of muskmelon fruit inoculated with A.alternata
2.2 鏈格孢侵染對(duì)甜瓜果實(shí)活性氧產(chǎn)生的影響
2.2.1 對(duì)H2O2含量的影響 貯藏伽師瓜前9 d,接種組果皮與果肉的H2O2含量顯著高于對(duì)照組果皮與果肉(p<0.05),貯藏第12 d后,接種組果皮與果肉的H2O2含量始終低于對(duì)照組。接種組果皮與果肉的H2O2含量在第9 d達(dá)到峰值,對(duì)照組果皮與果肉H2O2含量在第12 d達(dá)到峰值,第9 d接種組果皮與果肉的H2O2含量峰值分別是第12 d對(duì)照組果皮與果肉峰值的1.27、1.25倍,且差異極顯著(p<0.01)。且第9 d接種果皮的H2O2含量峰值是同一天接種果肉含量峰值的1.79倍,且差異極顯著(p<0.01)(圖2A)。
貯藏86-1甜瓜前9 d,接種組果皮與果肉的H2O2含量顯著高于對(duì)照組(p<0.05),并在貯藏第12 d后,接種組果皮與果肉H2O2含量始終低于對(duì)照組。貯藏第9 d,接種組果皮與果肉的H2O2含量達(dá)到峰值,對(duì)照果皮H2O2含量在第9 d達(dá)到峰值,而對(duì)照果肉H2O2含量在第15 d達(dá)到峰值。第9 d接種組果皮與果肉的H2O2含量峰值分別是對(duì)照組第9 d果皮與第15 d果肉峰值的1.42倍,且差異極顯著(p<0.01)和1.12倍,差異顯著(p<0.05)。接種果皮的H2O2含量峰值是接種果肉含量峰值的1.76倍,且差異極顯著(p<0.01)(圖2B)。

圖2 鏈格孢侵染對(duì)伽師瓜(A) 和86-1甜瓜(B)H2O2含量的影響Fig.2 Effects of A. alternata infection on H2O2 content of Jiashi(A)and 86-1 muskmelon(B)fruit
在貯藏期間,兩種甜瓜果皮與果肉的H2O2含量呈現(xiàn)先升高后降低的變化趨勢(shì),甜瓜接種果皮與對(duì)照果皮的H2O2含量均分別高于甜瓜接種果肉與對(duì)照果肉。伽師瓜第9 d接種組果皮與果肉的H2O2含量峰值分別是86-1甜瓜第9 d接種組果皮與果肉含量峰值的1.40、1.38倍,且差異極顯著(p<0.01)。原因是鏈格孢侵染初期,甜瓜爆發(fā)ROS用來(lái)防御鏈格孢菌的侵染。侵染中后期H2O2含量下降,是由于ROS清除酶的作用,防止ROS含量過(guò)高對(duì)甜瓜果實(shí)的進(jìn)一步傷害,這與蘋(píng)果、桃、枇杷等果實(shí)采后病害的研究結(jié)果一致[19-21]。

圖3 鏈格孢侵染對(duì)伽師瓜(A) 和86-1甜瓜產(chǎn)生速率的影響Fig.3 Effects of A. alternata infection on production rate of Jiashi(A)and 86-1 muskmelon(B)fruit
2.3 鏈格孢侵染對(duì)甜瓜果實(shí)MDA含量的影響
植物在逆境下遭受傷害與ROS積累誘發(fā)的膜脂過(guò)氧化程度密切相關(guān),MDA含量的高低反映細(xì)胞膜脂過(guò)氧化的程度[22]。鏈格孢侵染伽師瓜第30、24 d,接種果肉與接種果皮的MDA含量達(dá)到峰值,接種果肉MDA含量峰值是接種果皮含量峰值的2.42倍,且差異極顯著(p<0.01)(圖4A)。
鏈格孢侵染86-1甜瓜第27 d,接種果肉與接種果皮的MDA含量達(dá)到峰值,接種果肉MDA含量峰值是接種果皮含量峰值的1.41倍,且差異極顯著(p<0.01)(圖4B)。

圖4 鏈格孢侵染對(duì)伽師瓜(A) 和86-1甜瓜(B)MDA含量的影響Fig.4 Effects of A. alternata infection on MDA content of Jiashi(A)and 86-1 muskmelon(B)fruit
在貯藏期間,兩種甜瓜果皮與果肉的MDA含量整體呈現(xiàn)緩慢升高的變化趨勢(shì),接種組甜瓜果皮與果肉的MDA含量均分別低于對(duì)照組果皮與果肉,接種組與對(duì)照組的甜瓜果肉的MDA含量顯著高于對(duì)應(yīng)的接種組與對(duì)照組甜瓜果皮(p<0.05)。86-1甜瓜在第27 d,接種組果皮與果肉的MDA含量峰值分別是伽師瓜第24 d接種果皮與第30 d接種果肉MDA含量峰值的1.98、1.19倍,且差異極顯著(p<0.01)。說(shuō)明86-1甜瓜果皮與果肉的細(xì)胞膜脂過(guò)氧化的程度高于伽師瓜果實(shí),86-1甜瓜果皮與果肉的病害較伽師瓜果皮與果肉嚴(yán)重,伽師瓜具有較完整的膜系統(tǒng),與病斑直徑的研究一致。
2.4 鏈格孢侵染對(duì)甜瓜果實(shí)活性氧代謝相關(guān)酶活性的影響
2.4.1 對(duì)PPO活性的影響 PPO能利用O2催化酚類物質(zhì),氧化成對(duì)病原菌有毒害作用的醌類物質(zhì),抵御病原菌的侵入[23]。鏈格孢侵染伽師瓜第21、18 d,接種果皮與接種果肉的PPO活性達(dá)到峰值,接種果皮PPO活性峰值是接種果肉活性峰值的2.00倍,且差異極顯著(p<0.01)(圖5A)。
鏈格孢侵染86-1甜瓜第18、21 d,接種果皮與接種果肉的PPO活性達(dá)到峰值,接種果皮PPO活性峰值是接種果肉活性峰值的1.41倍,且差異極顯著(p<0.01)(圖5B)。
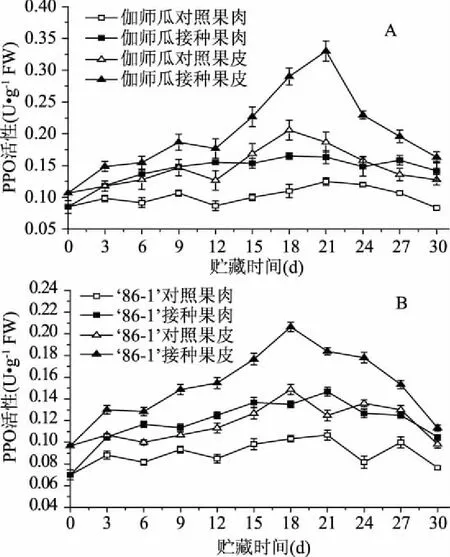
圖5 鏈格孢侵染對(duì)伽師瓜(A) 和86-1甜瓜(B)PPO活性的影響Fig.5 Effects of A. alternata infection on PPO activity of Jiashi(A)and 86-1 muskmelon(B)fruit
在貯藏期間,兩種甜瓜果皮與果肉的PPO活性整體呈現(xiàn)先升高后下降的變化趨勢(shì),接種組甜瓜果皮與果肉的PPO活性均分別顯著高于對(duì)照組果皮與果肉(p<0.05),接種組與對(duì)照組的甜瓜果皮PPO活性均分別顯著高于接種組與對(duì)照組甜瓜果肉(p<0.05)。伽師瓜第21 d接種果皮與第18 d接種果肉的PPO活性峰值分別是86-1甜瓜第18 d接種果皮與第21 d接種果肉活性峰值的1.60倍,差異極顯著(p<0.01)和1.12倍,差異顯著(p<0.05)。
2.4.2 對(duì)POD活性的影響 POD能通過(guò)氧化酚類物質(zhì)分解H2O2,并且能與SOD、CAT相互協(xié)調(diào)配合,清除過(guò)多的ROS,使體內(nèi)自由基維持動(dòng)態(tài)平衡,提高植物的抗病性[25]。貯藏伽師瓜第24 d,接種果皮與對(duì)照果皮的POD活性達(dá)到峰值,接種果皮的POD活性峰值是對(duì)照果皮活性峰值的1.16倍,且差異極顯著(p<0.01)(圖6A)。
貯藏86-1甜瓜第21 d,接種果皮與對(duì)照果皮的POD活性達(dá)到峰值,接種果皮的POD活性峰值是對(duì)照果皮活性峰值的1.26倍,且差異極顯著(p<0.01)(圖6B)。
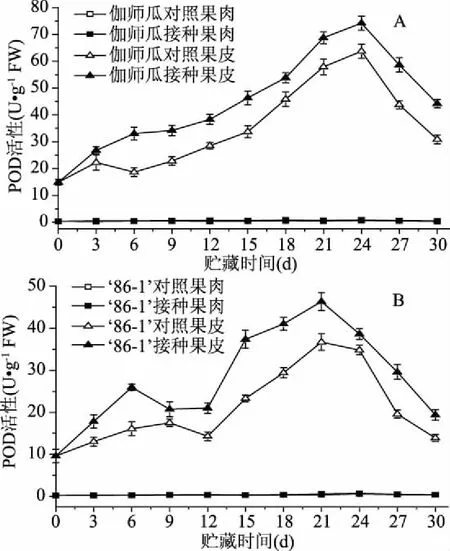
圖6 鏈格孢侵染對(duì)伽師瓜(A) 和86-1甜瓜(B)POD活性的影響Fig.6 Effects of A. alternata infection on POD activity of Jiashi(A)and 86-1 muskmelon(B)fruit
在貯藏期間,兩種甜瓜接種果皮與對(duì)照果皮的POD活性整體呈現(xiàn)先升高后下降的變化趨勢(shì),而甜瓜接種果肉與對(duì)照果肉的POD活性幾乎無(wú)變化,說(shuō)明甜瓜果皮POD活性發(fā)揮主要抵御鏈格孢的作用。接種甜瓜果皮的POD活性均顯著高于對(duì)照果皮(p<0.05),接種果皮與對(duì)照果皮的POD活性均分別極顯著高于接種果肉與對(duì)照果肉(p<0.01)。伽師瓜第24 d接種果皮的POD活性峰值是86-1甜瓜第21 d接種果皮活性峰值的1.60倍,且差異極顯著(p<0.01)。

圖7 鏈格孢侵染對(duì)伽師瓜(A) 和86-1甜瓜(B)SOD活性的影響Fig.7 Effects of A. alternata infection on SOD activity of Jiashi(A)and 86-1 muskmelon(B)fruit
貯藏86-1甜瓜第24 d,接種果皮與對(duì)照果皮的SOD活性達(dá)到峰值。第24 d,接種果皮的SOD活性峰值是對(duì)照果皮活性峰值的1.52倍,且差異極顯著(p<0.01)(圖7B)。
在貯藏期間,兩種甜瓜接種果皮與對(duì)照果皮的SOD活性整體呈現(xiàn)先升高后下降的變化趨勢(shì),而接種果肉與對(duì)照果肉的SOD活性幾乎無(wú)變化,說(shuō)明果皮SOD活性發(fā)揮主要抵抗鏈格孢侵染的作用,同POD。接種果皮的SOD活性均顯著高于對(duì)照果皮(p<0.05),接種果皮與對(duì)照果皮的SOD活性均分別極顯著高于接種果肉與對(duì)照果肉(p<0.01)。伽師瓜第24 d接種果皮的SOD活性峰值是86-1甜瓜第24 d接種果皮活性峰值的1.59倍,且差異極顯著(p<0.01)。
2.4.4 對(duì)甜瓜果實(shí)CAT活性的影響 CAT具有將H2O2轉(zhuǎn)化為H2O和O2的作用[25]。鏈格孢侵染伽師瓜第21、15 d,接種果皮與接種果肉的CAT活性達(dá)到峰值。第21 d接種果皮CAT活性峰值是第15 d接種果肉活性峰值的3.09倍,且差異極顯著(p<0.01)(圖8A)。
鏈格孢侵染86-1甜瓜第18、21 d,接種果皮與接種果肉的CAT活性達(dá)到峰值。第18 d接種果皮CAT活性峰值是第21 d接種果肉活性峰值的3.14倍,且差異極顯著(p<0.01)(圖8B)。

圖8 鏈格孢侵染對(duì)伽師瓜(A) 和86-1甜瓜(B)CAT活性的影響Fig.8 Effects of A. alternata infection on CAT activity of Jiashi(A)and 86-1 muskmelon(B)fruit
在貯藏期間,兩種甜瓜果皮與果肉的CAT活性整體呈現(xiàn)先升高后下降的變化趨勢(shì),接種組果皮與果肉的CAT活性均分別顯著高于對(duì)照組果皮與果肉(p<0.05),接種組與對(duì)照組果皮的CAT活性分別極顯著高于接種組與對(duì)照組果肉(p<0.01)。伽師瓜第21 d接種果皮與第15 d接種果肉的CAT活性峰值分別是86-1甜瓜第18 d接種果皮與第21 d接種果肉的1.47、1.49倍,且差異極顯著(p<0.01)。鏈格孢菌侵染引起甜瓜果實(shí)酶活性的變化規(guī)律與1-MCP處理對(duì)桃果實(shí)采后病害的研究結(jié)果一致[26]。
3 結(jié)論