胃癌組織橫向剪切波速度與患者臨床特征的關系
王小花,何慧療,姜淑英,林益怡
(溫州醫科大學附屬第二醫院 超聲影像科,浙江 溫州 325027)
胃癌是最常見的消化系統腫瘤之一,它的治療及預后與胃癌患者臨床特點密切相關。近年來隨著超聲技術的發展和超聲彈性成像技術的出現,通過探測組織的彈性硬度鑒別其性質顯示了一定的應用價值[1-3]。本研究應用無創的聲輻射力脈沖成像技術(acoustic radiation force impulse,ARFI)對胃壁腫瘤組織進行檢查,探討胃癌組織橫向剪切波速度與胃癌患者臨床特點之間的關系。
1 資料和方法
1.1 一般資料 收集2014年7月至2017年5月期間在溫州醫科大學附屬第二醫院手術且病理證實為胃癌的患者53例,年齡37~80歲,平均(64.7±8.5)歲,其中≥60歲45例,<60歲的8例;男42例,女11例;胃癌部位分為遠端37例,包括胃竇、遠端胃體,近端16例,包括賁門、胃底及近端胃體;腫瘤最大徑:≥5 cm 29例,<5 cm 24例;胃癌浸潤深度參照AJCC胃癌TNM分期標準[4]:侵及漿膜層或穿透漿膜層(T3+T4)41例,未累及漿膜層(T1+T2)12例;淋巴結轉移34例,無淋巴結轉移19例;組織學分化程度分為高分化型16例,中分化型14例,低分化型23例,高、中分化型分別包括高分化乳頭狀腺癌、管狀腺癌及中分化乳頭狀腺癌、管狀腺癌,低分化型包括低、未分化腺癌11例,印戒細胞癌10例,黏液腺癌2例。所有患者均為單發癌,術前未接受過非甾體類抗炎藥、放療、化療及其他免疫治療,在ARFI檢查后1周內行外科手術治療。
1.2 設備與方法 采用西門子ACUSON S2000超聲診斷儀,配備ARFI成像技術軟件,選擇4C1探頭,頻率2.0~5.0 MHz。選用心璋牌胃窗超聲造影劑48 g/人(杭州胡慶馀堂生產),按說明書調制成600 mL均勻懸濁溶液。檢查前患者禁食6 h以上,0.5 h前肌注阿托品0.5 mg以減弱胃蠕動。先用常規二維超聲了解空腹胃、肝、膽、脾、胰、盆腔及腹腔淋巴結情況,再予口服調制好的胃窗造影液,邊口服邊實時動態觀察造影劑經過食管下段、賁門的情況。胃腔充盈后囑受檢者取不同體位,依次掃查賁門、胃底、胃體、胃角、胃竇、幽門及十二指腸球部。確定病灶位置并測量病灶最大徑,然后切換至ARFI模式,應用聲觸診組織定量技術(virtual touch quantification,VTQ)測量胃癌組織的剪切波速度。檢測時囑受檢者吸氣后屏住呼吸,盡量將感興趣區調置于病灶中間位置并距探頭表面3~6 cm,測值時每發射一個推進脈沖后即可自動獲得一個橫向剪切波速度,反映該區域的彈性,見圖1。盡量在同一個屏氣周期內測量病灶部位5次,如病灶范圍較大則在病灶內不同部位間多次測量,分別記錄取平均值。
1.3 統計學處理方法 采用SPSS13.0統計軟件進行統計學分析。計量資料用表示,兩樣本均數比較用成組t檢驗;多個樣本均數比較用單因素方差分析,多個樣本均數間的多重比較用LSD-t檢驗;相關因素分析用多元線性回歸分析。P<0.05為差異有統計學意義。
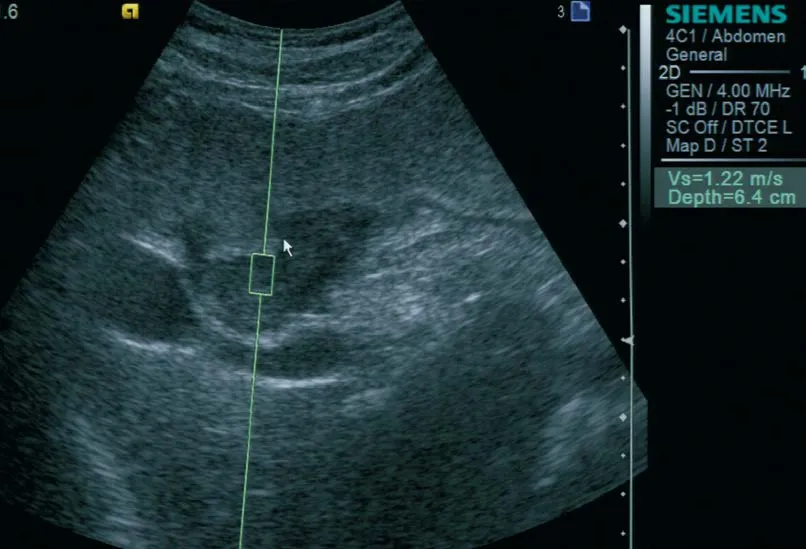
圖1 胃癌患者VTQ測量剪切波速度
2 結果
2.1 胃癌組織橫向剪切波速度與臨床特征的關系
胃癌組織橫向剪切波速度在不同年齡、性別、腫瘤的大小及發生部位、組織分化程度間差異無統計學意義(P>0.05),在不同浸潤深度和有無淋巴結轉移方面,差異有統計學意義(P<0.05)。胃癌組織T1+T2期的橫向剪切波速度低于胃癌組織T3+T4期,有淋巴結轉移的胃癌組織橫向剪切波速度高于無淋巴結轉移的胃癌組織。見表1。
2.2 胃癌組織橫向剪切波速度的多元回歸分析 有無淋巴結轉移(X1)與胃癌組織橫向剪切波速度(呈正相關,差異有統計學意義(P<0.05)。回歸方程為,見表2。
3 討論
據統計胃癌發病率及病死率居我國消化道惡性腫瘤的第一位,各類惡性腫瘤的第二位[5]。胃鏡、超聲內鏡檢查、薄層CT及超聲雙重造影是診斷胃癌最常用的檢查方法。ARFI是無創評估組織彈性硬度的超聲成像技術,包括聲觸診組織成像技術(virtual touch tissue imaging,VTI)和VTQ。VTI與傳統彈性成像技術類似,只能對組織彈性定性或半定量,無具體數值,受主觀因素影響較大[6]。而VTQ具有組織彈性成像量化值,其原理是利用探頭向確定的感興趣區發射推進脈沖,組織受力后產生縱向壓縮和橫向振動,收集這些細微變化并演算出感興趣區域的橫向剪切波速度,從而對組織進行彈性模量估計,間接反映該區域組織的彈性硬度。VTQ從全新的角度反映組織的彈性機械信息,結合常規超聲影像,無創性地獲得檢測特定區域組織的彈性硬度[7]。目前已較多應用于診斷肝、腎、淺表等器官疾病的研究[8-10]。
表1 胃癌組織橫向剪切波速度與臨床特征的關系
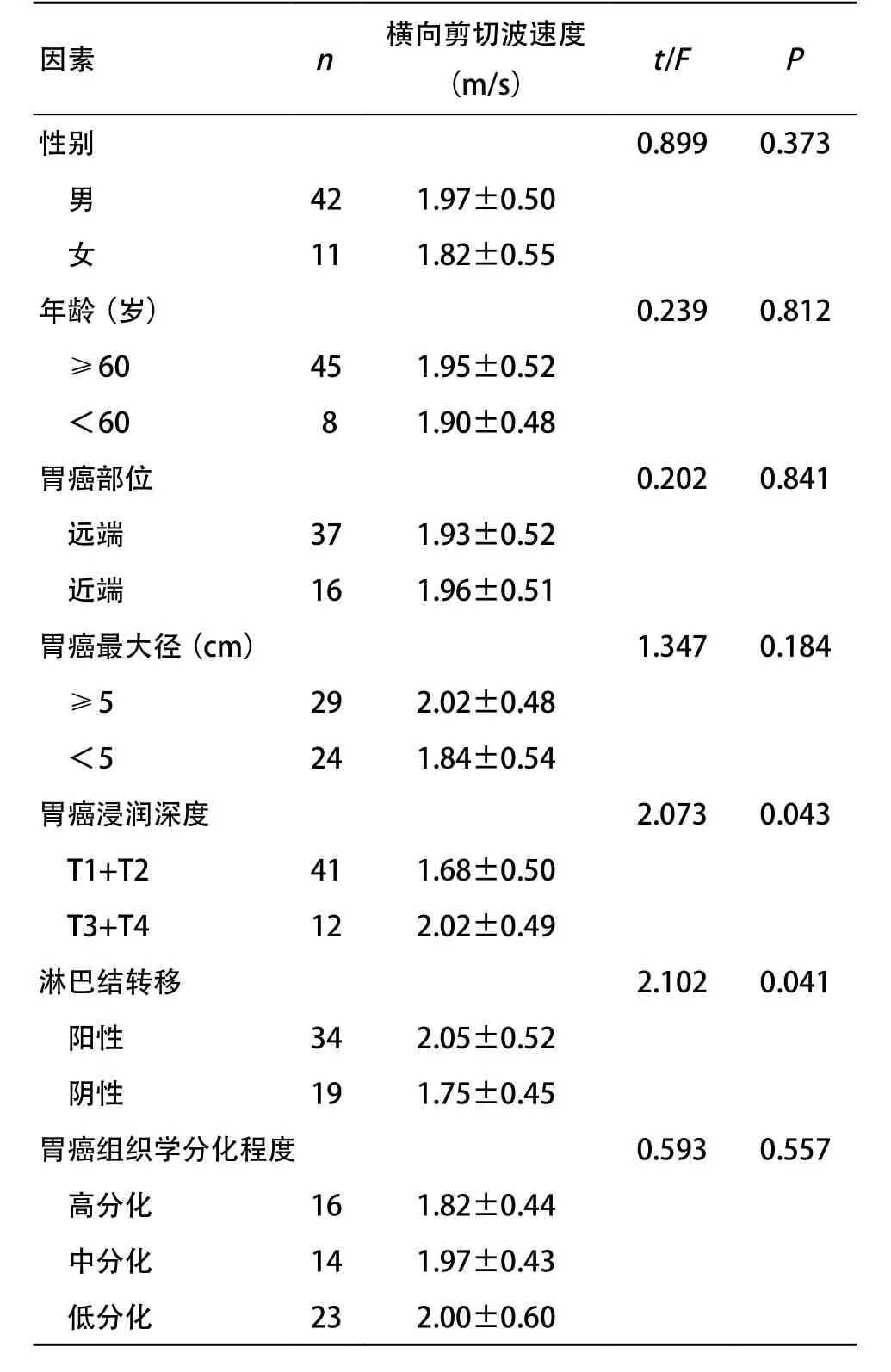
表1 胃癌組織橫向剪切波速度與臨床特征的關系
因素 n 橫向剪切波速度(m/s) t/F P性別 0.899 0.373男42 1.97±0.50女11 1.82±0.55年齡(歲) 0.239 0.812≥60 45 1.95±0.52<60 8 1.90±0.48胃癌部位 0.202 0.841遠端 37 1.93±0.52近端 16 1.96±0.51胃癌最大徑(cm) 1.347 0.184≥5 29 2.02±0.48<5 24 1.84±0.54胃癌浸潤深度 2.073 0.043 T1+T2 41 1.68±0.50 T3+T4 12 2.02±0.49淋巴結轉移 2.102 0.041陽性 34 2.05±0.52陰性 19 1.75±0.45胃癌組織學分化程度 0.593 0.557高分化 16 1.82±0.44中分化 14 1.97±0.43低分化 23 2.00±0.60
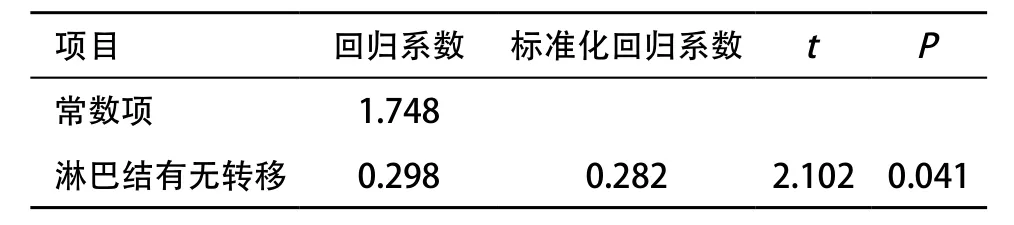
表2 胃癌組織橫向剪切波速度的多元回歸分析
本研究應用ARFI對胃壁腫瘤組織進行檢查,分析橫向剪切波速度與胃癌患者臨床病理學特征之間的關系。結果表明胃癌患者橫向剪切波速度在不同年齡、性別、腫瘤的大小及發生部位間差異無統計學意義(P>0.05),考慮與患者的體型、病灶的部位影響探測深度及樣本量較少有關,也與患者屏氣狀態及操作者技巧等因素有關。
人體不同組織的彈性或硬度改變與組織異常的病理狀態相關,大多數惡性腫瘤由堅硬的病變組織組成,與附近結構的粘連使活動性減低,減小了彈性,從而增加了硬度[11]。胃癌組織分化程度越低,其組織越硬、橫向剪切波速度越高;但本研究結果顯示橫向剪切波速度在不同分化程度間差異并無統計學意義(P>0.05),可能與胃癌組織病理成分及腫瘤組織內部壞死液化程度不等有關,低分化組部分包含了黏液癌及印戒細胞癌,其富含黏液腺細胞,而纖維及膠原組織含量較少、質地柔軟,橫向剪切波速度較小。
隨著胃癌的進展,浸潤深度增加,與附近結構粘連,活動性減低,胃壁硬度增加。本研究中胃癌組織的橫向剪切波速度隨浸潤深度加深而增加(P<0.05)。有淋巴結轉移的胃癌組織橫向剪切波速度高于無淋巴結轉移的胃癌組織,差異有統計學意義(P<0.05)。其原因考慮與胃癌的淋巴結轉移與浸潤深度呈正相關有關,一般淋巴結陽性組多為進展期胃癌,轉移率高達70%,浸潤胃壁組織較深[12]、質地較硬,而淋巴結陰性組多為早期胃癌、浸潤深度較淺、質地柔軟,所以腫瘤組織淋巴結陽性組較淋巴結陰性組硬度較大,橫向剪切波速度高。多因素分析結果顯示有淋巴結轉移與胃癌組織橫向剪切波速度呈正相關,而與浸潤深度無明顯相關性,這可能與隨著腫瘤組織浸潤深度增加,其內部出現壞死液化的可能性越大有關。
胃癌組織橫向剪切波速度與有無淋巴結轉移、腫瘤浸潤深度有關,可作為評價胃癌患者有無淋巴結轉移、腫瘤浸潤深度的一項輔助指標,從臨床角度看,術前行ARFI檢查能夠幫助進一步了解胃癌臨床特征。

