海洋細菌對DMSP的降解及其在極地低溫海域的研究進展
曾胤新
?
海洋細菌對DMSP的降解及其在極地低溫海域的研究進展
曾胤新
(中國極地研究中心, 國家海洋局極地科學重點實驗室, 上海 200136)
DMSP(二甲基巰基丙酸內鹽)是地球上最豐富的有機含硫化合物之一, 同時也是海洋微生物的重要營養物。浮游植物是其主要的生產者。DMSP還是海洋中DMS(二甲基硫)的重要來源和前體, 而DMS的排放與全球氣候變化存在密切關聯。細菌在DMSP的降解及DMS的生成方面扮演著重要角色。有關DMSP生物合成、代謝及其生態影響的研究已開展了近70年, 但涉及高緯度極地低溫海域的相關研究卻為數甚少。本文在簡要介紹DMSP生物合成與代謝, 以及DMSP降解途徑中的關鍵酶基因及其產生菌的基礎上, 結合筆者的工作實踐, 對近年來在極地低溫海域的相關研究進行了介紹并展開了部分討論。隨著國內對微生物驅動水圈地球元素循環的重視, 有關極地海域細菌參與DMSP/DMS代謝的研究工作將極大地增進人們對于微生物在極地海洋生態系統中生態地位的認識, 也對評估極地海洋微生物群落對全球氣候環境變化的響應與反饋具有重要的參考意義。
DMSP(二甲基巰基丙酸內鹽) 降解 海洋細菌 極地
0 引言
DMSP(二甲基巰基丙酸內鹽)是一種主要由海洋浮游植物、大型藻類以及海岸鹽生植物生成的含硫化合物, 可作為浮游植物的胞內滲透調節劑、抗氧化劑以及捕食者威懾物從而發揮重要作用, 在極地的藻類細胞中還可以作為冷凍保護劑[1-3]。每年由海洋藻類產生的DMSP可達10億噸或更多[4]。DMSP在浮游植物細胞中可占到其總碳的10%—20%、總硫的50%—90%[5]。僅在大洋表層水體中, DMSP就可占到海洋浮游植物所固定的碳的10%, 每年的硫產量則約為11.7萬億—103萬億mol[6]。自1948年被發現以來, 研究結果表明DMSP大量分布于表層海水中, 并且作為海洋中重要的碳源與硫源成為許多海洋生物, 尤其是海洋細菌的營養來源, 同時也是全球硫循環中不可或缺的一部分[2]。據推測, 大約在2.5億年之前隨著DMSP的主要生產者腰鞭毛類(也稱甲藻, dinoflagellate)逐漸多樣化, DMSP開始在海洋中變得豐富起來, 這一事件與已知的DMSP降解者—— 玫瑰桿菌支系最初的基因組擴張(genome expansion)時期是一致的[2]。
海洋中的DMSP之所以引起人們的廣泛關注, 其中一個重要原因在于它是DMS(二甲基硫)形成的主要前體, 而DMS是一種對氣候有明顯影響的氣體[7]。大洋水體中的DMS主要分布在真光層, 其含量與初級生產力以及浮游植物的分布有關。海洋中大約30%的DMSP被分解產生DMS[4]。由浮游植物產生并釋放到海水中的DMSP降解后產生的DMS, 在表層海水中處于高度過飽和狀態, 能夠以很大的通量(0.6′1012—1.6′1012mol·a-1)穿過海-氣界面進入大氣[8-10]。40年前科研人員已發現DMS是從海洋排放到大氣當中含量最為豐富的含硫化合物, 在全球硫循環中占有重要地位[7]。DMS作為海水中最重要的還原態揮發性生源有機硫化物, 其釋放量占到全球天然釋放量的50%以上[10-11]。DMS進入大氣后, 經氧化形成硫酸鹽氣溶膠, 成為酸雨的重要貢獻者。此外, 這些氣溶膠容易吸收水分, 可以充當云的凝結核并形成更多的云層。而云層對太陽輻射的反射作用可使地球表面溫度降低, 從而影響全球或區域氣候變化, 形成了DMS對氣候的負反饋效應[10]。這是一個與溫室效應相反的過程。與煤炭燃燒產生的二氧化硫量相比, DMS是進入大氣的硫的最大天然來源, 并且它的氧化產物比人類活動產生的二氧化硫在大氣中的逗留時間更長, 因而對全球硫負荷的貢獻更大[7,12]。作為全球硫、碳循環中的一種重要化合物, DMS對于海洋乃至全球氣候有著潛在的重要影響[13-14], 現已成為全球氣候變化研究領域的熱點之一。
鑒于DMS(P)在海洋生態系統以及全球硫循環中的重要地位與作用, 相關研究工作已經在國內外大量開展。但研究地域大多集中在中、低緯度海域, 對于高緯度的極地低溫海域的認識相對缺乏[15]。北冰洋與南大洋, 被認為是大氣DMS巨大的源, 并且對全球硫的收支具有重要的貢獻[16-17], 其中南極海域DMS的產量估計占全球的10%[18]。DMS通量的增加所產生的負反饋作用, 是否能有助于緩解目前極地面臨的暖化過程還不清楚。因此, 在極區開展關于DMS(P)及其生物地球化學過程的研究具有非常重要的生態學意義。
1 DMSP的生物合成
浮游植物是DMSP的主要生成者, 其中絕大多數屬于橫裂甲藻綱(Dinophyceae)與定鞭藻綱(Prymnesiophyceae), 而這兩個綱又分別以腰鞭毛類(dinoflagellate)與球石藻(coccolithophores)為代表[19]。此外, 在硅藻()、綠藻、珊瑚、高等植物(如甘蔗)、海岸被子植物及, 甚至部分海洋α-變形細菌、珊瑚蟲中, 也發現了生成DMSP的現象[2,20], 但有關這些生物產生DMSP的原因及其用途, 人們還不是全部都清楚。在南大洋區域, 產生DMSP的主要浮游植物有球石藻(屬于定鞭金藻)、棕囊藻()、甲藻等, 而同樣為優勢藻類的硅藻只能產生較少的DMSP[21]。在北極海域, 重要的DMSP生產者也包括定鞭金藻、棕囊藻、硅藻及甲藻[22-23]。
目前所提出的3條DMSP生物合成途徑, 均起始于甲硫氨酸(蛋氨酸), 只是后續的步驟存在差別(圖1[24]): 一條是存在于海洋藻類中的轉氨途徑, 中間產物包括4-甲硫基-2-氧代丁酸(MTOB)、4-甲硫基-2-羥基丁酸(MTHB)以及4-二甲硫基-2-羥基丁酸(DMSHB)。在海洋α-變形細菌也存在這樣的合成途徑; 另一條是存在于被子植物中的甲基化途徑, 中間產物包括S-甲基蛋氨酸(SMM)及DMSP-aldehyde; 還有一條較為少見、僅存在于一種腰鞭毛類中的脫羧途徑, 中間產物包括3-甲硫基丙胺(MTPA)及3-甲基硫代丙酸甲酯(MMPA)。在浮游植物、藻類、珊瑚以及α-變形細菌的DMSP合成途徑中, 存在相似的反應及中間產物, 但它們與被子植物中的合成途徑具有明顯差異, 這些差異表明生物合成DMSP的能力至少進化了兩次[1-2]。
2 DMSP的分解代謝
真核藻類與原核細菌的細胞中都存在能將DMSP裂解生成DMS的酶類。例如, 單細胞的球石藻不但能生成DMSP, 也能通過基因合成一種四聚體的DMSP裂解酶, 將DMSP裂解成DMS與丙烯酸[25-26]。此外, 在共生藻中也存在一種DMSP裂解酶, 但它與僅具有25%左右的相似性[27]。
研究表明, 浮游細菌與藻類的爆發具有一定關聯, 玫瑰桿菌、噬纖維菌-黃桿菌等通常在藻類的爆發期及衰退期達到較高豐度, 說明這些細菌的生長依賴于藻類產生的DMSP等有機質[28-29]。釋放到海水中的DMSP可被浮游細菌通過兩條主要代謝途徑迅速封存和降解(圖2[30])。一條是脫甲基途徑: 大部分, 甚至是絕大部分(50%—90%)的DMSP經由脫甲基途徑生成MMPA、再分解成為甲硫醇(MeSH)和乙醛, 最后以含硫蛋白形式進入微生物食物網[6,31]。來源于DMSP的碳、硫物質可分別占到異養細菌碳、硫需求的15%和100%[32-33]。表層海水中超過一半的浮游細菌能夠將DMSP脫甲基化[34]。屬于α-變形細菌的玫瑰桿菌支系及SAR11支系的細菌通常擁有脫甲基途徑中那些執行特殊且高效的催化反應的酶類[2]。另一條是裂解途徑: DMSP被降解形成DMS與丙烯酸或3-羥基丙酸輔酶A(3HP-CoA)[25,35]。由微生物參與DMSP降解所產生的DMS占據了海洋DMS總產量的90%以上[3]。與真核藻類相比, 以裂解途徑進行DMSP分解代謝的細胞是以細菌為主[2]。而含有DMSP裂解酶的細菌, 其多樣性組成主要分布在α、β以及γ-變形細菌中[2]。
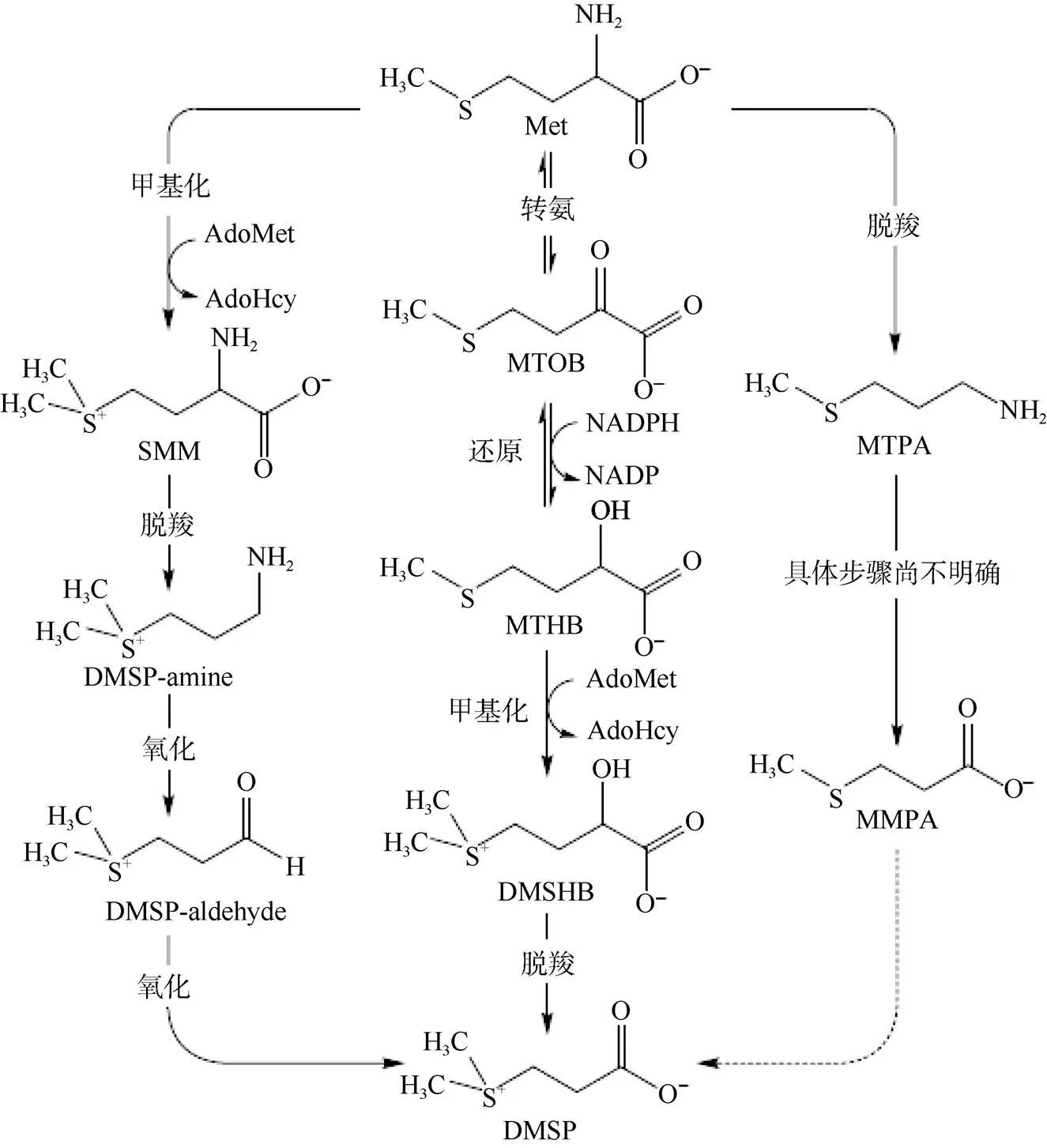
圖1 DMSP的生物合成途徑示意圖(改編自文獻[24])
Fig.1. Proposed DMSP biosynthesis pathways (adapted from reference[24])
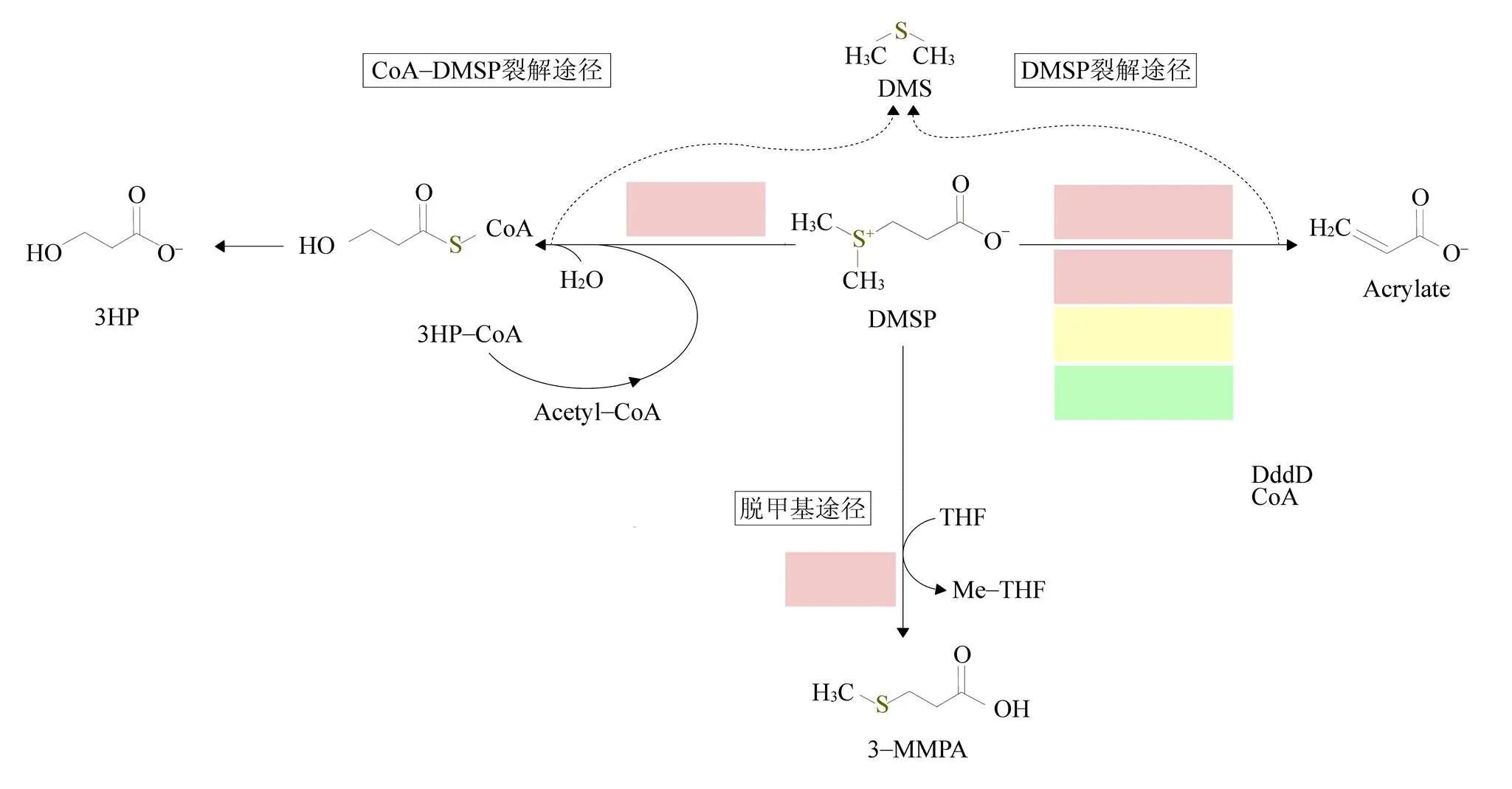
圖2 DMSP的分解代謝途徑示意圖(改編自文獻[30]). 黑色區域中為細菌酶類, 綠色區域為真核生物酶類, 白色區域為真核生物與細菌中均存在的酶類
Fig.2. Proposed DMSP catabolism pathways (adapted from reference [30]). Bacterial enzymes are in black background, eukaryotic in green, and DddP, found in both Domains, in white
由浮游細菌參與的兩條截然不同的DMSP代謝途徑, 在決定是將硫保留在海洋中(即通過脫甲基途徑將硫吸收到海洋微生物食物網中)、還是進入大氣(即通過裂解途徑生成DMS并通過海-氣界面進入大氣)的平衡性方面, 發揮著重要作用。這一方面表明了浮游細菌在海洋生態系統、尤其是上層生態系統的硫循環中所具有的生態學價值, 另一方面也為人們尋求緩解全球變暖提供了新的解決思路[6]: 通過改變硫的循環路徑、將原先進入海洋的硫化物釋放到大氣中, 從而幫助緩解全球變暖。實際上, 在自然界海水中的DMSP只有小部分(約30%)是以DMS的形式被釋放出來, 其余絕大部分是在海洋食物網中重復循環或沉降到深層海水中[4,36]。
3 DMSP分解代謝途徑中的關鍵功能基因
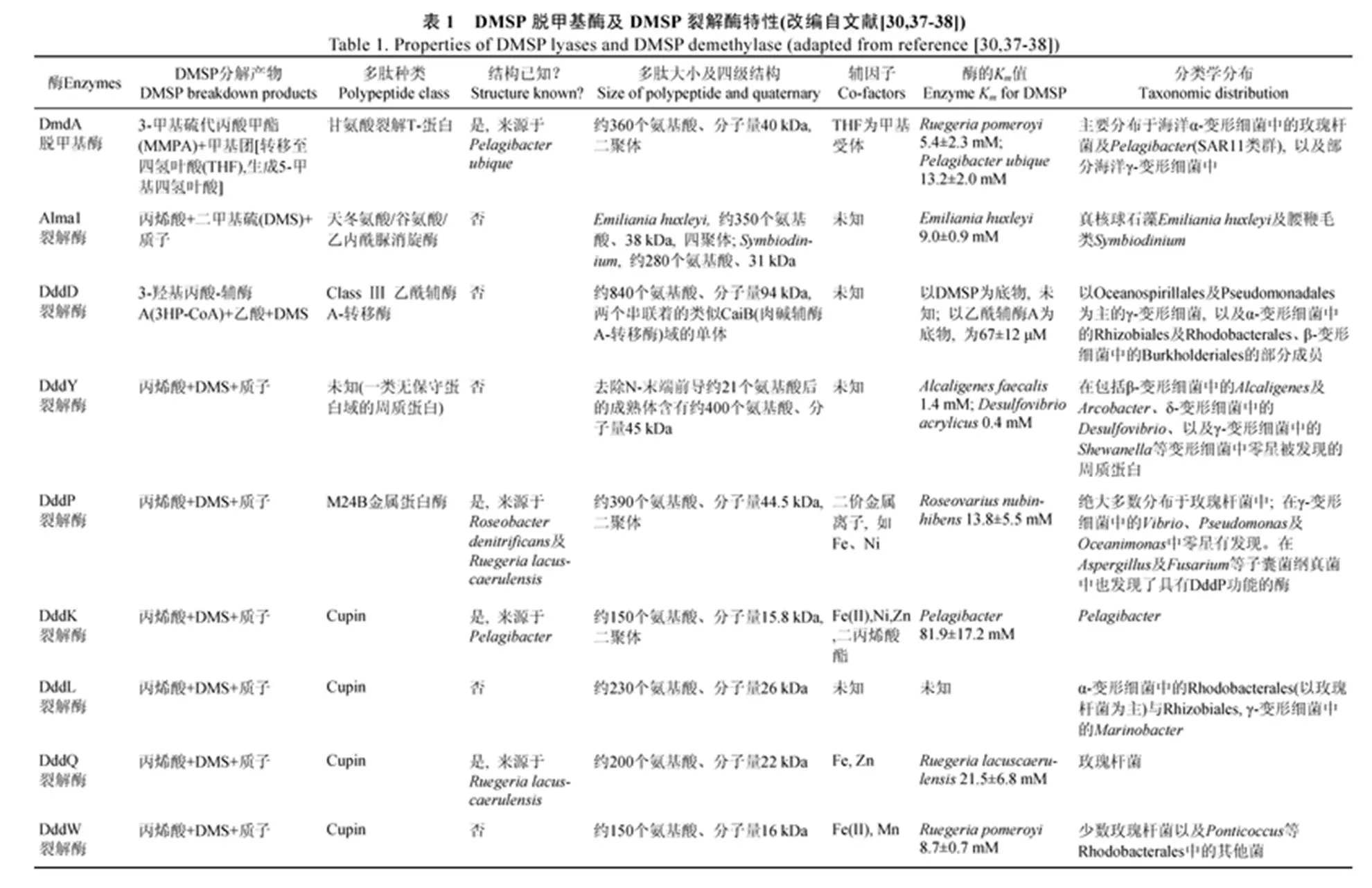
目前在微生物中發現的多條DMSP分解代謝途徑(圖2), 其代謝機制各不相同, 分子機制尚未完全闡明, 研究對象也主要來自溫帶海洋。與溫帶海洋微生物相比, 寒帶(即極地)海洋微生物胞內不僅含有更多的DMSP, DMSP所發揮的生理作用也有所不同[2], 因此極地海洋微生物中的DMSP分解代謝機制可能與溫帶海洋微生物存在差異。到目前為止, 在參與DMSP分解代謝途徑的關鍵酶中, 除了Alma是由真核的球石藻及共生藻產生之外, 其余8種酶, 包括1種DmdA(DMSP脫甲基酶)、7種Ddd+(DMSP依賴型產DMS裂解酶), 均是由細菌產生的(表1)[29,37-38]。
DMSP脫甲基途徑主要由DmdA、DmdB、DmdC、以及DmdD/AcuH等酶催化完成[6,39], 其中參與第一步反應的關鍵酶基因包含了A—E五個支系, 其產生菌分布在α-變形細菌中的玫瑰桿菌、紅螺菌目、SAR11(如)、SAR116(如Puniceispirillum marinum), 以及γ-變形細菌中的OM60等類群中[29,34], 并且以玫瑰桿菌(部分細菌同時具有脫甲基與裂解能力)、SAR11(缺乏DMSP裂解能力)為主。該基因編碼的DmdA屬于甘氨酸裂解T-蛋白家族。在墨西哥灣, 有2個玫瑰桿菌類的基因簇與1個SAR11類的基因簇在水華發生前后有顯著變化, 并且優勢支系與葉綠素a濃度密切相關, 這說明藻類的繁殖影響水體中含基因的細菌的豐度[34]。據估計, 表層海水中有58%(±9%)的細胞含有基因[40]。在開闊大洋區, 含基因的細菌通常以SAR11為主, 而在沿海水域則以玫瑰桿菌為主[41]。DMSP脫甲基途徑中的其他酶, 包括DmdB(MMPA輔酶A連接酶)、DmdC(MMPA輔酶A脫氫酶)及DmdD(甲硫基丙烯酰輔酶A水合酶), 其產生者不但分布于變形細菌門中的α、β、γ及δ等亞綱, 還包括放線菌門、厚壁菌門中的細菌以及部分古菌, 甚至還有真核的真菌、酵母及球石藻[2], 而AcuH(丙烯酰輔酶A還原酶)則廣泛分布于各類生物的細胞中。
在DMSP降解途徑中, 研究人員已發現7種Ddd酶, 分別由、、、、、及等基因編碼[29,37]。某些細菌, 如DSS-3、HTCC 1062, 可含有多個Ddd酶。DddD與其他6種將DMSP直接裂解生成DMS與丙烯酸的裂解酶不同, 它具有乙酰輔酶A轉移酶功能, 能將DMSP降解生成DMS和3-羥基丙酸(3HP)(圖2)。基因存在于變形細菌門的各亞綱中, 包括α (如、、、、、等屬)、β (如)及γ(如、等屬)等亞綱, 表明該基因在親緣關系較遠的不同細菌之間存在水平基因轉移(HGT)現象[4]。與其他6種位于細胞質中的Ddd酶不同, DddY位于細菌的壁膜間隙中, 它是最先被鑒別出來的DMSP裂解酶, 其多肽分類學地位尚不明確[42]。含有基因的細菌, 包括變形細菌門中的β (如)、γ (如、)、δ(如)以及ε (如)等亞綱。基因同樣很可能通過水平基因轉移在親緣關系較遠的細菌之間擴散。DddP無論是序列還是結構都與金屬多肽酶M24家族最相似, 但M24多肽酶水解的是C—N鍵, 而DddP斷裂的是C—S鍵[43-44]。DddP單體有兩個結構域, 結構域之間的夾角約90°。每個DddP二體含有兩個催化中心, 每個催化中心螯合兩個Fe3+、并有10個保守氨基酸。其中377位的天冬氨酸位于DMSP的β-C附近, 很可能是催化過程中的親核攻擊堿。突變377位的天冬氨酸會導致DddP酶活的喪失。兩個Fe3+輔基中的一個在催化過程中存在"ion-shift"現象, Fe3+的移動有助于DMSP的結合并且增加了DMSP的α-H的酸性, 是DddP實現催化功能的關鍵一步; DddP在M24金屬蛋白酶家族中形成了一個獨立的分支, 而且擁有一個不同于其他M24金屬蛋白酶的全新的N端結構域, 使得DddP形成了一個緊密的二體結構, 從而使得DddP的底物入口僅能允許DMSP進入而不允許短肽進入。研究發現, 催化中心關鍵氨基酸的突變導致了DddP蛋白酶催化能力的喪失和DMSP裂解酶催化能力的形成, 從而使DddP從金屬蛋白酶進化為DMSP裂解酶[43]。編碼基因主要分布在α-變形細菌綱的玫瑰桿菌支系及SAR116支系中[29,45], 并可通過水平基因轉移作用擴散到γ-變形細菌(如、等屬)、甚至是真核的子囊菌中[46]。在沿岸海域, 含基因的浮游細菌以玫瑰桿菌支系為主, 而在寡營養的大洋區則以SAR116類群占優勢[45]。DddK、DddL、DddQ及DddW皆屬于cupin超家族蛋白(表1)。含有基因的細菌主要來自α-變形細菌中的紅桿菌目與根瘤菌目, 另外還有γ-變形細菌中的屬;和目前僅在玫瑰桿菌支系及SAR11中被檢測到[30,37]。DddQ為β桶狀折疊結構, 在活性位點有1個Zn2+及6個高度保守的親水殘基Tyr120、His123、His125、Glu129、Tyr131及His163, 這些親水殘基在催化中發揮著關鍵作用, 尤其是Tyr131, 可以通過構象變化而成為啟動DMSP分解中β-消除反應的基石; 此外, 在DddQ的底物結合口袋上方有2個環可以在打開與關閉狀態間切換, 從而形成DMSP進入的通道[46];則是在(屬于SAR11類群)中被首次報道[37]。在這7種DMSP裂解酶基因中,與在全球海洋采集(GOS)數據庫中是數量最豐富的細菌性DMSP裂解酶基因[48], 基于海洋細菌基因組的調查也顯示的分布最為廣泛[2]。
4 極地低溫海域的相關研究進展
地處高緯度的南、北極海域具有的低溫、海冰覆蓋、極晝與極夜交替、夏季強輻射等自然環境特征, 其中的生態系統具有有別于中、低緯度海域的自身特點。但也正因為其環境特殊、地理偏遠, 因而對采樣、現場作業等科學考察的后勤支撐條件要求高, 從而導致人們對極地低溫海域的認識相對嚴重不足, 這包括了對于極地海域上層海洋生態系統中以DMSP為對象的硫元素的生物地球化學循環過程及調控機制的認識。
研究表明, 在DMSP降解過程中溫度及DMSP的濃度均會顯著影響含硫物質的區分, 低溫及高底物濃度會導致顆粒性DMSP向溶解性DMSP轉變[49]。海水中溶解性DMSP的濃度通常在1—25 nM, 而在水華期間濃度會更高, 尤其是在季節性低溫或極地海水中[50-51]。隨著浮游植物生物量的增加, 微生物群落吸收溶解性DMSP并將其轉化成DMS的能力也相應增強, 這表明DMS的產生最終是由有機物的可獲得性來決定的[22]。在北極加拿大群島的海水中, 細菌對DMSP的利用與其豐度成比例[52]。從亞熱帶到溫帶, 再到北極海域, DMS的產生都只占海水中DMSP降解的一小部分, 大部分DMSP的降解是通過脫甲基途徑來進行[49]。而海水中溶解性DMSP的濃度、水溫又可以影響到細菌對DMSP的分解是以哪條代謝途徑為主[49,53]: 提高DMSP濃度或降低水溫, 在當水體中的細菌對硫的需求得到滿足后, 細菌對DMSP的降解會從脫甲基途徑向裂解途徑轉換, 從而產生更多的DMS。對法國波爾多西南海岸潮間帶沉積生態系統的研究結果顯示, 當環境中的DMSP濃度低于26 μM時, 脫甲基是微生物主要的DMSP代謝途徑; 但當DMSP濃度超過這一數值時, 裂解成為了主要的代謝途徑[54]。表層海水中DMSP的濃度變化很大, 其范圍從不足1 nM(開闊大洋)到μM級別(浮游植物水華期間)[55], 而在極地海域溶解性DMSP的濃度通常很低(<2 nM), 即使當時顆粒性DMSP的濃度高達50 nM[56-57], 這應該歸因于DMSP的高易變性以及細菌對它的快速轉換[22]。經推測, 在極地低溫海域中由于海水中DMSP的濃度低, 因此其分解代謝途徑可能仍是以脫甲基途徑為主。本研究小組在北極王灣基于基因克隆文庫手段的研究顯示, 從灣口K1到灣底K5的3個站位的表層海水中均檢測到脫甲基途徑的基因及裂解途徑的基因, 但各站位含基因的克隆子數量極少、均為個位數, 而裂解途徑的另一個基因未在灣底站位K5被檢測出[58]。在不考慮引物的情況下, 認為各站位含酶基因的克隆子數量很可能反映了環境中目的DNA濃度的高低, 而目的DNA濃度的高低又與細胞的豐度存在密切聯系。
雖然許多研究認為大多數DMS的產生來源于細菌對DMSP的分解[33,59], 但在加拿大北極海域的研究卻顯示非細菌性過程在DMS的產生中占據支配地位, 而且該海域DMS產量的大小受限于當地低的藻類及細菌產量[22]。此外, 該海域中細菌利用的溶解性DMSP中, 僅有不到10%最終轉換成了DMS。而另一項在加拿大北巴芬灣/蘭開斯特海峽的研究又表明, 細菌代謝的DMSP中有12%—31%轉換成了DMS[52]。與更溫暖且具有更高生產力的環境相比, 低溫環境中異養細菌的生產力以及它們對DMSP的轉換速率常數更低[52]。部分研究認為, 在北極水體中DMSP主要是作為碳源被細菌利用, 因而導致釋放DMS的轉換效率高達30%[52]。基于這些已有的研究報道, 筆者認為由于不同的極地海域具有自身獨特的水文、營養、捕食等生態環境特征, 細菌性過程在控制當地DMS的產生中可能具有不同的生態學地位與影響。
與此同時, 在格陵蘭海及北冰洋的研究顯示, 海洋中細菌性DMS的產生與消耗, 通常是處于一個接近平衡的狀態, 從而將自然界中的DMS水平保持在一個相當窄的波動范圍內[60]。細菌不但能降解DMSP生成DMS, 它自身也能夠消耗海水中的DMS, 并且其消耗能力隨著DMS生成的增加而升高[15]。
有研究表明, 北極海水中不但有40%—65%的細菌細胞能吸收溶解性DMSP、并以γ-變形細菌及非玫瑰桿菌的α-變形細菌為主, 而且不同北極水團中含有其獨特的微生物群落, 從而對DMSP表現出明顯差異的親和力[52]。而本課題組在北極王灣的研究結果顯示, 無論是涉及脫甲基途徑的基因還是涉及裂解途徑的與基因, 其產生菌都與玫瑰桿菌支系密切相關[58]。此外, 本課題組在南極長城站近岸海域的研究表明, 水體中的基因均來自玫瑰桿菌支系, 但與北極王灣不同,基因分別來自以為代表的α-變形細菌、以及以為代表的γ-變形細菌[61]。這些結果表明了極地海域參與DMSP分解代謝的浮游細菌多樣性組成的復雜性。
與此同時, 本課題組基于分離培養方法獲得的DMSP降解細菌的多樣性組成與采用非培養方法獲得的結果存在差異。例如, 采用含DMSP底物的寡營養平板從王灣海水中分離到的細菌, 全部屬于γ-變形細菌。進一步對其中分布在不同屬的3株細菌sp. BSw22112、sp. BSw22131、sp. BSw 22132, 以及一株南極海洋細菌ZS2-28(屬于玫瑰桿菌支系)的分子生物學檢測發現, 這4株菌均含有基因片段, 并且與來自美國佐治亞海岸的模式菌DSS-3(屬于玫瑰桿菌支系)的基因序列相似性達97%—98%。這一發現暗示, 脫甲基酶基因也可以通過水平基因轉移作用在親緣關系較遠的海洋細菌中傳播, 從而有助于更多樣的浮游細菌參與到DMSP的脫甲基作用中。有關基因在全球海洋細菌中的生物地理分布、進化、以及表達調控等, 值得開展進一步的研究工作。此外, 課題組還在3株假單胞菌()DNA中檢測到基因片段, 其序列與南極菌株ZS2-28的基因具有高度同源性, 這與國外有關基因可通過水平基因轉移作用在不同細菌之間擴散的報道是相吻合的。而這種水平基因轉移作用的存在, 會給基于非培養方法研究環境中含DMSP降解基因的細菌的多樣性帶來一定程度的干擾與誤判。在這3株細菌中沒有檢測到基因的存在。
5 結語
浮游細菌不僅是海洋上層生態系統的重要組成成分, 同時在海洋硫元素的生物地球化學循環中扮演重要角色, 并且與影響氣候變化的氣體的代謝存在密切聯系。目前有關細菌介導的DMSP/ DMS代謝的研究成果大多是基于地處中低緯度的溫帶或亞熱帶海域的工作所取得的, 在極地低溫海域的研究工作報道極少。溫度、鹽度、營養情況等, 是影響微生物生存、繁殖及分布的重要環境因子。極地海洋因其獨特的地理位置, 造就了與溫、熱帶海洋不同的氣候與環境特點, 在南、北極低溫海洋中進化的細菌群落, 可能是不同于溫、熱帶海洋的; 而地理、水文及環境條件的差異, 不但可導致微生物群落結構及多樣性出現差異, 還可導致微生物的功能基因多樣性、生理代謝類型多樣性等出現差異。
到目前為止, 有關極地低溫海域中細菌對海水中DMSP的分解代謝是否仍是以脫甲基途徑為主、細菌性過程在控制DMS產生中的重要性究竟如何、全球氣候變化帶來的海洋酸化及海冰消融對極區DMSP/DMS代謝及硫元素循環的影響等, 人們仍知之甚少, 尚需大量研究工作的開展才能得到清晰的認識。隨著近年來國內科研機構及大學對DMSP代謝及硫元素生物地球化學循環的關注, 尤其是2017年國家自然科學基金委“水圈微生物驅動地球元素循環的機制”重大研究計劃的推出, 勢必會吸引更多的科研人員參與進來, 其研究區域也將會從中低緯度海域延伸到高緯度的極地海域, 相關研究工作的開展無疑會極大推動人們對于極地低溫海域中細菌驅動硫元素生物地球化學循環機制的認識, 對于進一步認識浮游細菌在極地海洋生態系統中的生態學地位、評估極地海洋微生物群落對全球氣候環境變化的響應與反饋具有重要的科學意義。
1 STEFELS J. Physiological aspects of the production and conversion of DMSP in marine algae and higher plants[J]. Journal of Sea Research, 2000, 43(3): 183—197. DOI:10.1016/s1385-1101(00)00030-7.
2 BULLOCK H A, LUO H, WHITMAN W B. Evolution of Dimethylsulfoniopropionate metabolism in marine phytoplankton and bacteria[J]. Frontiers in Microbiology, 2017, 8. DOI:10.3389/fmicb.2017.00637.
3 李立, 汪鵬, 彭夢珺, 等. 海洋二甲基硫產生菌及其功能基因研究進展[J]. 華中農業大學學報, 2013, 32(5): 20—28.
4 JOHNSTON A W, TODD J D, SUN L, et al. Molecular diversity of bacterial production of the climate-changing gas, dimethyl sulphide, a molecule that impinges on local and global symbioses[J]. J Exp Bot, 2008, 59(5): 1059—1067. DOI:10.1093/jxb/erm264.
5 Simó R, Pedrós-Alió C, Malin G, et al. Biological turnover of DMS, DMSP and DMSO in contrasting open-sea waters. Marine Ecology Progress Series, 2000, 203(1438): 1—11.
6 REISCH C R, STOUDEMAYER M J, VARALJAY V A, et al. Novel pathway for assimilation of dimethylsulphoniopropionate widespread in marine bacteria[J]. Nature, 2011, 473(7346):208—211. DOI:10.1038/nature10078.
7 LOVELOCK J E, MAGGS R J, RASMUSSEN R A. Atmospheric dimethyl sulphide and the natural sulphur cycle[J]. Nature, 1972, 237(5356): 452—453. DOI:10.1038/237452a0.
8 Andreae M O, Ferek R J, Bermond F, et al. Dimethylsulfide in the marine atmosphere. Journal of Geophysical Research: Atmospheres, 1985, 90: 12891–12900.
9 杜曉明, 劉厚田, 柳若安, 等. 廈門近海海域海水二甲基硫排放通量的研究[J]. 環境科學研究, 1998, 11(2): 36—38.
10 楊桂朋, 景偉文, 陸小蘭. 海洋中DMSP的研究進展[J]. 中國海洋大學學報(自然科學版), 2004, 34(5): 854—860.
11 MALIN G, KIRST G O. Algal production of dimethyl sulfide and its atmospheric role[J]. Journal of Phycology, 1997, 33(6): 889—896. DOI:10.1111/j.0022-3646.1997.00889.x.
12 CHIN M, JACOB D J. Anthropogenic and natural contributions to tropospheric sulfate: A global model analysis[J]. Journal of Geophysical Research: Atmospheres, 1996, 101(13):18691—18699. DOI:10.1029/96jd01222.
13 TODD J D, ROGERS R, LI Y G, et al. Structural and regulatory genes required to make the gas dimethyl sulfide in bacteria[J]. Science, 2007, 315(5812): 666—669. DOI:10.1126/science.1135370.
14 VALLINA S M, SIMó R. Strong relationship between DMS and the solar radiation dose over the global surface ocean[J]. Science, 2007, 315(5811): 506—508. DOI:10.1126/science.1133680.
15 LEVASSEUR M. Impact of Arctic meltdown on the microbial cycling of sulphur[J]. Nature Geoscience, 2013, 6(9): 691—700. DOI:10.1038/ngeo1910.
16 CURRAN M A J, JONES G B. Dimethyl sulfide in the Southern Ocean: seasonality and flux[J]. Journal of Geophysical Research: Atmospheres, 2000, 105(16): 20451—20459. DOI:10.1029/2000jd900176.
17 張麋鳴, 陳立奇, 汪建君. 南大洋二甲基硫海-氣交換過程研究進展[J]. 地球科學進展, 2013, 28(9): 1015—1024.
18 GIBSON J A E, GARRICK R C, BURTON H R, et al. Dimethylsulfide and the algain Antarctic coastal waters[J]. Marine Biology, 1990, 104(2): 339—346.DOI:10.1007/bf01313276.
19 Keller M D. Dimethyl sulfide production and marine phytoplankton:the importance of species composition and cell size[J]. Biological Oceanography, 1989, 6(5—6):375—382.
20 RAINA J B, TAPIOLAS D M, FORêT S, et al. DMSP biosynthesis by an animal and its role in coral thermal stress response[J]. Nature, 2013, 502(7473): 677—680. DOI:10.1038/nature12677.
21 VOGT M, LISS P S. Dimethylsulfide and climate[J]. Surface Ocean-Lower Atmosphere Processes, 2009: 197—232. DOI:10.1029/2008gm000790.
22 LUCE M, LEVASSEUR M, SCARRATT M G, et al. Distribution and microbial metabolism of dimethylsulfoniopropionate and dimethylsulfide during the 2007 Arctic ice minimum[J].Journal of Geophysical Research, 2011, 116. DOI:10.1029/2010jc006914.
23 厲丞烜, 王保棟, 楊桂朋. 挪威海和格陵蘭海海水DMS分布特征及影響因素研究[J]. 海洋學報, 2015(8): 9—25.
24 CURSON A R J, LIU J, BERMEJO MARTíNEZ A, et al. Dimethylsulfoniopropionate biosynthesis in marine bacteria and identification of the key gene in this process[J]. Nat Microbiol, 2017, 2: 17009. DOI:10.1038/nmicrobiol.2017.9.
25 YOCH D C. Dimethylsulfoniopropionate: its sources, role in the marine food web, and biological degradation to dimethylsulfide[J]. Appl Environ Microbiol, 2002, 68(12): 5804—5815.DOI:10.1128/aem.68.12.5804-5815.2002.
26 ALCOLOMBRI U, BEN-DOR S, FELDMESSER E, et al. Marine sulfur cycle. Identification of the algal dimethyl sulfide-releasing enzyme: a missing link in the marine sulfur cycle[J]. Science, 2015, 348(6242): 1466—1469. DOI:10.1126/science.aab1586.
27 YOST D M, MITCHELMORE C L. Dimethylsulfoniopropionate (DMSP) lyase activity in different strains of the symbiotic alga[J]. Marine Ecology Progress, 2009, 386(7):61—70.
28 KIRCHMAN D. The ecology ofin aquatic environments[J]. FEMS Microbiology Ecology, 2002, 39(2): 91—100. DOI:10.1016/s0168-6496(01)00206-9.
29 BUCHAN A, GONZáLEZ J M, MORAN M A. Overview of the marine rlineage[J]. Appl Environ Microbiol, 2005, 71(10): 5665—5677. DOI:10.1128/AEM.71.10.5665-5677.2005.
30 JOHNSTON A W, GREEN R T, TODD J D. Enzymatic breakage of dimethylsulfoniopropionate-a signature molecule for life at sea[J]. Curr Opin Chem Biol, 2016, 31: 58—65. DOI:10.1016/j.cbpa.2016.01.011.
31 KIENE R P, LINN L J, GONZáLEZ J, et al. Dimethylsulfoniopropionate and methanethiol are important precursors of methionine and protein-sulfur in marine bacterioplankton[J]. Appl Environ Microbiol, 1999, 65(10): 4549—4558.
32 Simó R, Archer SD, Pedrós-Alió C, et al. Coupled dynamics of dimethylsulfoniopropionate and dimethylsulfide cycling and the microbial food web in surface waters of the North Atlantic. Limnology and Oceanography, 2002, 47(1): 53—61.
33 KIENE R P, LINN L J, BRUTON J A. New and important roles for DMSP in marine microbial communities[J]. Journal of Sea Research, 2000, 43(3): 209—224. DOI:10.1016/s1385-1101(00)00023-x.
34 HOWARD E C, SUN S, REISCH C R, et al. Changes in dimethylsulfoniopropionate demethylase gene assemblages in response to an induced phytoplankton bloom[J]. Appl Environ Microbiol, 2011, 77(2): 524—531. DOI:10.1128/AEM.01457-10.
35 STEFELS J, VAN BOEKEL W. Production of DMS from dissolved DMSP in axenic cultures of the marine phytoplankton speciessp. [J]. Marine Ecology Progress Series, 1993, 97: 11—18. DOI:10.3354/meps097011.
36 楊桂朋, 厲丞烜. 海洋生物對二甲基硫生產的控制作用研究[J]. 中國海洋大學學報(自然科學版), 2009, 39(3): 453—460, 542.
37 SUN J, TODD J D, THRASH J C, et al. The abundant marine bacteriumsimultaneously catabolizes dimethylsulfoniopropionate to the gases dimethyl sulfide and methanethiol[J]. Nat Microbiol, 2016, 1(8): 16065. DOI:10.1038/nmicrobiol.2016.65.
38 SCHNICKER N J, DE SILVA S M, TODD J D, et al. Structural and biochemical insights into dimethylsulfoniopropionate cleavage by Cofactor-Bound DddK from the prolific marine bacterium[J]. Biochemistry, 2017, 56(23): 2873—2885. DOI:10.1021/acs.biochem.7b00099.
39 REISCH C R, CRABB W M, GIFFORD S M, et al. Metabolism of dimethylsulphoniopropionate byDSS-3[J]. Mol Microbiol, 2013, 89(4): 774—791.DOI:10.1111/mmi.12314.
40 HOWARD E C, SUN S, BIERS E J, et al. Abundant and diverse bacteria involved in DMSP degradation in marine surface waters[J]. Environ Microbiol, 2008, 10(9): 2397—2410. DOI:10.1111/j.1462-2920.2008.01665.x.
41 HOWARD E C, HENRIKSEN J R, BUCHAN A, et al. Bacterial taxa that limit sulfur flux from the ocean[J]. Science, 2006, 314(5799): 649—652. DOI:10.1126/science.1130657.
42 DE SOUZA M P, YOCH D C. Comparative physiology of dimethyl sulfide production by dimethylsulfoniopropionate lyase inandsp. StrainM3A[J]. Appl Environ Microbiol, 1995, 61(11): 3986—3991.
43 TODD J D, CURSON A R J, DUPONT C L, et al. Thegene, encoding a novel enzyme that converts dimethylsulfoniopropionate into dimethyl sulfide, is widespread in ocean metagenomes and marine bacteria and also occurs in some Ascomycete fungi[J]. Environmental Microbiology, 2009, 11(6): 1376—1385. DOI:10.1111/j.1462-2920.2009.01864.x.
44 WANG P, CHEN X L, LI CY, et al. Structural and molecular basis for the novel catalytic mechanism and evolution of DddP, an abundant peptidase-like bacterial dimethylsulfoniopropionate lyase: a new enzyme from an old fold[J]. Mol Microbiol, 2015, 98(2): 289—301. DOI:10.1111/mmi.13119.
45 CHOI D H, PARK K T, AN S M, et al. Pyrosequencing revealed SAR116 clade as dominant-containing bacteria in oligotrophic NW Pacific Ocean[J]. PLoS ONE, 2015, 10(1):e0116271. DOI:10.1371/journal.pone.0116271.
46 TODD J D, CURSON A R, SULLIVAN M J, et al. Thegene has a role in DMSP catabolism and resemblesofand other bacteria in conferring resistance to acrylate[J]. PLoS ONE, 2012, 7(4): e35947. DOI:10.1371/journal. pone.0035947.
47 LI C Y, WEI T D, ZHANG S H, et al. Molecular insight into bacterial cleavage of oceanic dimethylsulfoniopropionate into dimethyl sulfide[J]. Proc Natl Acad Sci USA, 2014, 111(3):1026—1031. DOI:10.1073/pnas.1312354111.
48 TODD J D, CURSON A R, KIRKWOOD M, et al. DddQ, a novel, cupin-containing, dimethylsulfoniopropionate lyase in marine roseobacters and in uncultured marine bacteria[J]. Environ Microbiol, 2011, 13(2): 427—438. DOI:10.1111/j.1462-2920.2010.02348.x.
49 KIENE R P, LINN L J. The fate of dissolved dimethylsulfoniopropionate (DMSP) in seawater: tracer studies using35S-DMSP[J]. Geochimica et Cosmochimica Acta, 2000, 64(16):2797—2810. DOI:10.1016/s0016-7037(00)00399-9.
50 KETTLE A J, ANDREAE M O, AMOUROUX D, et al. A global database of sea surface dimethylsulfide (DMS) measurements and a procedure to predict sea surface DMS as a function of latitude, longitude, and month[J]. Global Biogeochemical Cycles, 1999, 13(2): 399—444. DOI:10.1029/1999gb900004.
51 TURNER S M, MALIN G, LISS P S, et al. The seasonal variation of dimethyl sulfide and dimethylsulfoniopropionate concentrations in nearshore waters[J]. Limnology and Oceanography, 1988, 33(3): 364—375. DOI:10.4319/lo.1988.33.3.0364.
52 MOTARD-C?Té J, LEVASSEUR M, SCARRATT M G, et al. Distribution and metabolism of dimethylsulfoniopropionate (DMSP) and phylogenetic affiliation of DMSP-assimilating bacteria in northern Baffin Bay/Lancaster Sound[J]. Journal of Geophysical Research: Oceans, 2012, 117(9): n/a-n/a. DOI:10.1029/2011jc007330.
53 PINHASSI J, SIMO R, GONZALEZ J M, et al. Dimethylsulfoniopropionate turnover is linked to the composition and dynamics of the bacterioplankton assemblage during a microcosm phytoplankton bloom[J]. Applied and Environmental Microbiology, 2005, 71(12): 7650—7660. DOI:10.1128/aem.71.12.7650-7660.2005.
54 JONKERS H M, VAN BERGEIJK S A , VAN GEMERDEN H . Microbial production and consumption of dimethyl sulfide (DMS) in a sea grass (Zostera noltii)-dominated marine intertidal sediment ecosystem (Bassin d'Arcachon, France)[J]. FEMS Microbiol Ecol, 2000, 31(2): 163—172. DOI:10.1016/s0168-6496(99)00097-5.
55 VAN DUYL F C, GIESKES W W C, KOP A J, et al. Biological control of short-term variations in the concentration of DMSP and DMS during aspring bloom[J]. Journal of Sea Research, 1998, 40(3): 221—231. DOI:10.1016/s1385-1101(98)00024-0.
56 KIENE R P, KIEBER D J, SLEZAK D, et al. Distribution and cycling of dimethyl sulfide, dimethylsulfoniopropionate, and dimethyl sulfoxide during spring and early summer in the Southern Ocean south of New Zealand[J]. Aquatic Sciences, 2007, 69(3): 305—319. DOI:10.1007/s00027-007-0892-3.
57 DAMM E, KIENE R P, SCHWARZ J, et al. Methane cycling in Arctic shelf water and its relationship with phytoplankton biomass and DMSP[J]. Marine Chemistry, 2008, 109(1): 45—59. DOI:10.1016/j.marchem.2007.12.003.
58 ZENG Y X, QIAO Z Y, YU Y, et al. Diversity of bacterial dimethylsulfoniopropionate degradation genes in surface seawater of Arctic Kongsfjorden[J]. Sci Rep, 2016, 6: 33031. DOI:10.1038/srep33031.
59 ZUBKOV M V, FUCHS B M, ARCHER S D, et al. Rapid turnover of dissolved DMS and DMSP by defined bacterioplankton communities in the stratified euphotic zone of the North Sea[J]. Deep Sea Research Part II: Topical Studies in Oceanography, 2002, 49(15): 3017—3038. DOI:10.1016/s0967-0645(02)00069-3.
60 GALí M, SIMó R. Occurrence and cycling of dimethylated sulfur compounds in the Arctic during summer receding of the ice edge[J]. Marine Chemistry, 2010, 122(1): 105—117. DOI:10.1016/j.marchem.2010.07.003.
61 喬宗赟. 南極近岸海域浮游細菌重要生態功能基因的多樣性分析[D].集美大學, 2014.
BACTERIAL CATABOLISM OF DIMETHYLSULFONIOPROPIONATE (DMSP) IN POLAR MARINE AREAS
Zeng Yinxin
(SOA Key Laboratory for Polar Science, Polar Research Institute of China, Shanghai 200136, China)
Dimethylsulfoniopropionate (DMSP) is one of the most abundant organosulfur compounds on Earth, and a key nutrient for marine microorganisms. The main producers of DMSP are phytoplankton. DMSP is also the major precursor for gaseous dimethyl sulfide (DMS), which is important in global sulfur cycling and potentially affects weather and climate. Bacteria play an important role in the processes of DMSP degradation and DMS production. The pathways of DMSP synthesis and metabolism and the ecological impacts of DMSP have been studied for nearly 70 years. However, most of those studies have been performed at low- and mid-latitudes, and few experiments have been conducted in cold waters at high latitudes. In this review, I briefly introduce DMSP synthesis and catabolism, and then summarize recent advances in research on genes involved in DMSP degradation and the organisms that harbor those genes in polar marine areas. Studies on the bacterial metabolism of DMSP/DMS in polar marine areas will greatly improve our understanding of the role of microorganisms in the polar marine ecosystem, and the responses and feedback of marine microbial communities in the polar region to global climate change.
Dimethylsulfoniopropionate (DMSP), degradation, marine bacteria, polar region
2017年9月收到來稿, 2017年12月收到修改稿
國家自然科學基金項目(41476171)資助
曾胤新, 男, 1971年生。博士, 研究員, 研究方向為極地及海洋微生物學。E-mail: yxzeng@sina.com
10. 13679/j. jdyj. 20170037

