成人非酒精性脂肪肝患者早期腎損傷狀況及影響因素分析*
任習芳,張 祎
(三峽大學人民醫院消化內科,武漢443000)
隨著人們生活方式改變,非酒精性脂肪性肝病(NAFLD)發病率逐漸升高,并與高血壓病、2型糖尿病、冠心病等密切相關。近年來,國外研究者發現 NAFLD 可增加患慢性腎病(CKD)的發病風險,CKD具有高發病率和高病死率特點,潛在危險因素包括高齡、肥胖、高血壓、糖尿病,及時發現并且治療早期腎損傷至關重要,CKD 被預防或被延遲將成為可能[1-2]。本研究分析NAFLD患者早期腎臟損傷狀況及其影響因素,旨在提高腎損傷的診斷率,為臨床上更好地管理NAFLD患者,早期防治CKD的發生、發展提供理論依據。
1 資料與方法
1.1一般資料 選取2016年1月至2017年6月本院門診及住院NAFLD、NAFLD合并代謝綜合征(NAFLD+MS)患者125例。其中NAFLD患者78例,男55例、女23例,平均年齡50.8歲;NAFLD+MS患者47例,男28例、女19例,平均年齡51.6歲;同期體檢的單純性肥胖者78例為對照組,男62例、女16例,平均年齡51.2歲。各組一般資料比較,差異無統計學意義(P>0.05),具有可比性。
1.2診斷標準
1.2.1NAFLD診斷標準 NAFLD患者均符合2010年中華醫學會肝臟病學分會脂肪肝和酒精性肝病學組修訂的《非酒精性脂肪性肝病診斷標準》,排除病毒性肝炎、酒精性肝病、自身免疫性肝病及其他可致脂肪肝的特殊病例,排除合并其他嚴重疾病患者,以及影像學診斷具備以下3項腹部超聲表現中的兩項者為彌漫性脂肪肝患者:(1)肝臟近場回聲彌漫性增強(“明亮肝”),回聲強于腎臟;(2)肝內管道結構顯示不清;(3)肝臟遠場回聲逐漸衰減、所有患者均為初次來本院就診,未接受過任何治療措施。
1.2.2公式定義 根據身高及體質量計算體質量指數(BMI);采用腎臟病飲食改良 (MDRD)公式計算腎小球濾過率(eGFR)=186×血清肌酐Scr-1.154×年齡-0.203×(0.742女性)。腎損害被定義為eGFR<90 mL·min-1·1.73 m-2。超重或肥胖診斷依據2005年國際糖尿病聯盟標準,即腰圍>90 cm(男性),>80 cm(女性)和(或)BMI>25 kg/m2。采用穩態模型評估計算法計算胰島素抵抗指數(HOMA-IR),HMOA-IR=空腹血糖(FBG)×空腹胰島素(FINS)/22.5。
1.3方法
1.3.1標本采集 (1)收集一般資料:包括年齡、性別、現病史、既往史、家族史、飲酒史。(2)測量身高、體質量和計算BMI(BMI=kg/m2)。(3)測量腰圍:以cm為單位記錄,結果精確到1 mm。
1.3.2觀察指標 采用日立7600全自動生化分析儀及其配套試劑檢測血生化指標。全部研究對象行生化指標、代謝指標的檢測,采血前應禁食8~10 h,次晨于本院體檢中心采集血清檢測,(1)肝臟生化指標:天冬氨酸氨基轉移酶(AST)、丙氨酸氨基轉移酶(ALT)、γ-谷氨酰轉肽酶(γ-GGT)。(2)代謝指標:膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、FBG及尿酸(UA)。(3)腎臟生化及早期腎損指標:尿酸(UA)、血清肌酐(Scr)、尿微量清蛋白/肌酐(ACR)、β2-微球蛋白(β2-MG)、FINS。

2 結 果
2.1各組肝臟生化、腎臟生化、早期腎損傷指標比較結果 NAFLD組、NAFLD+MS組與對照組肝臟生化和代謝指標比較,ALT、AST、TC、TG、HDL、LDL、FBG、FINS、HOMA-IR均升高,差異有統計學意義(P<0.05),其余指標差異無統計學意義(P>0.05)。腎臟生化和早期腎臟損傷指標比較,NAFLD組和NAFLD+MS組FINS、HOMA-IR、Scr、ACR、β2-MG 均升高,eGFR 則降低,NAFLD+MS組與NAFLD組FINS、HOMA-IR比較,差異有統計學意義(P<0.05),見表1。
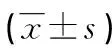
表1 各組肝臟生化、腎臟生化、早期腎損傷指標比較
注:與對照組比較,*P<0.05;與NAFLD組比較,#P<0.05
2.2NAFLD組中ACR與各指標相關分析結果 ACR是預測CKD較靈敏,準確率較高的檢測指標,且從上述分析結果得出在對照組、NAFLD組及NAFLD+MS之間,ACR差異有統計學意義(P<0.05),故將ACR與NAFLD和MS各項相關指標(BMI、腰圍、TC、TG、HDL、HOMA-IR、FBG、AST、ALT及γ-GGT)進行Spearman相關分析。ACR與BMI、腰圍、FBG、FINS、TG、LDL、HOMA-IR呈正相關(P<0.05),與HDL呈負相關(P<0.05),HOMA-IR對ACR的影響最大。見表2。

表2 ACR同NAFLD各項指標的Spearman相關分析
3 討 論
隨著對研究地深入,NAFLD與CKD的相互關系逐漸引起越來越多關注,提出2型糖尿病并發NAFLD患者可增加CKD的發病率,1型糖尿病患者中NAFLD是CKD發生、發展的獨立危險因素[3]。前瞻性研究也顯示NAFLD是CKD高發的危險因素,經過對大量的混雜因素進行校正分析后發現,脂肪肝與CKD發病率增加顯著相關[4]。
目前針對NAFLD與CKD的研究主要基于1型和2型糖尿病患者,且已經合并慢性腎病,以及合并MS、本研究主要針對性別、年齡基線相同,同時排除糖尿病、高血壓病及腎病史等,健康體檢成人脂肪肝發生早期腎損傷的危險因素。本研究中,NAFLD組和NAFLD+MS組在BMI、腰圍、TC、TG、HDL、LDL、FBG差異均無統計學意義(P>0.05);腎臟生化和早期腎臟損傷指標比較,NAFLD+MS組與NAFLD組的Scr、ACR、β2-MG均升高,eGFR則降低;NAFLD+MS組的eGFR明顯低于對照組與NAFLD組(P<0.05)。提示NAFLD與早期腎臟損傷或CKD密切相關,NAFLD合并高血壓、糖尿病、高脂血癥、中心性肥胖患者更早出現腎臟損害,NAFLD可能是早期腎臟損傷或CKD的危險因素。SCHVPPAN等[5]指出MS的特征數量直接與腎臟疾病有關。在國外相關研究證實,肝活檢診斷的NAFLD患者eGFR水平更低或有異常蛋白尿[6]。
eGFR、β2-MG是臨床上反映腎功能的良好指標,但eGFR的計算復雜,且當尿微量清蛋白出現異常時,eGFR還處于正常范圍。目前,研究認為CKD患者晨尿ACR和24 h尿微量清蛋白定量之間有相關性,ACR替代24 h尿微量清蛋白定量來評估腎病患者尿微量清蛋白的排泄情況,預測早期腎臟損傷[7]。在本研究中,對ACR與NAFLD相關指標進行Spearman分析,發現ACR與BMI、腰圍、FBG、FINS、TG、TC、LDL、HOMA-IR呈正相關,NAFLD+MS患者FINS與HOMA-IR明顯高于NAFLD組,其中HOMA-IR對ACR的影響最大,提示伴有胰島素抵抗(IR)的NAFLD+MS患者更易出現早期腎損害或CKD,考慮IR可能是NAFLD患者發生早期腎損傷的危險因素。NAFLD慢性炎性反應可導致IR加重,研究指出IR引起的高胰島素血癥可介導炎性反應及動脈粥樣硬化,通過多種途徑直接導致腎臟損傷[8]。同時胰島素受體分布于所有腎單位細胞上,故IR可直接作用于腎組織,如內皮細胞、足細胞、系膜細胞等,導致蛋白尿、腎間質小管損傷及水鈉代謝紊亂,最終誘導CKD的發生、發展[9]。羅春華等[10]調查宜昌市職業人群非酒精性脂肪肝患者,認為治療NAFLD的首要目標就是要改善IR,干預體質量是重要的病因治療,有效預防并發癥的發生。由此可看出ACR和HOMA-IR是較Scr、eGFR、β2-MG更敏感檢測早期腎臟損傷的指標。
NAFLD是CKD獨立危險因素,NAFLD+MS早期腎損傷患病率明顯增高,ACR和HOMA-IR是早期發現腎損傷最重要的指標,CKD也是最重要的轉歸。因此早期發現潛在危險因素至關重要,并進行早期干預,有效降低CKD患病率,提高NAFLD患者的生活質量。NAFLD的嚴重程度是否會影響CKD的進展,未來可能需要更多的研究來闡述NADLF與CKD的關系。

