腺苷酸活化蛋白激酶活性及其級(jí)聯(lián)效應(yīng)對(duì)肉品品質(zhì)的影響研究進(jìn)展
王 宇,袁 倩,王柏輝,楊 蕾,趙麗華,靳 燁*
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是一個(gè)異源三聚體,普遍存在于真核細(xì)胞生物中,由一個(gè)催化亞基α和兩個(gè)調(diào)節(jié)亞基β和γ構(gòu)成[1]。α亞基含有催化結(jié)構(gòu)域(kinase domain,KD)和自動(dòng)抑制結(jié)構(gòu)域(auto-inhibitory domain,AID),且有兩種異構(gòu)體,α1在機(jī)體中分布廣泛,定位于細(xì)胞質(zhì),而α2主要存在于骨骼肌、心臟和肝臟中,定位于細(xì)胞核[2];β亞基有兩種亞型,β1在肝臟中表達(dá),而β2在骨骼肌中表達(dá);γ亞基上有和腺苷一磷酸(adenosine monophosphate,AMP)、腺苷三磷酸(adenosine triphosphate,ATP)結(jié)合的位點(diǎn),其有3 種亞型,γ1和γ2在機(jī)體中分布廣泛,而γ3只在骨骼肌中表達(dá)[3]。細(xì)胞中的分解代謝和合成代謝共同決定細(xì)胞的能量狀態(tài),AMP是細(xì)胞能量狀態(tài)的關(guān)鍵檢測(cè)器,而AMPK是細(xì)胞中AMP的主要分子傳感器。因此,AMPK的活性主要由AMP與ATP的比值調(diào)控,機(jī)體在應(yīng)激狀態(tài)下消耗ATP導(dǎo)致AMP與ATP比值增大,從而激活A(yù)MPK,磷酸化的AMPK(phosphorylated AMPK,P-AMPK)激活A(yù)MPK的級(jí)聯(lián)效應(yīng),參與調(diào)控機(jī)體的能量代謝,上調(diào)產(chǎn)能分解代謝,關(guān)閉耗能代謝途徑[4]。AMPK通過調(diào)控下游靶蛋白和控制誘導(dǎo)基因轉(zhuǎn)錄修飾的轉(zhuǎn)錄因子和共激活劑的活性,調(diào)節(jié)細(xì)胞的能量代謝[5],進(jìn)而反映細(xì)胞能量水平以及特定細(xì)胞外營(yíng)養(yǎng)物質(zhì)的變化,如葡萄糖、脂肪酸、瘦素(Leptin)、脂聯(lián)素(adiponectin,AdipoQ)和生長(zhǎng)素,從而有助于控制機(jī)體的能量平衡和食物攝入量[6]。因此,深入研究AMPK的生物學(xué)特性對(duì)提高畜禽肉品品質(zhì)有重要的意義。
1 AMPK活力的調(diào)節(jié)
如同其他激酶,AMPK同樣通過磷酸化其活化環(huán)上的Thr172位點(diǎn)使其活化。AMPK無活性時(shí),AID結(jié)合到KD上,抑制AMPKα Thr172的磷酸化;而當(dāng)游離的AMP結(jié)合到AMPKγ上時(shí),導(dǎo)致AID從KD上解離,解除了AID對(duì)AMPKα Thr172位點(diǎn)磷酸化的抑制作用,且降低了磷酸化酶(protein phosphatase 2C,PP2C)對(duì)AMPKα Thr172位點(diǎn)去磷酸化作用,使Thr172仍處于磷酸化狀態(tài),間接激活A(yù)MPK[7]。目前發(fā)現(xiàn)3 種主要的AMPK上游激酶(AMP-activated protein kinase kinase,AMPKK),均通過磷酸化AMPKα Thr172位點(diǎn)使其活化[2]。據(jù)報(bào)道,5-氨基-4-甲酰胺咪唑核糖苷酸(5-amino-4-imidazolecarboxamide riboside,AICAR)、AdipoQ、Leptin等物質(zhì)均可調(diào)控AMPK活力。
1.1 上游激酶對(duì)AMPK活力的調(diào)節(jié)
抑癌肝激酶B1(liver kinase B1,LKB1)又名STK11,是AMPK主要的上游激酶。當(dāng)機(jī)體遭受饑餓、缺血、缺氧、藥物等應(yīng)激時(shí),LKB1會(huì)優(yōu)先激活A(yù)MPK保護(hù)機(jī)體。LKB1具有活性的必要條件是與兩個(gè)附屬蛋白——STE20相關(guān)銜接蛋白(STE20 related adaptor protein,STRAD)和小鼠蛋白25(mouse protein 25,MO25)形成復(fù)合物[8]。STRAD是LKB1的特異性接頭蛋白和底物,MO25的主要作用是連接到STRAD羧基端維持STRAD和LKB1復(fù)合物的穩(wěn)定性[7]。AMP結(jié)合AMPK使其成為L(zhǎng)KB1復(fù)合物的優(yōu)質(zhì)底物,不僅增強(qiáng)了LKB1對(duì)AMPK的磷酸化程度,而且降低了PP2C對(duì)AMPK的去磷酸化程度,從而激活A(yù)MPK[9]。Lin Ruiting等[10]的研究表明,6-磷酸葡萄糖酸脫氫酶使細(xì)胞內(nèi)5-磷酸核酮糖達(dá)到生理水平后抑制了LKB1-AMPK信號(hào)通路,進(jìn)而促進(jìn)脂肪酸的合成。
鈣/鈣調(diào)素依賴性蛋白激酶(calcium-calmodulin dependent protein kinase kinase,CaMKK)也可調(diào)控AMPK的活性。當(dāng)機(jī)體細(xì)胞漿中游離鈣的濃度升高時(shí),CaMKK將高靈敏地感受到Ca2+濃度變化而被激活[11]。在不改變AMP與ATP比值的情況下,相比于CaMKKα,CaMKKβ磷酸化AMPK的Thr172位點(diǎn)以激活A(yù)MPK的速度更快[12]。研究表明雷公藤甲素通過激活CaMKK-AMPK信號(hào)通路誘導(dǎo)癌細(xì)胞的自噬,如果敲除CaMKK基因或用特異性抑制劑sto-609抑制CaMKK的活性后,會(huì)導(dǎo)致癌細(xì)胞中AMPK Thr172位點(diǎn)的磷酸化水平降低,進(jìn)而抑制雷公藤甲素誘導(dǎo)癌細(xì)胞的自噬[13]。
轉(zhuǎn)化生長(zhǎng)因子β活化蛋白激酶1(transforming growth factor-β activated kinase,TAK1)是絲裂原活化蛋白激酶的成員,在AMPK活性調(diào)節(jié)中起重要作用[14]。Wang Bing等[15]的研究表明,一種新型組蛋白去乙酰化酶抑制劑Belinostat能提高胰腺癌細(xì)胞中活性氧(reactive oxygen species,ROS)的產(chǎn)生,但ROS只有在TAK1活性的介導(dǎo)下才可激活A(yù)MPK下游的信號(hào)級(jí)聯(lián)反應(yīng),TAK1的活性被抑制會(huì)明顯抑制ROS對(duì)AMPK的激活作用。
1.2 AMP途徑調(diào)節(jié)
5’-AMP可變構(gòu)激活A(yù)MPK(高達(dá)10 倍),ATP和AMP具有相似的結(jié)構(gòu),兩者可競(jìng)爭(zhēng)性結(jié)合AMPK的變構(gòu)位點(diǎn)[16]。細(xì)胞中AMP主要來源于腺苷酸激酶反應(yīng):2腺苷二磷酸(adenosine diphosphate,ADP)?ATP+AMP。當(dāng)機(jī)體處于靜息狀態(tài)下,ATP與ADP的比值維持在較高水平,反應(yīng)逆向進(jìn)行,所以低含量的AMP無法激活A(yù)MPK;但當(dāng)機(jī)體遭受應(yīng)激消耗ATP時(shí),反應(yīng)正向進(jìn)行,導(dǎo)致AMP大幅度增加,從而特異性激活A(yù)MPK[1]。AMP通過3 種方式激活A(yù)MPK:AMP變構(gòu)激活A(yù)MPKK;AMP結(jié)合到AMPK上,使其成為蛋白磷酸酶較差的底物,同時(shí)成為AMPKK的優(yōu)質(zhì)底物;AMP變構(gòu)激活A(yù)MPK[17]。另外據(jù)報(bào)道,ADP可提高AMPK Thr172位點(diǎn)的磷酸化程度,但前提是AMPK的β亞基N末端豆蔻酰化[18]。
AICAR是AMPK常用的激活劑。AICAR能激活對(duì)AMP敏感的酶,如AMPK、糖原磷酸化酶和果糖-1,6-二磷酸酶,所以AICAR不是AMPK的特異性激活劑[19]。機(jī)體攝入AICAR后,經(jīng)細(xì)胞腺苷激酶磷酸化為單磷酸核苷(D-ribofuranosyl-5-monophate,ZMP),ZMP與AMP具有高度的相似性,也可以結(jié)合AMPK的變構(gòu)位點(diǎn)激活A(yù)MPK,且兩者的作用具有加和性[20]。
1.3 AMP非依賴途徑調(diào)節(jié)
AdipoQ是脂肪組織分泌的一種細(xì)胞因子,主要通過與兩種受體AdipoQR1和AdipoQR2結(jié)合發(fā)揮其生物作用,AdipoQR1在組織中表達(dá)廣泛,而AdipoQR2主要存在于肝細(xì)胞中[21]。研究表明,AdipoQ結(jié)合AdipoQR1后會(huì)磷酸化LKB1使其活化,活化的LKB1通過磷酸化AMPKα的Thr172位點(diǎn)激活A(yù)MPK[22]。Awazawa等[23]的研究表明AdipoQ通過結(jié)合AdipoQR1激活A(yù)MPK,從而抑制固醇調(diào)節(jié)元件結(jié)合蛋白(sterol regulatory element-binding proteins,SREBP)1c的表達(dá),減少脂肪酸合成。
Leptin是脂肪細(xì)胞因子家族中的一員,主要由脂肪細(xì)胞分泌,它的循環(huán)水平和機(jī)體的脂肪量成正比[24]。Leptin與跨膜受體lepR結(jié)合使LKB1活化,活化的LKB1則從胞核轉(zhuǎn)移到胞質(zhì)中,磷酸化AMPK的Thr172位點(diǎn)激活A(yù)MPK[25]。García-Carrizo等[24]的研究表明,Leptin對(duì)AMPK僅在短時(shí)間內(nèi)具有激活作用,隨后的6~12 h期間AMPK的磷酸化水平顯著下降。有研究表明,Leptin通過磷酸化下丘腦中AMPKα的Ser491位點(diǎn)抑制AMPKα2的活性,通過磷脂酰肌醇3-激酶(phosphatidyl inositol 3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)-腫瘤抑制蛋白結(jié)節(jié)性硬化復(fù)合物(tuberous-sclerosis complex,TSC)-哺乳動(dòng)物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信號(hào)通路激活70S核糖體S6蛋白激酶(p70 ribosomal protein S6 kinases,p70S6K),而p70S6K通過磷酸化AMPKα的Ser491位點(diǎn)抑制AMPKα2的活性,導(dǎo)致體質(zhì)量下降和食欲降低[26],AMPK也可抑制p70S6K的活性進(jìn)而抑制蛋白質(zhì)的合成。
8Br-AMP和復(fù)合物C(Compound C)是AMPK常用的抑制劑,在不改變細(xì)胞AMP與ATP比值條件下,均可抑制AMPK的活性及其下游的級(jí)聯(lián)反應(yīng),但具體的作用機(jī)制需進(jìn)一步研究。
2 AMPK級(jí)聯(lián)效應(yīng)

圖1 AMPK級(jí)聯(lián)效應(yīng)示意圖Fig. 1 Schematic diagram of AMPK cascade
如圖1所示,AMPK級(jí)聯(lián)效應(yīng)由AMPK及其下游的一系列靶點(diǎn)基因構(gòu)成,一旦AMPK活化將磷酸化/去磷酸化其直屬下游靶點(diǎn),激活或抑制直屬下游靶點(diǎn)的活性,直屬下游靶點(diǎn)再聯(lián)動(dòng)地激活或抑制各自的下游靶點(diǎn),進(jìn)而激活A(yù)MPK的級(jí)聯(lián)效應(yīng),參與調(diào)控機(jī)體的能量代謝,如糖代謝、脂代謝、蛋白代謝。AMPK主要通過激活或抑制PGC-1α和FOXO1基因,聯(lián)動(dòng)地調(diào)控GLUT4、G6Pase等下游靶點(diǎn),參與調(diào)控機(jī)體糖代謝,進(jìn)而影響肉品的pH值、色澤和持水性等指標(biāo);通過激活或抑制PGC-1α和SREBPs基因,聯(lián)動(dòng)地調(diào)控PPARs、ACC和FAS等下游靶點(diǎn),參與調(diào)控機(jī)體脂代謝,進(jìn)而影響肉品的風(fēng)味、嫩度、多汁性、色澤和系水力等指標(biāo);通過抑制TSC基因級(jí)聯(lián)地調(diào)控mTORC1和eEF2K下游靶點(diǎn),參與調(diào)控機(jī)體蛋白代謝,進(jìn)而影響肉品的色澤。
3 AMPK對(duì)肉品品質(zhì)的影響
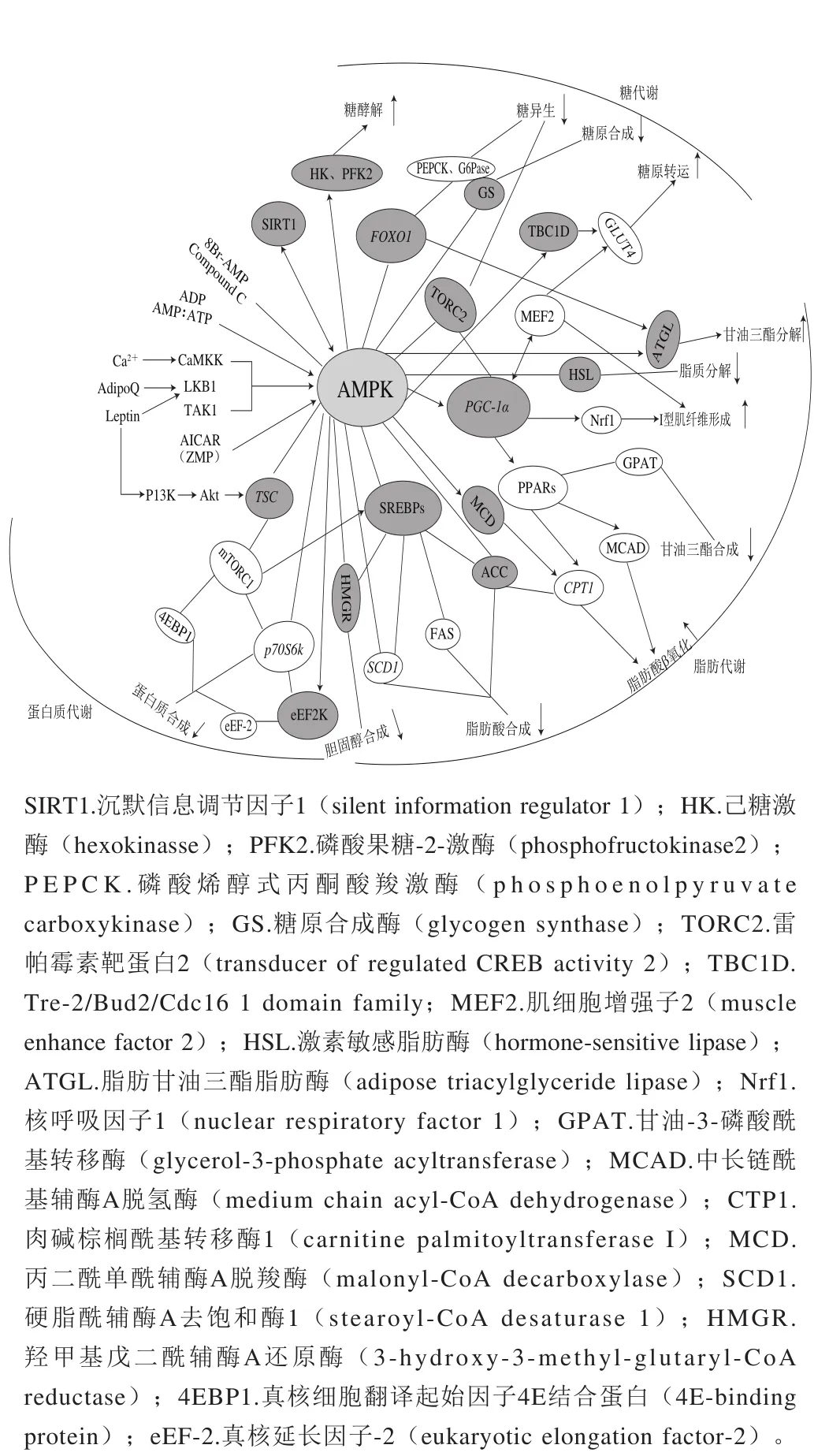
圖2 AMPK是能量代謝的主要調(diào)控器Fig. 2 AMPK is a major regulator of energy metabolism
3.1 AMPK通過調(diào)節(jié)糖代謝影響肉品品質(zhì)
靜息狀態(tài)下,機(jī)體中葡萄糖的產(chǎn)生與葡萄糖的攝取處于一定的動(dòng)態(tài)平衡,但當(dāng)外界因素(運(yùn)動(dòng)、饑餓、缺血、藥物、細(xì)胞因子等)刺激機(jī)體時(shí)導(dǎo)致整個(gè)動(dòng)態(tài)過程失衡并激活A(yù)MPK,P-AMPK主要通過以下3 種方式調(diào)節(jié)糖代謝:促進(jìn)GLUT4轉(zhuǎn)位、上調(diào)GLUT4基因的表達(dá);加速糖酵解;減少糖原合成和糖異生。
P-AMPK不僅可以磷酸化Rab10的TBC1域家族成員TBC1D1的Ser231位點(diǎn)和TBC1D4的Ser704位點(diǎn)使它們被激活,進(jìn)而調(diào)節(jié)GLUT4的囊泡與細(xì)胞膜的融合和停靠,增強(qiáng)GLUT4轉(zhuǎn)位[27],還能減少心肌細(xì)胞內(nèi)吞GLUT4,即增加細(xì)胞膜上GLUT4的含量,增加葡萄糖轉(zhuǎn)運(yùn)量[7]。P-AMPK通過磷酸化激活PGC-1α,而活化的PGC-1α再激活轉(zhuǎn)錄因子MEF2,促使MEF2向細(xì)胞核內(nèi)轉(zhuǎn)移并與GLUT4增強(qiáng)子結(jié)合,上調(diào)GLUT4基因表達(dá),促進(jìn)糖原轉(zhuǎn)運(yùn)[28]。P-AMPK通過直接磷酸化糖酵解關(guān)鍵酶(HK、PFK2等)或上調(diào)糖酵解酶的基因表達(dá)激活它們,進(jìn)而加速機(jī)體糖酵解,促進(jìn)ATP的合成[29]。Liang Junfang等[30]的研究表明,AMPKα2敲除的小鼠(而不是AMPKα1敲除的小鼠)降低了死后肌肉中AMPK的活性,且減少了宰后肉pH值的下降和乳酸的生成,所以AMPKα2催化亞基是宰后肌肉糖酵解主要的調(diào)節(jié)者。P-AMPK通過直接磷酸化GS的Ser7位點(diǎn)使其失活,減少糖原合成[18]。P-AMPK不僅可以直接磷酸化TORC2的Ser171位點(diǎn)使其失活,還可以直接磷酸化FOXO1使其失活,但不能進(jìn)入核內(nèi)與cAMP應(yīng)答元件結(jié)合蛋白(cAMP-responseelement-binding protein,CREB)結(jié)合抑制糖異生[31],也不能激活糖異生限速酶(PEPCK和G6Pase),進(jìn)而抑制糖異生[32]。研究表明PGC-1α可誘導(dǎo)糖異生,但由于TORC2被AMPK磷酸化而失活,中斷了PGC-1α-TORC2信號(hào)通路,抑制了糖異生[28]。
畜禽屠宰前,耐力運(yùn)動(dòng)或攝入特殊營(yíng)養(yǎng)物質(zhì)(L-精氨酸)可激活A(yù)MPK,提高骨骼肌糖原含量,進(jìn)而增強(qiáng)肌肉強(qiáng)度[33]。而畜禽屠宰后,肌肉及各細(xì)胞內(nèi)的生物化學(xué)反應(yīng)仍在繼續(xù)進(jìn)行,但由于失血導(dǎo)致體液平衡被破壞、供氧停止,機(jī)體很快進(jìn)入無氧狀態(tài),ATP含量迅速降低,激活A(yù)MPK,加速糖酵解途徑使乳酸蓄積,導(dǎo)致pH值快速降低,而糖酵解產(chǎn)生的熱量減慢了胴體的冷卻,故高溫和低pH值易導(dǎo)致形成PSE(pale,soft,exudative)肉。宰后肉AMPK活力的高低會(huì)直接影響pH值下降的快慢,進(jìn)而影響肉品的色澤、持水性等指標(biāo)。研究表明長(zhǎng)期處在饑餓壓力下的西藏綿羊,宰后肉的AMPK活力和乳酸含量增加、糖原含量減少、pH值降低、熟肉率降低、滴水損失減少、剪切力增加[34]。宰前運(yùn)輸加速機(jī)體ATP消耗,放血后肌肉的低能量狀態(tài)致使AMPK快速被激活,導(dǎo)致糖酵解迅速發(fā)生、乳酸積聚和PSE肉的形成率增加[35],而運(yùn)輸后休息期間的水淋浴噴霧可緩解宰前應(yīng)激并恢復(fù)畜禽能量,緩解了宰后肉質(zhì)的惡化。Hu等[36]的研究表明在急性熱應(yīng)激條件下,通過膳食中補(bǔ)充谷氨酰胺或葡萄糖均可提高雞胸肉的pH值、a*值和b*值,降低滴水損失、L*值和AMPK的活性。
3.2 AMPK通過調(diào)節(jié)脂代謝影響肉品品質(zhì)
ACC是脂肪酸合成的限速酶,有ACCα和ACCβ兩種亞型,ACCα主要在脂肪酸合成的組織中表達(dá),如肝臟和脂肪組織,ACCβ主要在脂肪酸氧化的組織中表達(dá),如骨骼肌和心肌[1]。P-AMPK通過磷酸化ACCβ的Ser221位點(diǎn)使其失活,抑制了ACC將乙酰輔酶羧化為丙二酰單酰輔酶A(malonyl-CoA,MCA)的催化作用,降低了MCA對(duì)CTP1的抑制作用[7],從而使線粒體外膜上的跨膜蛋白CTP1可催化長(zhǎng)鏈脂肪酸轉(zhuǎn)運(yùn)到線粒體基質(zhì)中進(jìn)行β氧化供能。P-AMPK也可激活MCD,導(dǎo)致MCA含量降低,加速脂肪酸氧化[37]。研究表明,P-AMPK先激活PPARα的輔助活因子PGC1,促進(jìn)PPARα和PGC1結(jié)合進(jìn)而上調(diào)PPARα的表達(dá),活化的PPARα可上調(diào)下游靶點(diǎn)CPT1和MCAD等脂肪酸β氧化的限速酶活力,從而增加脂肪酸氧化供能[38]。
P-AMPK不僅可以磷酸化HMGR的Ser871位點(diǎn)使其失活,降低膽固醇合成,也可以抑制其下游靶點(diǎn)過氧化物酶體增殖物激活受體γ(peroxisome proliferator-activated receptor γ,PPARγ)和GPAT的活性,減少脂肪細(xì)胞中甘油三酯的積累[39]。SREBPs能調(diào)控機(jī)體脂肪酸和甘油三酯的合成,當(dāng)機(jī)體膽固醇含量低時(shí),SREBP裂解激活蛋白會(huì)與SREBP1c結(jié)合將其送入高爾基體內(nèi)進(jìn)行修飾,暴露出活性部位,之后進(jìn)入核內(nèi)調(diào)節(jié)下游靶點(diǎn)ACC、SCD1和FAS等酶的活力,促進(jìn)脂肪酸生成[40]。研究表明,mTORC1也可激活SREBP1c,導(dǎo)致其發(fā)生核轉(zhuǎn)移并參與調(diào)節(jié)靶基因的后續(xù)轉(zhuǎn)錄,促進(jìn)脂肪酸生成[41]。而P-AMPK通過直接磷酸化SREBP1c,降低其轉(zhuǎn)錄活性、與DNA結(jié)合的能力及進(jìn)入核內(nèi)的數(shù)量,從而減少脂肪酸合成[42]。研究表明SCD1基因的突變或缺失可激活A(yù)MPK,增加脂肪酸氧化[43]。P-AMPK還可抑制SREBP2對(duì)其下游靶標(biāo)HMGR的調(diào)控,降低膽固醇的含量[44]。
當(dāng)脂肪分解速率高于脂肪酸利用率時(shí),會(huì)導(dǎo)致脂肪再次從頭合成,為防止ATP消耗,P-AMPK會(huì)磷酸化HSL的Ser565位點(diǎn),進(jìn)而阻止HSL的Ser563位點(diǎn)被環(huán)腺苷酸依賴cAMP的蛋白激酶磷酸化激活,最終降低脂肪的分解[45]。
SIRT1和AMPK均能調(diào)控脂類代謝。研究表明SIRT1可被酚類物質(zhì)激活,活化的SIRT1會(huì)激活LKB1和AMPK引起ACC磷酸化失活,從而參與脂質(zhì)代謝調(diào)控[46]。AMPK和SIRT1協(xié)同調(diào)控骨骼肌能量代謝相關(guān)基因的表達(dá),P-AMPK間接地通過增加細(xì)胞內(nèi)NAD+/NADH激活SIRT1,從而促進(jìn)其下游靶基因(如PGC-1α、CTP1、丙酮酸脫氫酶激酶4基因(pyruvate dehydrogenase kinase isozyme 4,PDK4)、GLUT4)的表達(dá),反過來SIRT1可對(duì)LKB1去乙酰化使其活化,活化的LKB1再磷酸化AMPK的Thr172位點(diǎn)激活A(yù)MPK[47]。Lin Jiandie等[48]的研究表明PGC-1α基因與肌纖維的轉(zhuǎn)化密切相關(guān),PGC-1α基因的過表達(dá)會(huì)提高骨骼肌中I型肌纖維的含量。AMPK經(jīng)外界刺激激活使細(xì)胞中NAD+/NADH增加,激活SIRT1,活化的SIRT1可介導(dǎo)下游靶點(diǎn)PGC-1α發(fā)生去乙酰化被激活,P-AMPK也可直接磷酸化PGC-1α的Thr177和Ser538位點(diǎn)以激活PGC-1α[49],活化的PGC-1α通過調(diào)控其下游靶基因MEF2和Nrf1的活性,促進(jìn)I型肌纖維形成[2]。MEF2也可直接與PGC-1α基因的啟動(dòng)子結(jié)合調(diào)控PGC-1α的表達(dá),進(jìn)而調(diào)控肌纖維類型的轉(zhuǎn)化[2]。
Cantó等[50]的研究表明SIRT1和PGC-1α的脫乙酰對(duì)AMPK增加PGC-1α的活性是必要的,抑制SIRT1活性會(huì)降低AICAR對(duì)PGC-1α脫乙酰的誘導(dǎo)作用,AMPK調(diào)節(jié)線粒體和脂質(zhì)代謝相關(guān)基因的表達(dá)時(shí),很大程度上需要依靠SIRT1對(duì)PGC-1α活力的調(diào)控。據(jù)報(bào)道,monacolin K通過SIRT1-AMPK信號(hào)通路使FOXO1脫乙酰化/去磷酸化被激活,活化的FOXO1由細(xì)胞質(zhì)定位轉(zhuǎn)變?yōu)楹硕ㄎ唬せ盍酥|(zhì)分解的限速酶ATGL,促進(jìn)甘油三酯分解為甘油和游離脂肪酸[51]。研究表明,AMPK通過磷酸化ATGL的Ser406位點(diǎn),增加了甘油三酯的分解[52]。monacolin K還可通過SIRT1-AMPK信號(hào)通路磷酸化SREBP1,抑制SREBP1進(jìn)入細(xì)胞核發(fā)揮脂肪合成作用[51]。一些研究表明SIRT1與AMPK相互作用,共同調(diào)控脂質(zhì)代謝,但兩者信號(hào)間的轉(zhuǎn)導(dǎo)關(guān)系仍需深入研究。
在畜禽飼養(yǎng)期間,通過外界刺激激活畜禽體內(nèi)的AMPK,一方面導(dǎo)致酵解型肌纖維向氧化型肌纖維轉(zhuǎn)變,使機(jī)體中氧化型肌纖維含量增加,肌纖維的類型決定肉的性能和品質(zhì),肌纖維類型組成不同,肉的嫩度、肌內(nèi)脂肪(intramuscular fat,IMF)含量、肌肉色澤和風(fēng)味等肉品指標(biāo)也有差異。若酵解型肌纖維所占比例大,則宰后肉pH值下降迅速且系水力低,易形成PSE肉。反之,氧化型肌纖維所占比例大,則肌肉嫩度好、pH值下降緩慢、色澤紅潤(rùn)、風(fēng)味好、肌紅蛋白和磷脂的含量也豐富。Huang等[53]的研究表明,氧化型肌纖維含量與背膘厚度和IMF含量呈正相關(guān),而酵解型肌纖維含量與IMF含量呈負(fù)相關(guān),與屠宰率呈正相關(guān)。另一方面,AMPK可抑制脂肪生成,影響畜禽的肌內(nèi)脂肪沉積量,進(jìn)而影響肉質(zhì)嫩度和多汁性。Shen等[54]的研究表明小鼠膳食中補(bǔ)充α-硫辛酸可提高小鼠死后肌肉的極限pH值,減少胴體脂肪的沉積,并可防止PSE肉的形成。Yang Ye等[55]的研究表明,慢速型生長(zhǎng)雞16 周后肌內(nèi)脂肪含量和脂肪基因表達(dá)明顯高于8 周快速生長(zhǎng)雞,且16 周慢速生長(zhǎng)雞的AMPK表達(dá)顯著低于8 周快速生長(zhǎng)雞,所以AMPK表達(dá)與雞的IMF含量呈負(fù)相關(guān)。王亞娜等[56]的研究表明,宰后肉在成熟過程中脂肪氧化和降解產(chǎn)生的醛、醇、酮等風(fēng)味物質(zhì)會(huì)對(duì)肉的風(fēng)味有一定影響。宰后肉經(jīng)烹飪處理產(chǎn)生的揮發(fā)性支鏈脂肪酸和烷基酚類也會(huì)影響肉品的風(fēng)味。
3.3 AMPK通過調(diào)節(jié)蛋白代謝影響肉品品質(zhì)
mTOR是調(diào)控機(jī)體蛋白質(zhì)合成的重要樞紐,mTOR發(fā)揮功能的必要條件是存在mTORC1或mTORC2。P-AMPK直接磷酸化TSC2的Ser1345位點(diǎn),激活TSC1/TSC2復(fù)合物,抑制小G蛋白的活性,使mTOR失活[57]。4EBP1和p70S6K是mTORC1下游蛋白,4EBP1調(diào)控蛋白的翻譯,而p70S6K調(diào)控蛋白的合成。mTORC1通過磷酸化4EBP1使真核細(xì)胞啟動(dòng)因子(eukaryotic initiation factor,eIF)4E從4EBP1-eIF4E復(fù)合物上解離下來,游離的eIF4E與eIF4G、eIF4B、eIF4A結(jié)合形成eIF4F起始復(fù)合物,再結(jié)合到5’ TOP mRNAs結(jié)構(gòu)上啟動(dòng)機(jī)體蛋白質(zhì)的翻譯[58]。p70S6K基因被mTORC1磷酸化形成了具有活性的P-p70S6K,促進(jìn)蛋白質(zhì)的合成[59]。mTOR經(jīng)P-AMPK作用失去活性,降低其對(duì)4EBP1和p70S6K的磷酸化作用,從而抑制機(jī)體蛋白質(zhì)的合成。
eEF-2主要調(diào)控機(jī)體蛋白質(zhì)的翻譯、肽鏈的延伸和核糖體的移動(dòng)等。P-AMPK通過磷酸化eEF2K的Ser398位點(diǎn)改變eEF2K的活性[60]。活化的eEF2K通過磷酸化eEF-2的Thr56位點(diǎn)使其失活,減少了eEF-2與核糖體間的相互作用,降低蛋白質(zhì)的合成[61]。研究表明mTORC1-p70S6K信號(hào)通路通過磷酸化eEF2K的Ser366位點(diǎn)抑制了eEF2K的活性[62]。
AMPK活性的改變可能導(dǎo)致mTOR信號(hào)的改變,并會(huì)影響畜禽瘦肉的生長(zhǎng)[63]。機(jī)體運(yùn)動(dòng)時(shí)AMPK被激活,抑制蛋白質(zhì)的合成,但運(yùn)動(dòng)后的恢復(fù)期,AMPK對(duì)蛋白質(zhì)的抑制減弱,機(jī)體會(huì)提高蛋白質(zhì)的合成以補(bǔ)充運(yùn)動(dòng)中流失的蛋白質(zhì)[47]。Dreyer等[64]的研究表明,運(yùn)動(dòng)期間P-AMPK降低了4EBP1的磷酸化,進(jìn)而抑制蛋白質(zhì)的合成,但運(yùn)動(dòng)后1~2 h Akt、mTOR、S6激酶、eEF2等的活化提高了蛋白質(zhì)的合成;因此可通過增加畜禽的運(yùn)動(dòng)量提高AMPK活性,增加運(yùn)動(dòng)后期蛋白質(zhì)的合成,如增加肌紅蛋白的含量以提高肉的色澤、增加一些肌纖維蛋白的合成以增強(qiáng)肌肉的強(qiáng)度。Appuhamy等[65]的研究表明,P-AMPK對(duì)牛乳腺上皮細(xì)胞中mTOR介導(dǎo)的蛋白質(zhì)合成具有負(fù)向調(diào)控作用,但與mTOR介導(dǎo)的乳蛋白合成相比,其對(duì)乳蛋白合成速率的影響甚微。
4 結(jié) 語
AMPK及其級(jí)聯(lián)效應(yīng)可調(diào)控機(jī)體的各種能量代謝,如促進(jìn)糖酵解、葡萄糖吸收、脂肪酸氧化和I型肌纖維形成,并抑制糖原、脂肪酸、膽固醇、蛋白質(zhì)等物質(zhì)的合成。所以,調(diào)控AMPK的生物學(xué)效應(yīng)將有利于肉品品質(zhì)的改善。到目前為止,國(guó)內(nèi)外主要是將AMPK作為許多慢性代謝疾病的治療靶點(diǎn),如糖尿病、肥胖、癌癥和腫瘤等,而通過調(diào)控AMPK改善肉品品質(zhì)的研究相對(duì)較少。但由于AMPK是機(jī)體糖脂蛋白代謝的重要調(diào)節(jié)器,宰前AMPK主要通過調(diào)節(jié)脂代謝和蛋白代謝影響機(jī)體脂肪沉積、肌纖維類型及蛋白質(zhì)的合成,進(jìn)而影響肉品品質(zhì),而宰后其主要通過調(diào)控糖酵解影響肉品品質(zhì)。因此,AMPK及其級(jí)聯(lián)效應(yīng)仍是改善肉品品質(zhì)的重要靶點(diǎn)。

