高效液相色譜法檢測黃瓜中的膠霉毒素
毛黎娟,章初龍
(浙江大學 a農生環測試中心,b生物技術研究所,浙江 杭州 310058)
真菌在谷物或其他食品中生長繁殖時會產生真菌霉素,當人或動物食入這種霉變的谷物或食品時發生中毒現象,即為真菌性食物中毒。真菌毒素是食品鏈中的隱形殺手,著名的真菌毒素有黃曲霉毒素、鐮刀菌毒素。
膠霉毒素是煙曲霉產生的真菌毒素之一[1-6],具有免疫抑制活性和抗菌活性。除了煙曲霉以外,青霉(Penicillium)、木霉(Trichoderma)等很多真菌都可以產生膠霉毒素。歐盟302/2 014號法規批準由里氏木霉菌株CBS 126896生產的內切-1,3(4)-β-葡聚糖酶制備物可作為飼料添加劑使用,但加拿大等規定產真菌毒素的生產菌不能用作飼用酶制劑生產菌。同時,木霉還是常用的植物病害生防真菌,一些木霉種,如綠木霉(T.virens)會產生膠霉毒素[7]。但迄今關于在農作物上使用生防木霉菌是否會導致農產品中膠霉毒素殘留仍未明確。因此,建立膠霉毒素的定量分析方法對于檢測谷物或食品中的膠霉毒素殘留,以及分析真菌產膠霉毒素的能力等都是非常必要的。
Romer Labs@建立了針對膠霉毒素的基于薄層層析(TLC)的定量檢測方法,可用于谷物、飼料等樣品中膠霉毒素的半定量檢測,國內也有研究人員對人體細胞和煙曲霉共培養液中的膠霉毒素進行檢測、對產膠霉毒素的真菌菌株進行分離鑒定等,但還未見對糧食或蔬菜中膠霉毒素進行測定的報道。為此,擬建立適合于黃瓜中膠霉毒素殘留檢測的高效液相色譜(HPLC)定量分析方法,以期為相關研究及應用提供參考。
1 材料與方法
1.1 試材與儀器試劑
供試材料為市售黃瓜。
儀器:Delta 600高效液相色譜儀,美國Waters;Tissuelyser-24全自動樣品快速研磨儀,中國上海凈信科技;3K15臺式高速離心機,德國Sigma;分析天平,中國上海梅特勒-托利多儀器有限公司;超聲波清洗器,中國上海科導超聲儀器有限公司。
試劑:甲醇、乙腈均為色譜純,德國Sigma;試驗用水為Milli-Q超純水。
1.2 方法
1.2.1 對照品儲備液制備
膠霉毒素標準品購自Romer Labs@,濃度101.0 μg·mL-1,4 ℃避光保存。準確移取1.0 mL置于10.0 mL容量瓶中,加乙腈溶解,定容至刻度,即得對照品儲備液(含膠霉毒素10.10 μg·mL-1)。
1.2.2 供試品處理
取黃瓜500 g,去蒂。將可食用部分切碎,用組織粉碎機將樣品加工成漿狀,均勻分成若干份,分裝入潔凈盛樣袋內,密閉,標記。準確稱取0.5 g均勻試樣置于5 mL的具塞刻度塑料離心管中,準確加入2.0 mL 84:16(體積比)乙腈-水溶液,加入5顆陶瓷珠,用全自動樣品快速研磨儀65.00 Hz快速提取180 s,重復提取4次。先以9 000 r·min-1離心15 min,取上清,再以12 000 r·min-1離心20 min,取上清液,即得供試品溶液。
1.3 液相色譜條件
分析柱:XBridge C18,內徑5 μm,4.6 mm×250 mm(寬pH值范圍),柱溫35 ℃;流動相:A相為水,B相為甲醇。梯度洗脫程序:0 min,流速1.0 mL·min-1,流動相A與流動相B體積比50∶50;15.00 min,流速1.0 mL·min-1,流動相A與流動相B體積比50∶50;15.10 min,流速1.0 mL·min-1,流動相A與流動相B體積比25∶75;20.00 min,流速1.0 mL·min-1,流動相A與流動相B體積比10∶90;25.00 min,流速1.0 mL·min-1,流動相A與流動相B體積比50∶50;35.00 min,流速1.0 mL·min-1,流動相A與流動相B體積比50∶50。檢測條件:流速1.0 mL·min-1,進樣體積20 μL,檢測器為Waters 2998二極管陣列檢測器。
1.4 測定方法
取對照品溶液及供試品溶液20 μL進行液相色譜分析,記錄色譜圖。采用標準曲線法計算樣品中膠霉毒素的含量。
2 結果與分析
2.1 提取溶劑
分別選用84∶16(體積比)的乙腈-水溶液與70∶10∶20(體積比)的甲醇-水-正己烷溶液提取黃瓜中的膠霉毒素。結果顯示,在相同質量的黃瓜中加入相同體積的提取溶劑,都能滿足提取需要,但是甲醇-水-正己烷溶劑體系不互溶,增加了操作步驟;因此,本試驗采用84∶16(體積比)的乙腈-水溶液作為提取溶劑,進行膠霉毒素提取。
2.2 色譜條件
2.2.1 流動相比例
流動相由甲醇和水組成,隨甲醇濃度的增加,膠霉毒素保留時間減小。如果膠霉毒素濃度太大,與雜質峰不能實現基線分離;如果膠霉毒素濃度太低,則峰寬變大,保留時間太長。本試驗對流動相比例、濃度、流速等條件進行篩選,最終采取梯度洗脫的方法。在該梯度條件下,雜質峰和膠霉毒素色譜分離良好,且可減少數據采集時間,保護色譜柱。
2.2.2 檢測波長
以10.10 μg·mL-1膠霉毒素標準溶液在1.3節的流動相條件下在210~400 nm波長進行掃描,結果顯示,最大吸收峰為269 nm。故采用269 nm作為檢測波長進行定量分析(圖1)。

A,檢測波長210~400 nm的檢測結果;B,出峰時間為9.348 min 時210~400 nm的檢測圖譜;C,出峰時間為9.348 min、 269 nm檢測波長下的HPLC色譜圖1 膠霉毒素標準溶液的檢測圖譜
2.3 專屬性
在上述試驗條件下,經預處理的黃瓜樣品中其他物質不干擾膠霉毒素的測定(圖2),可見該方法專屬性良好。
2.4 線性關系
分別精密移取對照品儲備液適量,用流動相作為稀釋液進行稀釋,并配制膠霉毒素濃度分別為0.101、0.202、0.505、1.01、2.02、5.05、10.1 μg·mL-1的系列標準溶液,進行高效液相色譜分析。以峰面積為縱坐標,對照品溶液濃度為橫坐標,繪制標準曲線,得線性回歸方程為Y=9788.9X+537.45,R2=0.997 9。結果表明,膠霉毒素在0.101~10.10 μg·mL-1范圍內線性關系良好。
2.5 檢測限和定量限
以3倍信噪比所對應的濃度作為檢測限,以10倍信噪比所對應的濃度作為定量限,結果顯示,本試驗方法的檢測限與定量限分別為0.101、0.202 μg·mL-1,相當于取樣量為0.5 g時,樣品中對應的膠霉毒素含量分別為0.4、0.8 mg·kg-1。
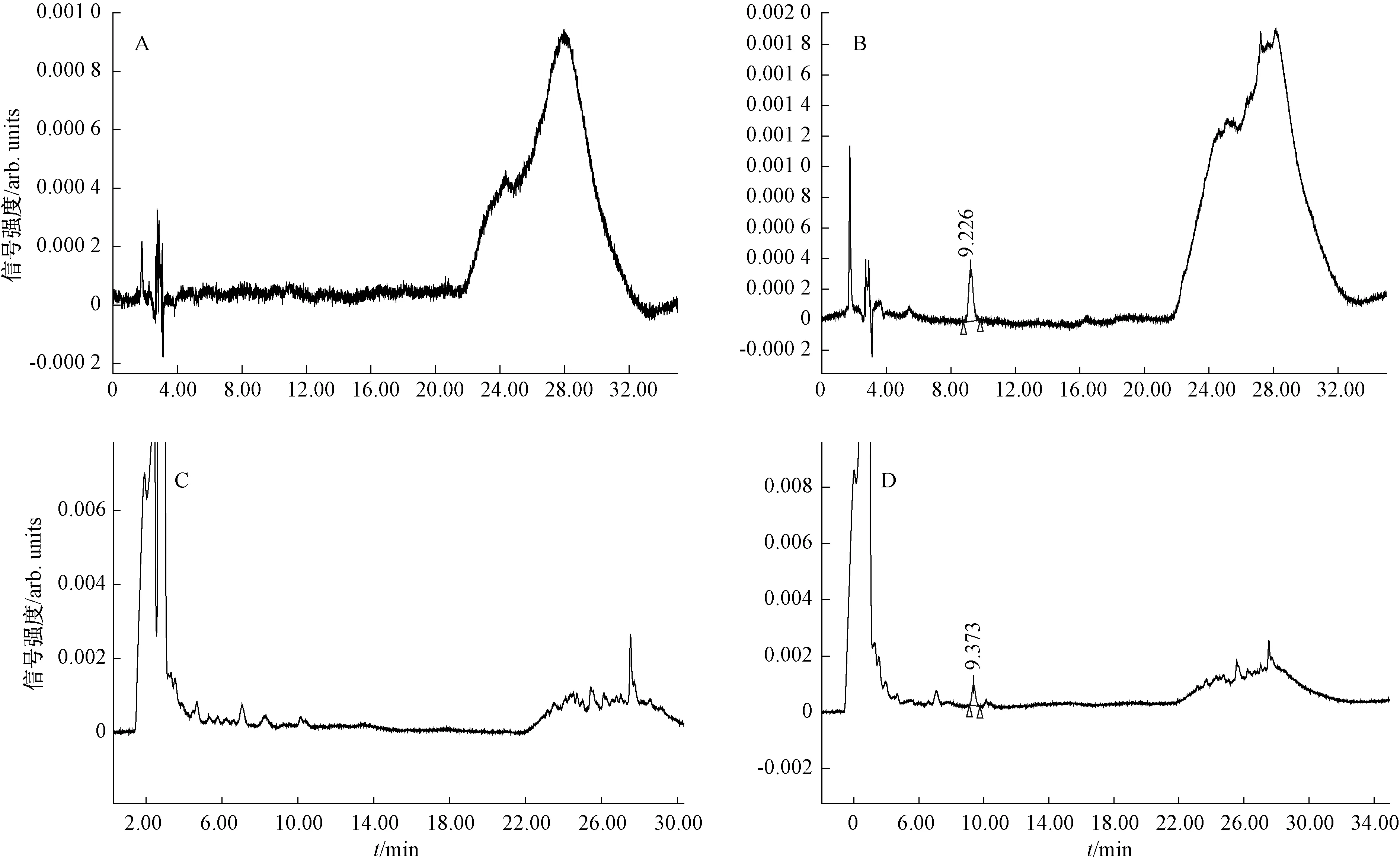
A、B、C、D分別為空白、對照、樣品和樣品加標圖2 黃瓜中膠霉毒素的高效液相色譜檢測結果
2.6 精密度
分別取對照品溶液0.101、1.01、5.05 μg·mL-1,按照色譜條件連續進樣,測定5次,計算峰面積的相對標準偏差(relative standard deviation, RSD),平均值為2.5%,表明膠霉毒素測定精密度良好。
2.7 穩定性
取新制備的0.101、1.01、5.05 μg·mL-1的對照品溶液,室溫下棕色瓶中密封避光保存,分別保存0、4、12、16、36、42、124、130 h進樣(表1),檢測結果的RSD分別為3.3%、3.4%、2.1%,表明膠霉毒素溶液穩定性良好,但盡快進樣的測定結果更可靠。
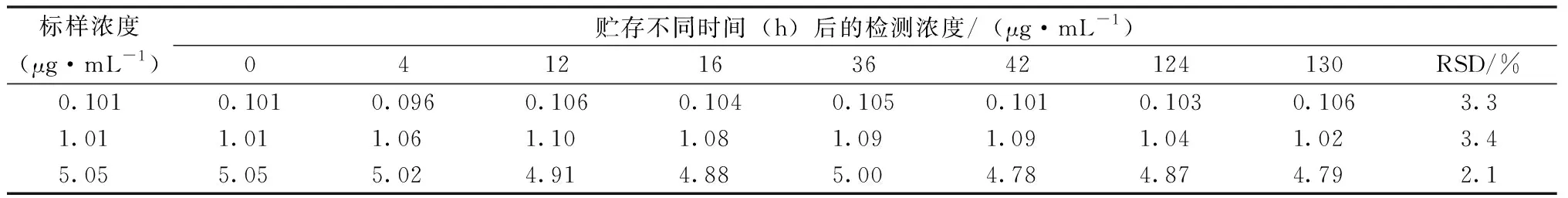
表1 膠霉毒素的穩定性試驗結果
2.8 重復性
分別稱取同批次黃瓜約0.5 g,加入膠霉毒素對照品溶液(膠霉毒素濃度為101 μg·mL-1)10.0 μL,制成含1.01 μg的樣品,按1.2.2節方法平行制備6份供試品溶液,按照1.3節色譜條件進行測定,測定的膠霉毒素含量分別為2.033 7、1.952 3、2.191 7、2.115 2、1.998 2、2.180 0 mg·kg-1,計算樣品膠霉毒素含量的RSD為4.8%。
2.9 回收率
取無膠霉毒素殘留的黃瓜空白樣品各0.50 g,分別加入膠霉毒素對照品溶液(膠霉毒素濃度為101 μg·mL-1)5.0、10.0、20.00 μL,制成含低中高3種濃度的樣品,每個濃度樣品平行3份,按照前述方法進行測定,計算回收率。黃瓜中膠霉毒素的平均回收率分別為106.3%、103.2%和105.5%,RSD分別為1.4%、3.7%和5.0%(表2),符合檢測要求,可滿足黃瓜樣品中含低中高濃度的膠霉毒素殘留的檢測要求。
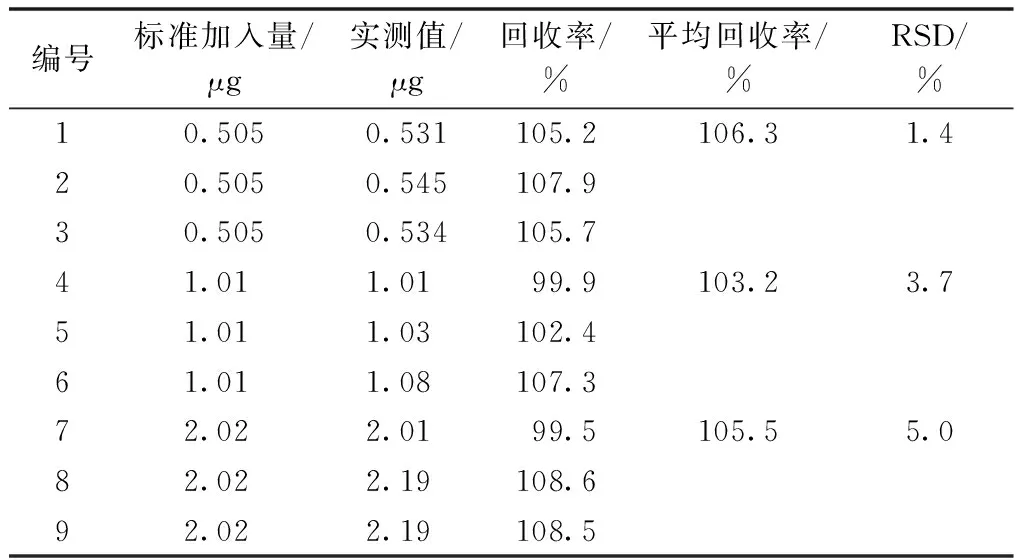
表2 黃瓜樣品中膠霉毒素加標回收率及精密度
3 小結
建立黃瓜中膠霉毒素的HPLC定量分析方法,與Romer Labs@建立的膠霉毒素TLC定量檢測方法相比,該方法操作簡便、靈敏度高、專屬性強,能較準確地測定膠霉毒素殘留量。該方法測定黃瓜中膠霉毒素含量的線性范圍為0.101~10.1 μg·mL-1,檢測限為0.101 μg·mL-1,回收率99.5%~108.6%,對黃瓜樣品進行測定的RSD為1.4%~5.0%,可用于黃瓜樣品中膠霉毒素殘留量的檢測。

