不同有機酸協同超高壓處理對黃酒中醇水締合影響的研究
曹晶晶,曾慶梅,*,張傲娜,嚴王慧,鄭 玥,魏國華
(1.合肥工業大學食品科學與工程學院,安徽合肥 230009;2.合肥工業大學 農產品生物化工教育部工程研究中心,安徽合肥 230009)
黃酒營養豐富,有“液體蛋糕”之稱,是具有特殊風味和口感的醇水溶液。它作為傳統的酒精發酵飲料,是中國最受歡迎的酒精飲料之一,年消耗量達數百萬升[1]。對于自然老熟過程,人們提出了“締合說”[2]。締合說認為,新酒中游離的酒精分子或酒精分子團較多,對感官的刺激性較大,口感欠佳;水和乙醇都是極性分子,有很強的締合能力,在貯存過程中,黃酒中的乙醇分子與水分子之間通過氫鍵發生締合作用,使更多的乙醇分子受到束縛,游離的乙醇分子數目減少,從而降低了酒精對味覺器官的刺激作用,飲酒感到柔和、圓潤、刺激性小;黃酒中水和乙醇含量約占整體的95%[3]。根據締合說,黃酒中主要存在水-水,水-乙醇和乙醇-乙醇分子間的氫鍵締合作用。研究[4]表明黃酒刺激性降低被認為是水-乙醇分子的氫鍵結構的變化。
新生黃酒在陶壇中貯存至少一年才能上市。傳統的陳化過程耗時耗力,生產周期長,影響企業經濟效益[2]。目前超高壓(Ultra-High Pressure,UHP)已經被廣泛應用于酒類研究中[5],高壓能夠為酯化、氧化等化學反應提供能量,加快老熟[6],并且不會對酒體的顏色、pH、濁度等感官性質產生有害作用。但關于超高壓在黃酒氫鍵締合的應用報道較少;黃酒中的有機酸種類較為豐富。適量的酸在酒中起到緩沖、調和、諧味的作用[7]。有機酸中的羥基質子極性較強,可能對黃酒的氫鍵締合具有一定影響[8-9]。
在溶液化學領域,醇水溶液的氫鍵研究是最具吸引的課題之一。而飲料酒中的氫鍵研究卻相對較少。喬華[2]等人基于粘度考察了酒度、貯存時間及汾酒中主要微量成分對模型白酒黏度的影響。楊星[10]等對通過核磁共振研究白酒模擬體系發現,隨著貯藏時間的延長,體系中氫鍵締合強度逐漸增強。目前,大多數學者僅用1H-NMR光譜中水的羥基質子峰來表征氫鍵締合強度[11]。本文在同時考察水和乙醇羥基質子峰基礎上,還進行了粘度測量。通過有機酸協同超高壓處理新生黃酒來強化氫鍵締合,以期找到一種有效的方法解決新生黃酒刺激性大的問題,以指導生產實踐。
1 材料與方法
1.1 材料與儀器
二次超純水;99.7%乙醇、檸檬酸、蘋果酸、乳酸、乙酸、丙酮酸等均為分析純,所有試劑 均購自合肥美豐化學儀器有限公司;新壓榨未經陳釀的新生黃酒、一年陳黃酒 取自安徽省古南豐酒業有限公司。
1 L YcB630/2.5超高壓設備(工作壓力0~600 MPa,工作溫度0~80 ℃) 兵器工業第五二研究所;DZQ-400多功能真空包裝機 上海嘉歆包裝機械有限公司;烏式粘度計(0.6~0.7 mm) 上海前鋒橡塑玻璃制品廠生產;粘度計專用恒溫水浴槽 上海平軒科學儀器有限公司;超導核磁共振(NMR)光譜儀 美國安捷侖公司;sanorious PB-10 pH計 北京賽多利斯儀器系統有限公司;氣質聯用儀 德國布魯克公司。
1.2 實驗方法
1.2.11H-NMR檢測1H-NMR用超導核磁共振光譜儀在20 ℃、400 MHz下操作。氘代試劑是由美國CIL生產的含有0.03%(體積分數)(TMS)作為外部參比的CO(CD3)2。
1.2.2 粘度檢測 通過烏式粘度計測量粘度。毛細管直徑為0.6~0.7 mm。通過循環恒溫水浴槽將測試溫度保持在(30±0.05) ℃。
1.2.3 黃酒氫鍵締合強度指標的確定 用二次超純水將無水乙醇稀釋成乙醇體積分數分別為:0.00%、5.00%、10.00%、18.00%、30.00%、40.00%、50.00%、60.00%、70.00%、80.00%、90.00%、100.00%的溶液。按1.2.1和1.2.2方法測定上述溶液的1H-NMR和粘度。結合研究結果根據黃酒酒度范圍確定適用于黃酒體系的氫鍵締合強度檢測指標。
1.2.4 樣品超高壓處理 將未經陳釀的新生黃酒以及一年陳黃酒于3000 r/min下離心30 min,取上清液待用。取50 mL不同濃度的乙醇-水溶液分裝于聚乙烯袋中封口,排盡袋中空氣,并用封口機熱封口。確定超高壓的壓力條件為100、200、300、400 MPa,保壓時間20 min,對應樣品編號為W100,20 min、W200,20 min、W300,20 min、W400,20 min;超高壓處理時間為5、10、20、30 min,壓力為300 MPa,對應樣品編號為W300,5 min、W300,10min、W300,20 min、W300,30 min;未處理樣品編號為W0;溫度均為室溫,循環次數為一次。超高壓設備的有效體積為1 L,升壓速度100 MPa/min,降壓時間為5~10 s,腔內水溫為常溫。
1.2.5 黃酒中有機酸對乙醇水氫鍵締合的影響 配制檸檬酸濃度為1×10-5、1×10-4、1×10-3、1×10-2、1 mol/L的18%(v/v)的乙醇水溶液,按1.2.1、1.2.2方法進行1H-NMR和粘度檢測。蘋果酸、乳酸、乙酸、丙酮酸對18%乙醇水溶液氫鍵締合影響的考察方法同檸檬酸。
1.2.6 黃酒理化指標及風味物質檢測 參照國標《GB/T 13662-2008》的方法,對黃酒中酒精度、總糖、總酸、pH、氨基酸態氮、非糖固形物進行測定。黃酒揮發性風味物質的檢測沿用課題組已建立的頂空固相微萃取氣相色譜-質譜法。內標物選擇2-乙基丁酸,具體的樣品預處理方法、頂空固定微萃取條件及色譜條件參考相關文獻[12]。
1.2.7 黃酒感官評價 根據國標《GB/T 13662-2008》的感官評價方法,擬定了已驗證過的黃酒感官評分標準。由經過訓練的小組成員(每次8人)對黃酒樣品進行色澤、香氣、口味以及風格根據黃酒感官實驗評分表進行感官品評,取平均分為最終得分。
1.3 數據統計與分析
所有數據均為三次實驗平均值,且粘度測量誤差在30 s以內。核磁數據采用Mestre Nova軟件處理,實驗數據采用Excel、SPSS 20.0和Origin 8.0進行分析,p<0.05表示差異顯著。
2 結果與分析
2.1 黃酒氫鍵締合強度檢測指標的確定
1H-NMR可以測量質子的相對化學位移來確定氫鍵締合的類型。更重要的是,它可以反映分子間氫鍵締合的細節[13]。通過1H-NMR研究在乙醇摩爾濃度范圍內水和乙醇混合液的氫鍵締合的情況。0%、5%、18%、30%、40%、50%、60%、70%、80%、90%(v/v)和沒有H+或OH-雜質的純乙醇溶液1H-NMR光譜如圖1所示。在整個乙醇濃度范圍內的羥基質子化學位移值如表1所示。

圖1 乙醇-水溶液的1H-NMR光譜

表1 隨著乙醇濃度變化乙醇和水羥基質子化學位移值
由圖1可見,乙醇的羥基質子峰隨著乙醇濃度的增加逐漸明顯;甲基和亞甲基隨乙醇濃度增加峰型無明顯變化;在乙醇摩爾分數χ范圍內,水羥基質子峰和醇羥基質子峰獨立分離,易于區分。由表1看出在純水溶液中,只有水羥基質子峰,羥基質子化學位移δ(H-OH)為4.685。另一方面,在純乙醇溶液中,乙醇的羥基質子化學位移δ(Et-OH)為4.994。根據黃酒國家標準[14],在黃酒的酒度范圍內,1H-NMR顯示易于區分的乙醇和水的羥基質子峰。
圖2(a)顯示,在EtOH-H2O溶液中,甲基和亞甲基的質子化學位移在很大程度上不受乙醇濃度的影響。因此,它們可作為內部參考峰。圖2(b)可以看出,在0<χ(乙醇摩爾濃度)<1.00范圍內,乙醇羥基質子化學位移遠高于純乙醇δ(Et-OH)=4.994(χ=1),水質子化學位移比純水的δ(H-OH)=4.685(χ=0)小得多。據了解,氫鍵締合影響醇水結構。隨著質子外部環境的變化,其化學位移發生變化,原來的乙醇-乙醇和水-水結構被破壞。在不同的乙醇摩爾濃度區域微觀締合結構呈現新的狀態。這個結論與Burikov[14]等人通過分析拉曼和紅外光譜研究了乙醇-水體系的結論一致。
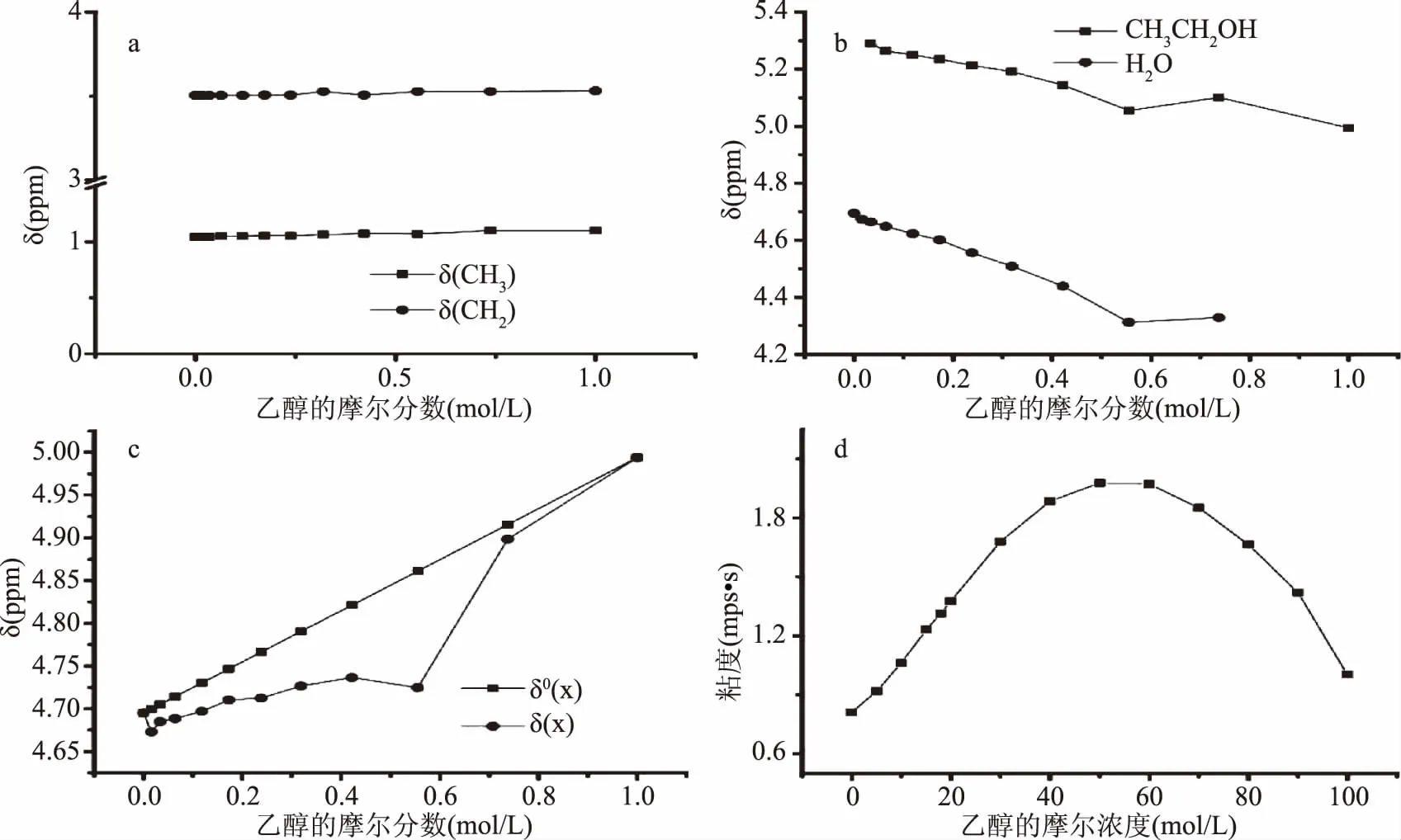
圖2 乙醇水溶液的1H-NMR數據及體系粘度變化
Dixit[16]認為乙醇和水混合后的熱力學變化是由于系統內分子之間氫鍵的不完全混合造成的。因此為了確定氫鍵強度,我們在不同乙醇濃度的乙醇-水溶液中讀取了兩個羥基質子峰。
δ(χ)為溶液中乙醇和水的羥基質子化學位移加權平均值:
δ(χ)=δe(χ)χ+δw(χ)(1-χ)
式(1)
式(1):δe(χ)和δw(χ)分別表示乙醇摩爾分數為χ時,乙醇和水的羥基質子化學位移。
假設溶液混合的理想狀態是指兩者在混合體系內不發生任何締合作用,δ°(χ)為理想混合時純水和純乙醇的羥基質子加權平均化學位移:
δ°(χ)=δe(0)χ+δw(1)(1-χ)
式(2)
式(2):δe(0)和δw(1)分別為純乙醇和純水未經超高壓處理的羥基質子化學位移。
為了更直觀的說明乙醇-水溶液的不完全混合與理想混合之間的差別,又引入公式:
Δδ=δ°(χ)-δ(χ)
式(3)
其中Δδ越大,表明乙醇和水分子混合狀態與理想混合相差越遠,分子間氫鍵締合越強。
圖2(c)顯示了δ°(χ),δ(χ)隨乙醇摩爾分數增加的變化情況。當乙醇摩爾濃度χ為0.550時,Δδ值達到最大值,結果與粘度測量一致(參見圖2(d))。原因可能是此時乙醇與水分子之間形成穩定的氫鍵結構。乙醇-水溶液中乙醇與水的摩爾比接近1∶2,導致在強氫鍵下形成穩定的環狀三聚體締合結構[17]。
2.2 超高壓處理對乙醇-水體系中醇水締合影響
2.2.1 超高壓處理壓力對乙醇-水體系中醇水締合影響 按1.2.4的方法對樣品進行超高壓處理,不同壓力處理20 min下乙醇-水體系的Δδ變化見表2。

表2 不同壓力處理20 min對醇水體系氫鍵締合影響
由表2可見,隨著處理壓力的增大,醇水體系的Δδ值先增大后減小,并且在300 MPa下,達到最大值。這可能是由于高壓對醇水溶液提供的能量,促進乙醇水體系形成更為穩定的氫鍵締合群。而隨著壓力增加到一定值時,過多的能量破壞溶液中原有的水分子和乙醇分子之間的締合群,溶液中游離態乙醇分子、水分子增加,使氫鍵締合向著減弱的方向移動[18]。可見壓力過大反而能破壞原有的醇水氫鍵締合。
2.2.2 超高壓處理時間對乙醇-水體系中醇水締合影響 按1.2.4的方法對樣品進行超高壓處理,300 MPa不同處理時間下乙醇-水體系的Δδ變化見表3。
由表3可見,隨著處理時間的增加,醇水體系的Δδ值先增大后減小,并且在20 min處理下,達到最大值。這可能是由于隨著處理時間的增加,高壓物理能的積聚與壓力不斷增大所產生的物理能的效果相同導致,并且在20 min處理條件下,更有利于促進體系的乙醇-水分子間的氫鍵締合。

表3 300 MPa不同處理時間對醇水體系氫鍵締合影響
分別對壓力和時間兩個因素進行單因素方差分析,可得壓力對醇水氫鍵締合的影響更顯著。綜合上述數據分析可得在300 MPa、20 min處理條件下,醇水體系中的乙醇分子與水分子之間的締合得到了較大加強,為解釋超高壓處理能夠加速酒體的陳釀過程提供了一定的實驗依據。
2.3 有機酸對醇水氫鍵締合的影響
2.3.1 檸檬酸對醇水氫鍵締合的影響 在乙醇水溶液中,考察了不同濃度檸檬酸對-OH質子化學位移的影響(參見圖3)。在檸檬酸濃度1×10-3mol/L時可引起黃酒化學轉移向低場移動(參見圖3(b))。如圖3(c)可見,即使添加1×10-4mol/L的檸檬酸,也可以清楚地觀察到可易于區分的水和乙醇的羥基質子峰。但圖3(a)中當檸檬酸濃度為1×10-1mol/L中乙醇和水的兩個-OH峰合并為單峰并位于較低場(δ=5.11)。有學者提出,由于快速的質子交換,醇水間氫鍵締合作用加強,乙醇和水的羥基質子峰合并為單峰。因此,圖4所示合并單峰的羥基質子化學位移δ值隨著檸檬酸濃度的增加而增加,即氫鍵締合強度不斷增強。

圖3 乙醇-水溶液在不同濃度檸檬酸添加下的1H-NMR光譜

圖4 -OH質子化學位移隨檸檬酸濃度的變化
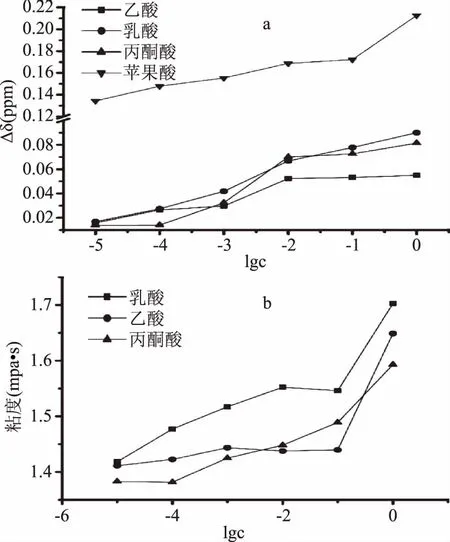
圖5 有機酸對醇水氫鍵締合的影響

圖6 各種有機酸的分子鍵線式
Fig.6 The molecular structure of various organic acids

圖7 一維核磁共振氫譜
Fig.7 The proton spectra after different treatment
注:a.原酒;b.超高壓處理酒;c.蘋果酸-超高壓處理酒;d.檸檬酸-超高壓處理酒;e.一年陳黃酒。
2.3.2 其他酸對醇水氫鍵締合的影響 本文還研究了蘋果酸、丙酮酸、乙酸和乳酸對模型黃酒醇水氫鍵締合的影響(參見圖5)。結果表明所研究的酸均會導致Δδ和粘度值隨著乙醇濃度的增加而增加。酸引起了H2O和EtOH分子之間的緊密關聯。酸對氫鍵的影響可分為兩個因素:未解離的酸分子(HA)和解離的H+[19]。由圖5可見,有機酸對模型黃酒氫鍵締合強度影響順序為:蘋果酸,乳酸,丙酮酸,乙酸。酸對氫鍵締合的影響可能與-OH,-COOH和-C=O基團的數量有關。圖6可知,乳酸具有一個羧基(-COOH)和一個羥基(-OH),而蘋果酸具有兩個羧基,且它們碳骨架一致。通過比較1.0 mol/L蘋果酸與同濃度下乳酸的Δδ值,得出基于羧基對Δδ的貢獻值約為0.123。黃酒中的有機酸除了含有羥基外,還有吸電子基團—羰基,這就使得羥基上的氫(通常稱羥基氫)正電性更強[7]。因此酸氫鍵作用力比醇更強。其不僅與乙醇水的締合群形成分子間氫鍵,還可能直接參與乙醇水的締合結構網絡,形成了新的酸-醇-水締合結構網絡。
2.4 有機酸協同超高壓處理對黃酒氫鍵締合的影響
根據上述實驗結果可以設想:令有機酸與超高壓協同作用處理新生黃酒,對處理后黃酒進行氫鍵締合強度檢測。擬找到強化黃酒氫鍵締合的工藝措施,改善陳釀周期長等缺點[20]。分別取100 mL黃酒共4組,第一組為空白對照組,第二組未加有機酸,第三組和第四組分別加入10-3mol/L的檸檬酸,蘋果酸。然后第二、三、四組再進行300 MPa,20 min超高壓處理。并分別對這四組黃酒和一年陳黃酒進行1H-NMR檢測,見圖7。由于黃酒成分復雜,所含微量成分整體效果是促進醇水間羥基質子的快速交換,使得黃酒的核磁氫譜圖只存在一個合并單峰。此單峰可以較好的反映黃酒的氫鍵締合強度,此結果與2.3.1研究一致。由圖7可見,空白對照組新酒中合并單峰的羥基質子位移δ為4.436。超高壓處理組δ為4.468。蘋果酸協同超高壓組和檸檬酸協同超高壓組δ值分別移動到4.474和4.502,而一年陳黃酒δ為4.477。超高壓處理組和有機酸協同超高壓組δ均向低場移動。檸檬酸協同超高壓處理新生黃酒氫鍵締合強度優于一年陳黃酒。由此可以認為檸檬酸協同超高壓處理新生黃酒能夠增強黃酒氫鍵締合,改善新酒刺激辛辣味,使口感更為圓潤柔和。
2.5 有機酸協同超高壓處理對黃酒主要理化性質及風味成分的影響
由表4可見,處理酒相比較于原酒,其酒精度、總酸、pH均呈現一定程度的降低。總酸降低可能是添加少量有機酸有利于酯化反應向正方向進行,且與超高壓的綜合作用結果使總酸降低。酒精度的變化可能是有機酸協同超高壓處理加強了游離乙醇分子與水的締合作用,使更多的游離乙醇分子受到束縛。處理后的黃酒符合國標《GB/T 13662-2008》中相關指標的規定。由表5可見,經處理后的新生黃酒,其醇類、醛類風味物質均有一定程度的降低,而揮發性酯類物質含量增加。原因可能是有機酸協同超高壓條件下,促進了酯化反應向正方向移動。處理酒的醇類和醛類降低,使新酒的醇醛辛辣刺激感降低。經檸檬酸協同超高壓處理的新生黃酒其醇、醛、酸、酯類風味成分的總量均接近于一年陳水平。
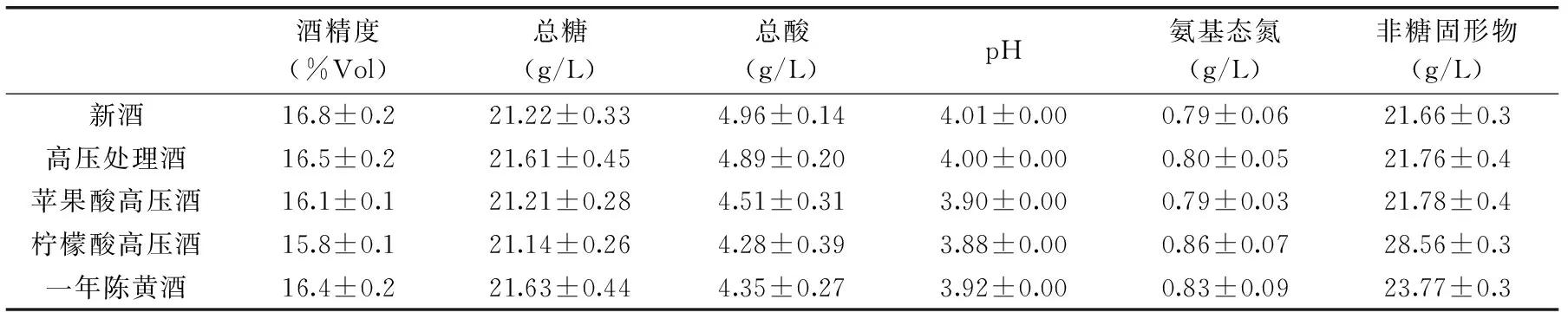
表4 不同條件處理對黃酒主要理化指標的影響

表5 不同條件處理對黃酒風味成分的影響
2.6 有機酸協同超高壓處理對黃酒感官品評的影響
由表6可見,有機酸協同超高壓處理新生黃酒,透明度增加,澀度、刺激度均一定程度的降低,口感更加柔和,酒體更加協同,且無異味產生。檸檬酸協同超高壓處理新生黃酒,感官品評得分略高于一年陳黃酒,這也與氫鍵締合、GC-MS分析結果相符。
3 結論
通過對0~1.0 mol/L乙醇濃度的乙醇水溶液的1H-NMR及粘度檢測,確定了適用于黃酒酒度范圍的醇水氫鍵締合強度指標:Δδ、η。相關實驗表明,Δδ和η越大,氫鍵締合強度越強。超高壓處理乙醇水體系,改變了體系的氫鍵締合強度。300 MPa,20 min超高壓處理下,乙醇水氫鍵締合增強最明顯,但壓力過大反而會破壞體系氫鍵。大多數的酸能促進醇水氫鍵締合強度,并且基于羧基(-COOH)對Δδ貢獻值約為0.123。當檸檬酸添加量為1×10-3mol/L時,由于體系快速的質子交換,一維核磁氫譜圖僅出現乙醇和水的羥基質子合并單峰,此單峰較好地反映體系的醇水氫鍵締合強度。氫鍵締合越強,單峰越向低場移動。檸檬酸協同超高壓處理黃酒氫鍵締合強度略高于一年陳黃酒,且其口感和風味均得到改善。由此認為,檸檬酸協同超高壓處理,可有效促進黃酒中醇水氫鍵締合,降低新酒刺激味。

