響應面優化谷氨酰胺轉氨酶改性大豆與啤酒糟混合蛋白工藝
宗緒巖,李 建,彭翠珍,李 麗,*
啤酒糟又稱為麥糟、麥芽糟,是啤酒釀造麥芽糖化的副產物,占啤酒工業總副產物的85%[1]。啤酒糟中含有麥芽的外殼和殘留的胚乳,富含纖維素、阿拉伯木聚糖、木質素和蛋白質,是一種低成本食品廢棄物,是良好的膳食纖維源和植物性蛋白質源[2],因此除了用于飼料生產[3]、食用菌培植[4]外,也被用于研發生產水解多肽、復合氨基酸[5]等蛋白制品及面包[6]、餅干等休閑食品。由于啤酒糟中蛋白質在麥芽汁制備過程中經過了高溫滅酶處理,蛋白質發生變性,特性也已經改變,限制了啤酒糟蛋白的利用。
目前,對植物蛋白的改性方法主要有化學改性[7]、物理改性[8]、酶法改性[9]等。酶法改性的方式有多種,通常包括催化蛋白質發生水解作用[10]、共價交聯作用、糖基化[11]以及磷酸化[12]等,從而改善蛋白質的溶解度及乳化性等功能特性。由于可控性強、條件溫和、耗能少、專一性強及副產物少,易于實現工業化生產,酶法改性成為近年來研究的熱點[13]。谷氨酰胺轉氨酶(transglutaminase,TGase)通過催化蛋白質或多肽中谷氨酰胺殘基的γ-羥胺基團與Lys上的ε-氨基之間形成共價鍵,增大蛋白質的分子質量,從而改善蛋白質的凝膠性、黏彈性、保水性等。胡小中等[14]研究表明對大豆分離蛋白改性時,TGase的使用使大豆蛋白的凝膠性及熱穩定性能得到顯著改善。朱小燕等[15]研究發現通過TGase改性的米渣蛋白持油性、體外消化率及流變性得到提升。由于啤酒糟中蛋白質主要來源于大麥[16],含有大量的谷氨酰胺,而大豆蛋白富含Lys,Lys和谷氨酰胺作為TGase的作用底物,若將啤酒糟蛋白和大豆蛋白混合進行TGase改性,不僅有助于改善蛋白的凝膠性能,平衡其人體必需氨基酸的組成,提高蛋白質營養價值,拓寬啤酒糟蛋白的利用價值和使用范圍。
本實驗采用濕磨法提取、富集啤酒糟蛋白,分析了其氨基酸組成,從而確立了TGase改性啤酒糟蛋白與大豆分離蛋白混合的實驗思路,并采用響應面分析法對改性加工條件進行優化,提高TGase生物改性效果,從而獲得凝膠性能良好的蛋白產品,研究結果為拓寬啤酒糟蛋白的應用范圍及其精深加工提供實驗參考。
1 材料與方法
1.1 材料與試劑
啤酒糟 華潤雪花啤酒(內江)有限責任公司;大豆分離蛋白(蛋白質質量分數>90%) 益海嘉里(秦皇島)蛋白工業有限公司;TGase(酶活力100 U/g)泰興市東圣食品有限公司;其他試劑均為分析純。
1.2 儀器與設備
多功能膠體磨 溫州昊星機械設備制造有限公司;粗(細)篩子、高效落地高速離心機 賽默飛世爾科技(中國)有限公司;H-spray Mini小型噴霧干燥儀北京霍爾斯生物科技有限責任公司;L-8800全自動氨基酸分析儀 日本Hitachi公司;TA.XT Plus物性測定儀 英國Stable Mciro System公司;Kjeltec 2200凱氏定氮儀 瑞典FOSS公司。
1.3 方法
1.3.1 啤酒糟蛋白的制備工藝流程[17]
啤酒糟→濕法粉碎→篩分→濾漿→離心→去上清液→復溶沉淀→噴霧干燥→保存備用
噴霧干燥條件:進風溫度165 ℃,進風量700 L/h,物料質量分數12%,進料流量0.4 L/h。
1.3.2 凱氏定氮法測定啤酒糟蛋白含量[18]
稱取1 g(精確至0.001 g)啤酒糟蛋白樣品于消化管中,加入12 mL濃硫酸及7.8 g混合催化劑(硫酸鉀-硫酸銅質量比7∶0.8),放入消化爐中,220 ℃消化0.5 h,420 ℃消化1.5 h后取出冷卻至室溫,上機測定蛋白含量。取蛋白質換算系數為6.25。
1.3.3 啤酒糟蛋白氨基酸組成測定
取3 mL樣品溶液(質量濃度1 mg/mL)于安瓿瓶中,加入6 mol/L鹽酸溶液10 mL,滴入幾滴苯酚,充入氮氣1 min以排出其中的空氣,酒精噴燈,熔化封瓶。將密封樣品在110 ℃條件下徹底水解22 h后,冷藏保存。取出冷卻至室溫。敲瓶,轉移至100 mL容量瓶,過濾后取200 μL,與真空干燥箱中減壓干燥。加入1 mL的pH 2.2檸檬酸鈉上機緩沖溶液稀釋,振蕩,取20 μL上樣。用全自動高速氨基酸分析儀進行分析,采用柱后茚三酮法測定樣品中的各種氨基酸含量。
分析條件:柱溫57 ℃;色譜柱日立#26225C型;流動相流速1 mL/min;反應柱溫135 ℃。
1.3.4 TGase改性混合蛋白工藝
參考文獻[19],并稍作修改。恒定溶液蛋白質量分數為15%,配制不同添加量的啤酒糟蛋白與大豆蛋白混合溶液,在室溫條件下攪拌均勻,用1 mol/L的NaOH(或HCl)溶液調節反應體系pH值為所需值,添加TGase,在所需溫度水浴反應一段時間后,于90 ℃水浴加熱40 min,將制得的樣品放入冰水浴中迅速冷卻,并置于4 ℃冰箱中過夜,用于凝膠強度的測定。
1.3.5 凝膠強度測定
采用質構儀穿刺實驗法[20]。穿刺實驗操作條件:P 0.5探頭,測試前速率5.0 mm/s,測試速率2.0 mm/s,測試后速率10.0 mm/s,出發力10 g,下壓凝膠5 mm所需力為凝膠強度[21]。
1.3.6 單因素試驗
以混合蛋白凝膠強度為指標,分別考察啤酒糟蛋白添加量(10%、20%、30%、40%、50%)、加酶量(5、10、15、20、25 U/g)、水浴溫度(20、30、40、50、60 ℃)、水浴時間(60、90、120、150、180 min)、初始pH值(5、6、7、8、9)對混合蛋白凝膠性質的影響。單因素試驗基本條件為啤酒糟蛋白添加量30%、加酶量15 U/g、水浴溫度50 ℃、反應時間2 h、反應pH 7.0。
1.3.7 響應面試驗
在單因素試驗的基礎上,利用Design-Expert 8.0軟件進行響應面優化設計,以混合蛋白凝膠強度為響應值,以啤酒糟蛋白添加量、水浴溫度、水浴時間為因變量,設計3因素5水平的二次回歸正交旋轉組合分析試驗,試驗重復6 次,共20 個試驗點,試驗因素與水平如表1所示。
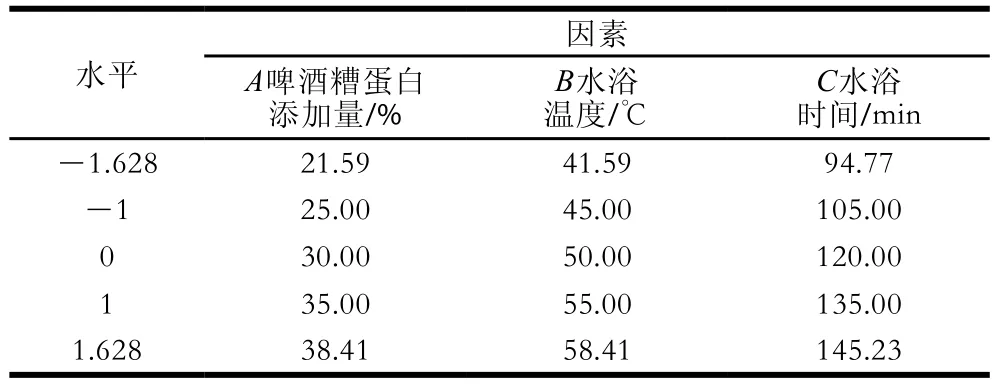
表1 二次回歸正交旋轉組合設計因素與水平Table 1 Factors and levels used in quadratic regression orthogonal rotation design
2 結果與分析
2.1 啤酒糟提取物蛋白質含量及氨基酸組成分析
采用凱氏定氮法,重復測定3 次后取平均值,測得蛋白質質量分數為52.23%。在1.3.3節色譜條件下,取標準混合液和樣品溶液各20 μL進樣分析,測定峰面積值,同時對樣品進行3 次平行測定。啤酒糟蛋白氨基酸組成如表2所示。
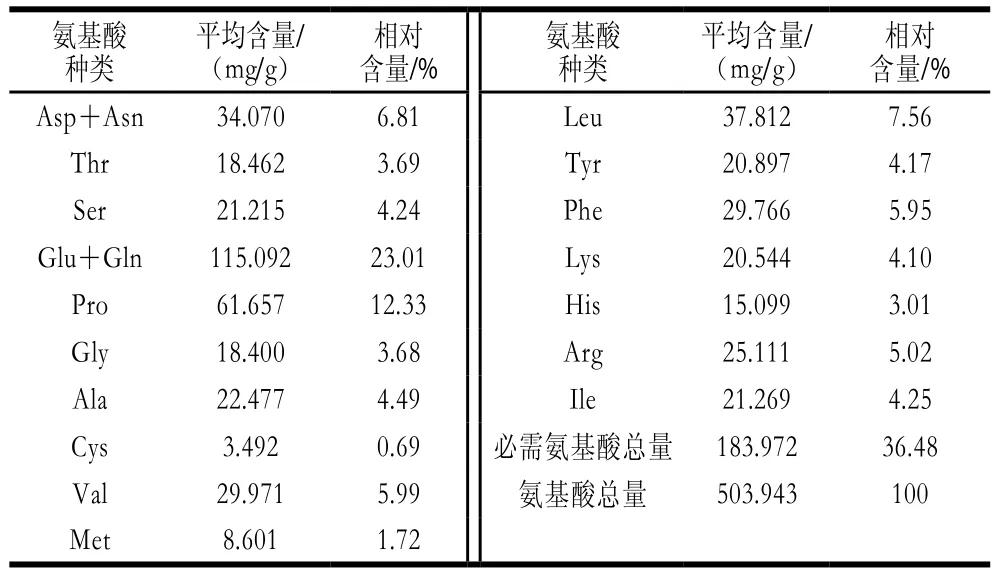
表2 啤酒糟蛋白的氨基酸組成(n=3)Table 2 Amino acid composition of BSG protein (n = 3)
由表2可知,啤酒糟蛋白樣品中共檢測到17 種氨基酸,氨基酸總量為503.943 mg/g,其中人體必需氨基酸(除Try外)含量為183.972 mg/g,占總氨基酸含量的36.48%,而含量最高的是Glu+Gln(23.01%),其次是Pro(12.33%)。谷物蛋白中的第1限制氨基酸[22]Lys相對含量較低,僅4.1%。實驗結果表明,啤酒糟蛋白中含有大量的Glu,但Lys含量較低,因此考慮添加富含Lys的大豆蛋白配合TGase改性啤酒糟蛋白,一方面可以為酶交聯反應提供更多的催化位點,提高催化效率,另一方面,可以優化蛋白質中氨基酸配比。
2.2 單因素試驗結果
2.2.1 啤酒糟蛋白添加量對混合蛋白凝膠性能的影響
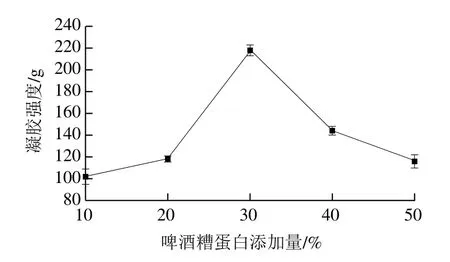
圖1 啤酒糟蛋白添加量對混合蛋白凝膠強度的影響Fig. 1 Effect of proportion of BSG protein on gel strength of TGase-treated mixed proteins
如圖1所示,當啤酒糟蛋白添加量較低時,隨著添加量的增加,混合蛋白的凝膠強度也增加。當添加量超過30%時,凝膠強度隨添加量的升高而下降。這可能是因為隨著添加量的增加,體系中的非蛋白類物質增多,從而使得凝膠強度反而下降。因此,啤酒糟蛋白添加量為30%為宜。
2.2.2 水浴溫度對混合蛋白凝膠性能的影響
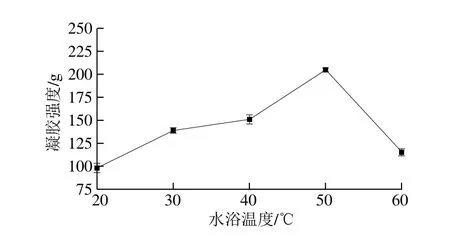
圖2 水浴溫度對混合蛋白凝膠強度的影響Fig. 2 Effect of bath temperature on gel strength of TGase-treated mixed proteins
如圖2所示,當水浴溫度在20~50 ℃時,混合蛋白的凝膠強度隨水浴溫度的升高呈增長趨勢,當水浴溫度超過50 ℃時,混合蛋白的凝膠強度急劇下降。溫度的升高可以提高酶的活性,且隨溫度的升高,布朗運動速率增加,分子相互碰撞的機會增加,酶催化效率增大[23],故混合蛋白的凝膠強度呈現出逐漸增加的趨勢。當溫度繼續升高,超過了酶的最適宜溫度時,酶逐漸失活,導致凝膠強度下降[24]。唐傳核等[25]在研究中發現,TGase在60 ℃時幾乎完全失活。本實驗與上述結論基本相符,選擇水浴溫度為50 ℃。
2.2.3 水浴時間對混合蛋白凝膠性能的影響
如圖3所示,隨著水浴時間的延長,混合蛋白的凝膠強度先上升后降低,在120 min時達到最大值。反應時間是影響酶促反應的重要因素[26],隨著反應時間的延長,TGase催化反應趨于完全,并且有一定的水分析出,而維持蛋白質凝膠網絡穩定性所需要的共價鍵數目具有一定的飽和性[27],因而反應時間過長反而使得凝膠強度降低。因此,選擇水浴時間為120 min為宜。

圖3 水浴時間對混合蛋白凝膠強度的影響Fig. 3 Effect of heating time on gel strength of TGase-treated mixed proteins
2.2.4 初始pH值對混合蛋白凝膠性能的影響
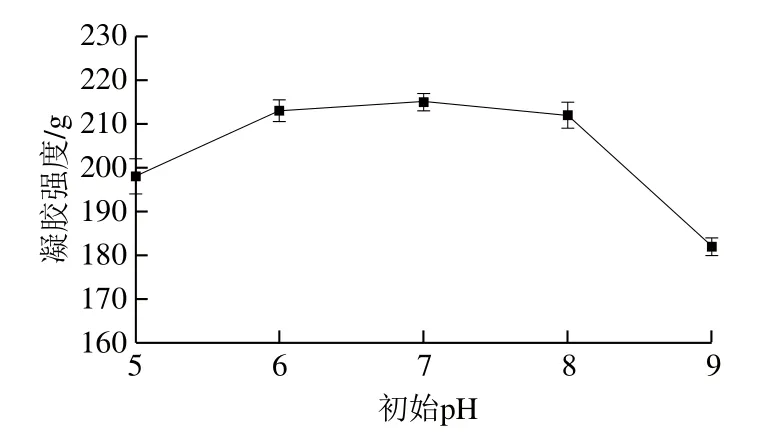
圖4 初始pH值對混合蛋白凝膠強度的影響Fig. 4 Effect of initial pH on gel strength of TGase-treated mixed proteins
如圖4可知,隨著初始pH值的升高,混合蛋白的凝膠強度呈現出先上升后下降的趨勢,在pH 6~8時TGase均表現出較好的催化效果。當pH值大于8時,混合蛋白的凝膠強度開始下降,這可能是因為過高的pH值使得TGase發生空間構象的改變而部分失活所致[28]。因此,選擇反應初始pH值為7。
2.2.5 加酶量對混合蛋白凝膠性能的影響
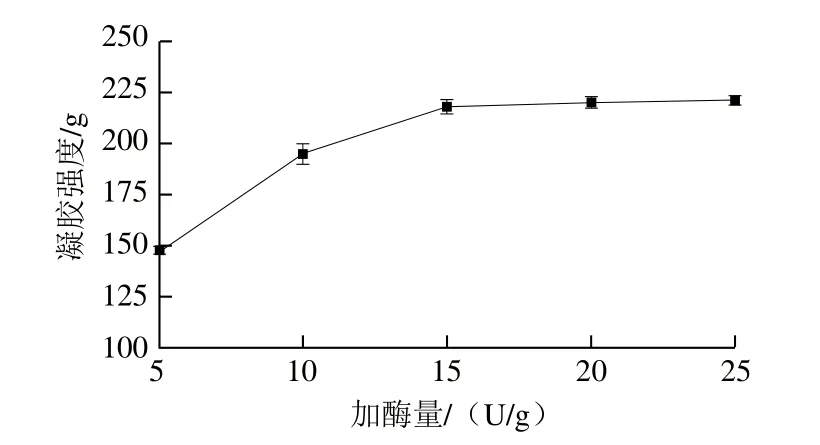
圖5 加酶量對混合蛋白凝膠強度的影響Fig. 5 Effect of TGase dosage on gel strength of TGase-treated mixed proteins
如圖5所示,隨著TGase添加量的增多,混合蛋白的凝膠強度也隨之呈先上升后平穩的趨勢。江波等[29]指出,由于TGase體系中可能存在水解酶,添加量過高反而會影響凝膠的形成。因此,選擇加酶量為15 U/g為宜。
2.3 響應面試驗結果
利用Design-Expert 8.0軟件的中心組合設計,以啤酒糟蛋白添加量、水浴時間、水浴溫度為響應變量,混合蛋白凝膠強度為響應值,進行響應面試驗,結果如表3所示,對表3數據進行回歸分析和響應面分析,回歸分析結果如表4所示,響應面和等高線如圖6所示。得到以混合蛋白凝膠強度為響應值的回歸方程為:凝膠強度=214.46+8.82A-12.16B+8.11C+12.25AB-9.5AC-3.25BC-26.52A2-22.81B2-6.19C2。

表3 中心組合試驗方案及結果Table 3 Central composite design with response variable

表4 回歸方程方差分析Table 4 Analysis of variances for the developed regression equation
由表4可知,模型的F值為32.6,P值小于0.000 1,表明該模型達到了極顯著水平;失擬項差異不顯著(P=0.392 6>0.05),這表明模型無失擬因素存在,能較好地反映實際情況;試驗模型的決定系數R2值為0.967 0,說明混合蛋白凝膠強度的檢測結果與模型預測結果有著良好的一致性,試驗模型的校正系數R2Adj值為0.937 4,這表明試驗結果有93.74%受所選試驗因素的影響。因此,該模型可以較好地對混合蛋白凝膠強度進行分析和預測。各因素對混合蛋白凝膠強度影響的大小順序為B>A>C,即水浴溫度對混合蛋白的凝膠強度的影響最大,其次是啤酒糟蛋白添加量,最后是水浴時間。由回歸方程和方差分析可知,模型中一次項A、B、C對混合蛋白凝膠強度的影響達到極顯著水平(P<0.01);模型中交互項AB對混合蛋白凝膠強度的影響達到極顯著水平(P<0.01),AC對混合蛋白凝膠強度的影響達到顯著水平(P<0.05);模型中二次項A2、B2對混合蛋白凝膠強度的影響達到極顯著水平(P<0.01),C2對混合蛋白凝膠強度的影響達到顯著水平(P<0.05)。
2.4 響應面分析及模型驗證實驗結果
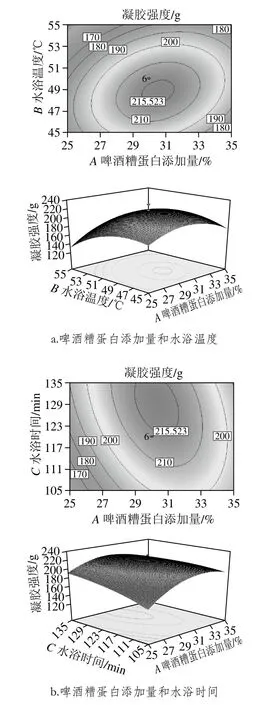
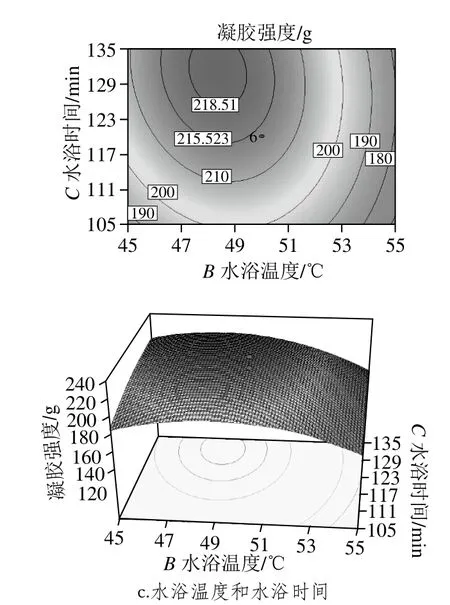
圖6 各因素交互作用的響應面Fig. 6 Response surface plots showing the interactive effects of various factors on gel strength of modified proteins
響應面圖是回歸方程的形象描述,能夠直觀反映各個因素與響應值之間的關系以及兩因素間交互作用的類型[30-31]。響應面圖的等高線呈橢圓形、密集、曲面坡度陡峭則表示兩因素交互影響大,而等高線呈圓形、稀疏、曲面坡度平緩則與之相反[32]。由圖6可知,啤酒糟蛋白添加量與水浴溫度、水浴時間等高線為橢圓形,這表明啤酒糟蛋白添加量與水浴溫度、水浴時間對混合蛋白凝膠強度的影響交互作用顯著。而水浴時間與水浴溫度等高線雖為橢圓形,但較接近圓形,這表明兩者間有一定的交互作用,但交互效應較弱;觀察沿坐標軸方向等高線疏密情況可知,在兩兩交互作用中,對于混合蛋白凝膠強度的影響:水浴溫度>啤酒糟蛋白添加量>水浴時間,這與表4方差分析結果一致。
利用Design-Expert 8.0軟件進行反應條件進行優化組合,得到TGase改性大豆與啤酒糟混合蛋白的最佳工藝條件為啤酒糟蛋白添加量29.72%、水浴溫度48.26 ℃、水浴時間131.84 min,此時酶改性所得混合蛋白的凝膠強度最高,達到219.611 g。考慮到實際情況,將最佳處理條件修改為啤酒糟蛋白添加量30%、水浴溫度48 ℃、水浴時間132 min,在此優化條件下進行3 次驗證實驗。驗證實驗平均值為218.55 g,與預測值總體吻合,說明采用響應面優化TGase改性混合蛋白的處理條件是可行的,所得優化工藝條件較可靠。
3 結 論
以啤酒糟為原料,通過濕磨法對其中蛋白質進行提取富集,并分析了所得蛋白質的氨基酸組成,確立了TGase對啤酒糟蛋白與大豆蛋白混合改性的實驗思路。在單因素試驗的基礎上,選擇啤酒糟蛋白添加量、水浴溫度、水浴時間進行中心組合試驗設計,使用Design-Expert 8.0軟件進行數據擬合,得到TGase改性最佳處理條件為啤酒糟蛋白添加量30%、加酶量15 U/g、反應pH 7、水浴溫度48 ℃、水浴時間132 min,在此處理條件下,所得改性后蛋白質的凝膠強度為218.55 g。通過驗證實驗所得實際值與模型預測值接近,證明應用響應面法優化TGase改性啤酒糟蛋白與大豆蛋白混合是準確可行的,對于拓寬啤酒糟蛋白的適用范圍具有重要意義。

