生物反應器模擬生活垃圾填埋降解產甲烷性能
曾韻敏,王里奧,胥騰屯,宋 雪,胡超超,李 彤
?
生物反應器模擬生活垃圾填埋降解產甲烷性能
曾韻敏1,2,王里奧1,2※,胥騰屯2,宋 雪2,胡超超2,李 彤2
(1. 重慶大學煤礦災害動力學與控制國家重點實驗室,重慶 400044; 2. 重慶大學資源及環境科學學院,重慶 400044)
該文采用生物反應器模擬生活垃圾填埋降解過程,跟蹤測試了垃圾在厭氧消化過程中產甲烷進程及滲濾液特性,并探索兩者之間的關系,旨在篩選出可以預測垃圾厭氧消化產甲烷進程的指標。結果表明滲濾液pH值、TOC/TN (total organic carbon/total nitrogen)、乙酸/戊酸(HAc/HVa)的變化對系統產甲烷進程及穩定性有一定的指示作用。消化系統產甲烷初期,滲濾液pH值穩定在5.77~5.91。產甲烷高峰期,滲濾液pH值會迅速升高達到峰值。滲濾液中TOC/TN≥11時,垃圾厭氧發酵系統穩定,產甲烷正常。而當滲濾液中TOC/TN<11時,發酵系統因氨積累失穩,產氣量小。戊酸在垃圾厭氧消化過程中生成與轉化較為活躍,HAc/HVa變化較大且有明顯的拐點,拐點處可預測消化系統進入產甲烷期。此外,采用16S rRNA基因標記技術對反應器中3個階段的垃圾滲濾液樣品(水解酸化期A、產甲烷高峰期B、產甲烷末期C)以及試驗結束時垃圾樣品和覆蓋土樣品進行群落評估。聚類樹分析得出生活垃圾(municipal solid wastes,MSW)樣品與滲濾液樣品其微生物種類及豐度都較為接近,有較近的親緣關系,且反應期越長相似度越高。測定滲濾液樣品的微生物群落組成可一定程度反映出系統內垃圾的群落結構。覆蓋層是系統進行硝化反應的主要場所。垃圾厭氧消化末期,系統中氨積累抑制產甲烷菌活性,是導致系統產甲烷能力下降的主要原因。
垃圾;甲烷;降解;生物反應器填埋場;厭氧消化;滲濾液;微生物群落
0 引 言
城市生活垃圾中含有較多的有機組分,具有潛在的能源價值[1-3],厭氧消化是一種常用的處理生活垃圾以及實現能源回收的生物處理技術[4]。生物反應器填埋場技術通常采用滲濾液回灌[5-8]、營養添加、pH值調節、溫度調節、供氧[9]和微生物接種等手段強化厭氧消化中微生物過程,從而加速垃圾中易降解、中等易降解有機組分轉化和穩定[10]。厭氧消化是一系列復雜的微生物催化降解過程,為保障生物反應器系統穩定運行,提升廢物處理效率及資源化水平,理想條件是對系統進行在線監測、實時調節。由于垃圾自身性質不均勻、監測點布設成本較高以及取樣困難代表性不足等原因,針對填埋場垃圾體的在線監測較難實施。滲濾液為垃圾厭氧消化的產物,滲濾液的性質和體積是評估垃圾填埋層穩定化的最重要的信息[11]。通過對滲濾液中垃圾代謝產物濃度的測定預測和評估垃圾的厭氧消化過程可能是一種更為經濟可行的方法。Arjun[12]指出滲濾液中的COD、揮發性脂肪酸(volatile fatty acid, VFA)濃度隨著填埋垃圾穩定過程而變化。Moletta等[13]開發厭氧流化床生物反應器自動控制系統,選用了液相pH值、產甲烷濃度和氫氣濃度作為反應器控制參數。Ahring[14]等研究了在以糞便為基質的生物反應器厭氧消化過程中,沼液中VFA作為工藝指標使用的合理性。陳琳等[15]研究蔬菜廢棄物厭氧發酵過程,沼液中揮發性脂肪酸濃度可作為系統酸化失穩預警指標,丙酸、正/異丁酸、正/異戊酸出現突變時,發酵系統出現酸化征兆。有機垃圾在消化進程中發生生物降解,系統中微生物群落結構會發生明顯變化,微生物群落結構與垃圾的消化過程密切相關,群落多樣性可以體現微生物群落結構穩定性[16]。測定滲濾液及垃圾的群落組成,有助于進一步了解垃圾的降解狀況,分析抑制系統產甲烷進程的不利因素。
本試驗跟蹤測定了垃圾生物反應器中溫消化過程中產甲烷進程、滲濾液特性(pH值、TOC、TN、VFA)和微生物群落結構,并對各指標的變化規律及相關性進行了分析,提出了可以預測垃圾厭氧消化產甲烷進程的指標,分析影響垃圾厭氧消化產甲烷的原因,為垃圾厭氧消化系統工藝參數的實時調節提供支撐,保障生物反應器填埋場高效運行。
1 材料與方法
1.1 生活垃圾、覆蓋土的來源與性質
垃圾取自重慶市沙坪壩區城市生活垃圾轉運站,按照《生活垃圾采樣和分析方法》(CJJ134-2009)中規定的方法將垃圾進行分類,垃圾組分分析數據見表1。中間覆蓋層土壤取自重慶大學校園內為建筑棄土。土壤經自然風干后過20目篩,挑除石塊、植物根莖、植物殘體。試驗裝填垃圾、覆蓋土壤詳細物化參數見表2。

表1 試驗垃圾組成成分 Table 1 Composition of municipal solid wastes(MSW) %

表2 垃圾和土壤的理化參數Table 2 Materialized parameters of MSW and soil
1.2 試驗裝置及步驟
試驗裝置示意圖如圖1所示,反應器采用內徑為30 cm,中間筒體高度60 cm圓柱形不銹鋼罐體。反應器膛中設1個氣體收集井,中間預埋管徑6 cm的穿孔塑料花管。柱體底部為圓錐形,設有滲濾液收集管和閥門。排氣閥出口用橡膠管接一個濕式氣體流量計,流量計后接氣體收集袋。柱體側壁設置溫度傳感器和3個觀察取樣口。裝置內部有溫度探頭,可測定裝置內垃圾溫度。試驗裝置表面覆有電加熱帶及保溫材料,溫度探頭連接溫控儀,溫控儀控制加熱帶加熱,調節罐體內垃圾溫度。

1.安全閥 2.法蘭盤 3.觀察窗 4.花管 5.土壤 6.垃圾 7.壓力表 8.流量計 9.閥門 10.集氣袋
將垃圾樣品進行人工分選,破碎成2~5 cm。破碎后垃圾樣品充分混合分層填裝。反應器底部的錐形收集結構中放置一層12 cm厚的粗顆粒卵石,形成自由排水條件,在卵石層上面放置穿孔金屬板,以防止因細小固體垃圾顆粒運動而造成滲濾液收集管的堵塞。固體廢物以19 cm分層并壓實,其中垃圾層厚度17 cm,垃圾裝填密度為800 kg/m3,覆蓋層厚度為2 cm。垃圾與覆蓋層交互裝填共3層。垃圾裝填完畢后加蓋密封。試驗于2016年10月17日進行垃圾裝填。在試驗期間,溫控儀設置為35 ℃,控制反應器內部垃圾溫度為(35±2)℃。
1.3 分析方法
垃圾揮發性固體的質量分數采用灼燒法。C,H,N,S的質量分數采用Vario Macro元素分析儀測定。產氣量和氣體成分(甲烷、二氧化碳)由濕式流量計和福立FL9510氣相色譜儀監測,色譜柱為填充柱,固定相porapakQ 2 m× 3 mm,TCD檢測器,載氣為 He氣。滲濾液pH 值用METTLER TOLEDO 型pH計測定。揮發性脂肪酸采用 Agilent GC-2010PLUSAF 230V氣相色譜測定,主要分析乙酸,丙酸,正丁酸和正戊酸濃度,色譜柱:DB-FFAP 30 m× 0.25 mm,膜厚0.25m,FID檢測器,載氣為N2,進樣口溫度為250 ℃,柱箱溫度230 ℃。分流比為10.8,進樣量2L。滲濾液TOC采用島津 TOC-LCPH型總有機碳分析儀測定、TN采用島津TNM-L型總氮分析儀測定。
1.4 微生物群落分析
收集反應器中的滲濾液,樣本被固定在0.2m的過濾器上,DNA提取按照試劑盒中說明書要求進行操作,采用Genemark土壤基因DNA提取試劑盒。DNA濃度由超微量紫外分光光度計(德國Implen Nanophotometer N60)測定,提取液裝入1.5 mL離心管密封?20 ℃冷凍保存。利用高通量測序技術對土壤微生物進行DNA測序,測序工作委托上海美吉生物醫藥科技有限公司完成,引物信息為ArBa515F(5'-GTGCCAGCMGCCGCGGTAA-3')和Arch806R(5'-GGACTACVSGGGTATCTAAT-3')。測試完成后,使用I-Sanger生物信息云平臺進行測序結果分析。
1.5 計算方法
應用Scholl Canyon一階動力學模型對試驗的產氣速率進行擬合。得到垃圾產氣速率與時間關系的定量數學表達式。Scholl Canyon模型產氣速率表達式如下
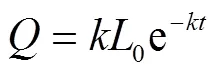
式中為反應器產氣速率,mL/d;為產氣速率常數,d-1;0為同一時間裝填垃圾的潛在產氣總量,mL/kg;為垃圾裝填后的時間,d。
2 結果與分析
2.1 垃圾產氣速率及其模型構建
垃圾裝填后第3天,反應器開始產氣,并且在7 d后產氣速率達到最大。該階段主要由于垃圾孔隙中空氣因擠壓釋放以及垃圾中易腐組分耗氧分解。氣體主要成分為N2,并且伴隨有O2濃度降低,CO2濃度升高,無甲烷產生。隨后5個月,垃圾產氣速率逐漸降低。垃圾產氣主要集中在前100天,該階段主要為易生物降解的有機垃圾兼性厭氧發酵期和厭氧產甲烷期。150 d后,出現一個小的產氣高峰。該階段延續前一階段水解產物進一步消化。230 d后,試驗完成階段性產氣,生活垃圾中易腐易降解的組分(主要為廚余和果蔬類)已完成降解,系統進入對較難降解垃圾的厭氧發酵期,產氣量小。該階段垃圾累積產氣量為1 850.38 L。
對垃圾裝填后250 d其產氣速率進行監測,試驗數據通過方程式(1)進行指數回歸擬合,擬合結果見圖2。圖2可以看出,生活垃圾厭氧消化產氣速率符合指數衰減規律,實測值與擬合曲線基本相符,擬合度較好,相關系數為0.78,說明Scholl Canyon模型對填埋場中易降解垃圾消化產氣階段產氣速率與時間關系進行預測是合理的。擬合參數可以看出,垃圾產氣速率常數為0.0149 d?1,垃圾產氣潛能0為66.36 L/kg。焦學軍等[17]研究得出,整個填埋產氣年限內垃圾產氣量為96.31 L/kg。
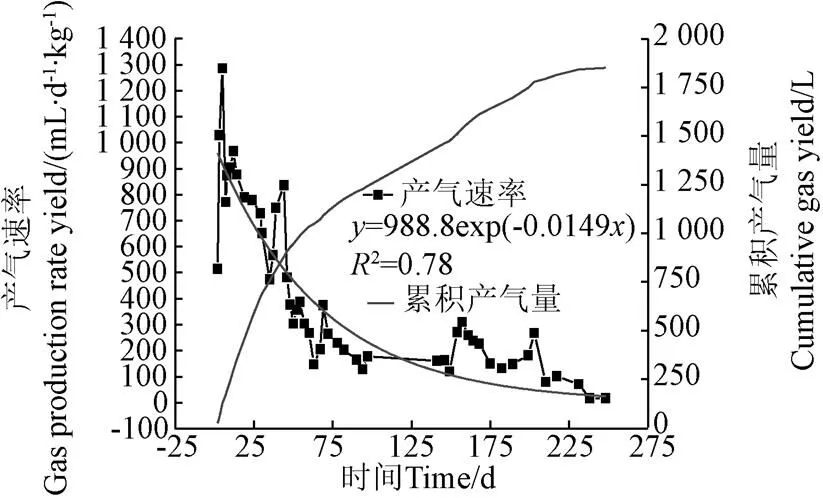
圖2 垃圾產氣變化趨勢圖
2.2 生活垃圾填埋降解過程pH值變化
垃圾降解過程,滲濾液中化學成分和濃度隨時間動態變化,CH4產率一定程度反映產甲烷菌的活性[18]。圖3為反應器內滲濾液pH值和甲烷產率隨時間的變化規律。試驗期間滲濾液pH值變化規律先降低后升高,然后降低,在穩定產甲烷期pH值達到最高為6.63。在進行滲濾液回灌的厭氧消化生物反應器內觀測到了相同的趨勢[19]。由圖3可以看出,前50天,滲濾液pH值迅速下降,pH值從6.46下降到5.92。反應初期垃圾以水解酸化反應為主[20],滲濾液中有機酸不斷積累,pH值降低[21]。從第50天到第80天,該階段系統開始產CH4,該階段主要為產甲烷菌的產生、馴化以及富集階段。隨后至第175天滲濾液pH值變化不大,其變化范圍為5.77~5.91。垃圾水解的中間產物被微生物利用進行細胞增殖以及向甲烷轉化,避免了系統持續酸化,使得pH值相對穩定。反應器在運行150 d后系統產甲烷速率迅速升高并維持在較高水平,之后25 d,滲濾液pH值也顯著升高,原因隨著垃圾產甲烷過程的進行及強化,水解酸化階段產生的有機酸被消耗轉化為CH4。在第200天以后,滲濾液pH值和甲烷產率在到達高峰后又開始下降,且該階段沼氣產量也下降,垃圾消化進入產甲烷后期。該階段由于反應器內代謝毒素的積累,抑制甲烷菌活性,使得系統產甲烷能力下降。此外,水解產酸菌對毒素的耐受能力較強,垃圾中難降解的物質持續發酵水解,使產生的有機酸積累,導致滲濾液pH值下降。綜上所述,生活垃圾厭氧消化進程中,系統滲濾液pH值的變化與甲烷產率有相似的趨勢,可一定程度輔助預測垃圾的產甲烷進程。在垃圾發酵進行到第50 天時,滲濾液pH值由快速下降期過渡到平緩期。隨后從第50 天至第150 天,pH值穩定在5.8左右,系統甲烷產率逐漸升高至58 mL/(kg·d),該階段對應垃圾降解產甲烷初期;從第175天至第200天,pH值顯著升高且系統甲烷產率維持在100 mL/(kg·d)以上,該階段為垃圾降解穩定產甲烷期;第200 天以后,pH值在到達峰值后持續降低,且當pH值小于5.8(230 d后),系統甲烷產率低于30 mL/(kg·d)進入產甲烷末期。
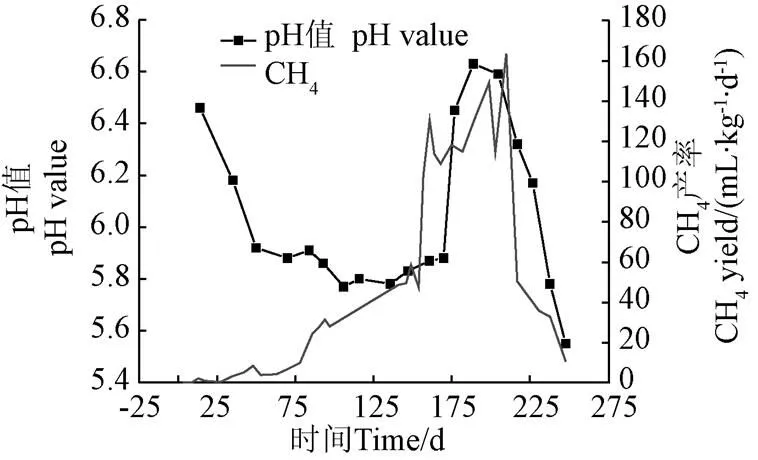
圖3 pH值變化趨勢圖
2.3 生活垃圾填埋降解過程滲濾液TOC和TN的變化
圖4a為滲濾液TOC、TN變化規律。試驗期間TOC濃度出現2次顯著升高。第1次高峰出現在反應進行90 d,TOC質量濃度為41 150 mg/L,由易水解的糖類物質分解所致。由于微生物菌群的生長及產甲烷過程的進行,垃圾水解的可生物利用的中間產物被消耗,滲濾液中累積的TOC濃度緩慢降低。第2次TOC濃度顯著升高發生在第120 天以后,可能是由難水解的蛋白類及纖維素等物質降解產生的。全過程TOC質量濃度范圍在26 695~41 355 mg/L。TN質量濃度隨時間波動增加,其范圍在1 489~3 106 mg/L。滲濾液中氮主要來源于垃圾中蛋白類物質分解轉化[22]。TN和TOC均在第175天時出現峰值,印證了該階段主要為蛋白類物質的水解。
圖4b為滲濾液TOC/TN變化趨勢圖。滲濾液TOC/TN在整個反應期內呈先增大后波動下降的趨勢,反應初期(第14天到第100天)TOC/TN值從16.76升高到21.79。糖類物質水解速率大于蛋白類物質,滲濾液中TOC釋放速率大于TN,且隨著生物反應進行,微生物調整期后優勢菌群會進行大量增殖,從而消耗掉垃圾中的部分可利用的氮素,使得滲濾液中TOC/TN升高。隨著系統產甲烷速率升高TOC/TN值下降,從第100天至第230天,TOC/TN值在11~17范圍內波動,產甲烷菌消耗TOC,同時該階段伴隨有蛋白類物質的水解,會有較多氮素進入滲濾液中,雙重作用使得TOC/TN值降低。第230天后滲濾液中TOC/TN低于11,該階段氮素持續積累,環境惡化,微生物活性降低。曾經對多個填埋場以及垃圾焚燒廠滲濾液中氨氮和總氮濃度進行測定,實測數據得出,滲濾液中氨氮與總氮呈正相關,滲濾液中總氮主要以氨氮的形式存在,氨氮濃度占總氮質量分數的85%~90%。此外,Kjeldsen[23]研究指出在較長的產甲烷期內,滲濾液中氨的濃度并沒有下降,氨是滲濾液中的主要長期污染物。厭氧消化系統對氨氮敏感,高濃度氨氮對產甲烷菌有毒害作用[24-25]。滲濾液中TOC/TN對生物質降解產甲烷系統反應期具有一定的指示作用。當滲濾液中TOC/TN≥11時,厭氧發酵系統穩定,正常產氣。而當滲濾液中TOC/TN<11時,系統內因NH3產生過多使得微生物出現“氨中毒”,抑制底物厭氧消化速率,導致發酵系統失穩[26]。
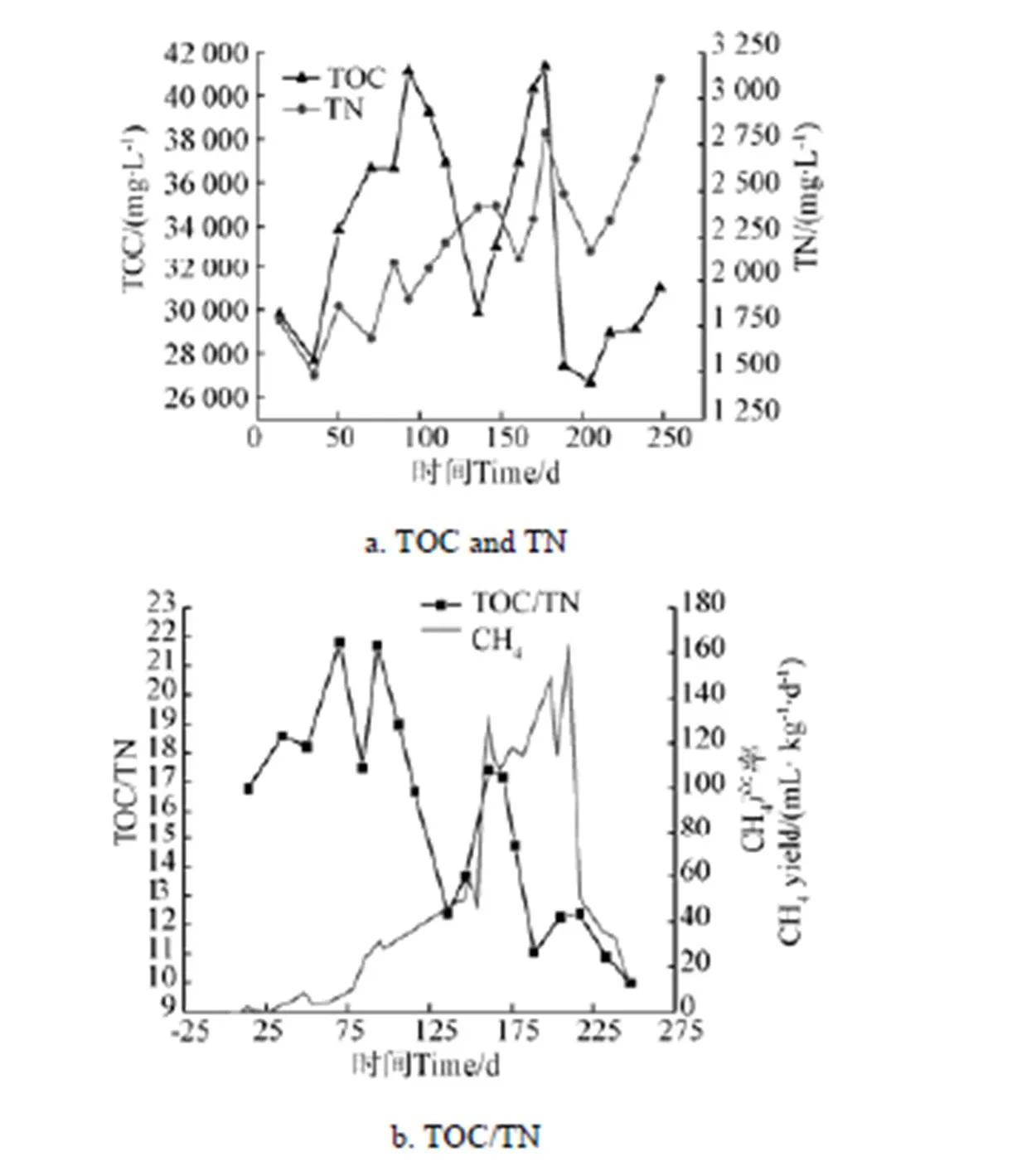
圖4 TOC和TN變化規律
2.4 生活垃圾填埋降解過程揮發性脂肪酸的變化
VFA厭氧消化過程中重要的中間代謝產物,VFA的濃度可反映系統內底物的水解酸化程度和產甲烷效率[27]。厭氧消化產沼氣系統中,能被產甲烷菌直接利用的中間產物為甲酸、甲醇和乙酸以及H2、CO,其他長鏈脂肪酸積累會導致系統酸化,對產甲烷進程不利。Yeole[28]研究得出丙酸濃度對產甲烷菌生長有顯著的抑制作用。試驗監測了垃圾消化系統滲濾液中乙酸(HAc)、丙酸(HPr)、丁酸(HBu)、戊酸(HVa)的含量。為消除進樣誤差,圖5為系統產甲烷產率與乙酸/丙酸、乙酸/丁酸、乙酸/戊酸的變化規律。由圖 5可知,在反應內期僅HAc/HBu<1,HAc/HPr與HAc/HVa均大于1,且HAc/HVa>HAc/HPr,說明系統中滲濾液各有機酸濃度為HBu>HAc>HPr>HVa。反應進行84 d時,HAc/HVa迅速降低,從7.94下降至2.49。而其它兩組比值均無明顯變化,在水解酸化期戊酸生成相對增幅最大。從圖5可看出70 d后HAc/HBu、HAc/HPr、HAc/HVa均升高,而系統也開始產甲烷,說明該階段丙酸、丁酸、戊酸的轉化降解速率大于產甲烷菌降解乙酸的速率,它們也可能通過不同的代謝途徑轉化為乙酸,從而補償部分乙酸的消耗。從比值增長趨勢可以推測出,3種脂肪酸降解的難易程度:戊酸>丙酸>丁酸。在整個試驗期內HAc/HBu、HAc/HPr總體變化趨勢較小,不能很好的反映出系統的消化進程。HAc/HVa變化較大且有明顯的拐點(第84天),該點對應的甲烷產率為25 mL/(kg·d),處于產甲烷初期。

圖5 VFAs變化趨勢圖
2.5 生活垃圾填埋降解過程微生物群落與種群的變化
采用16S rRNA基因標記技術對反應器中3個階段的垃圾滲濾液樣品,(水解酸化期A、產甲烷高峰期B、產甲烷末期C)以及試驗結束時垃圾樣品(MSW)和覆蓋土樣品(cover)進行微生物群落測定。其中,滲濾液樣品A、B、C取樣時間分別為反應進行后第50天、190天和250天。MSW樣品和cover樣品取樣時間為第250天。每個樣品取樣3個。圖6為微生物種群Heatmap圖,顯示了在門水平下各樣品總豐度前50的微生物種群,數值為對應物種的OTU值,頂部為樣本聚類樹。
聚類樹分析可看出MSW樣品與滲濾液樣品有較近的親緣關系,且反應期越長、相似度越高。滲濾液樣品微生物種類及豐度都較為接近。測定滲濾液樣品的群落組成可一定程度反映出系統內垃圾的群落結構,可用于垃圾消化進程的預測。
垃圾消化過程重點關注產酸菌、產甲烷菌和硝化細菌。從圖6可看出,厚壁菌門()占到樣品中總OTUs (operational taxonomic units)的45.7%~96.2%。其中主要為梭狀芽孢桿菌。Kim等[29]從廢水處理廠分離出,研究得出其為產酸菌,可利用半乳糖為碳源,厭氧發酵代謝終產物有H2、CO2、乙醇、乙酸、丁酸和己酸[30]。說明發酵系統產氫、產酸過程穩定,該階段不是整個消化過程的限制步驟。此外,即使在產甲烷末期,系統產甲烷能力下降,但是依然維持有較高的豐度且活性較強,可進一步對垃圾中難降解的物質進行發酵降解。產酸菌對應酸桿菌門(),產甲烷菌屬于廣古菌門(),硝化細菌對應硝化螺旋菌門()。cover樣品中3種細菌豐度均高于MSW樣品,說明在垃圾填埋處置過程中引入土壤進行中間覆蓋能有效提升系統的微生物量[31],覆蓋層可作為生化反應活性層,可促進系統內垃圾厭氧消化產甲烷。此外,cover樣品中硝化螺旋菌門共有5種,說明覆蓋層是系統進行硝化反應的主要場所。對比滲濾液樣品可以看出,隨著反應時間的增長,滲濾液樣品中酸桿菌門()和廣古菌門()微生物量增加。值得注意的是,3個滲濾液樣品中均未檢測出硝化螺旋菌門(),作為硝化細菌(),可將亞硝酸鹽氧化成硝酸鹽。缺少硝化菌,氨氮/硝酸鹽/亞硝酸鹽循環體系被中斷,導致系統內“氨積累”,微生物活性受到抑制,不利于系統消化產氣。根據研究結果,建議在垃圾耗氧分解階段接種硝化螺旋菌門()生物菌劑,強化垃圾發酵初期NH3-N硝化反應,緩解消化系統后期“氨積累”引起環境惡化,從而保障垃圾厭氧消化階段的穩定性,提升垃圾處理效率。
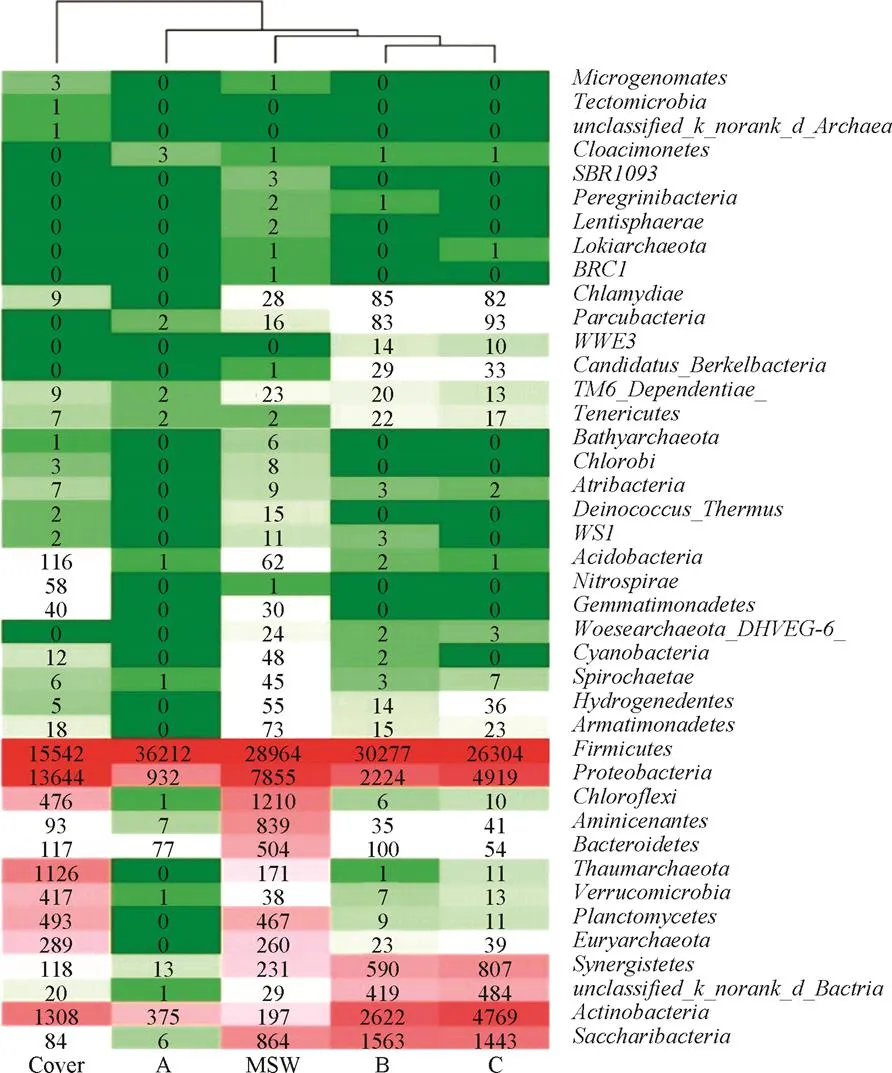
注:圖中數值為豐度OTU。
3 結 論
生活垃圾厭氧消化產氣速率符合Scholl Canyon模型指數衰減規律。擬合結果顯示,生活垃圾產氣速率常數為0.0149 d-1,垃圾產氣潛能為66.36 L/kg。
滲濾液pH值的變化對系統產甲烷進程有一定的指示作用,可作為一個輔助參考指標預測垃圾消化產甲烷進程。穩定產甲烷期,pH值會迅速升高達到峰值,產甲烷末期,pH值持續降低,且小于5.8。滲濾液TOC濃度出現2次峰值,分別對應垃圾中糖類和蛋白類物質水解。滲濾液中TN濃度持續增長,呈現氮積累的趨勢,該結果與發酵系統中缺乏硝化菌有關。滲濾液中TOC/TN≥11時,垃圾厭氧發酵系統穩定,正常產氣。而當滲濾液中TOC/TN<11時,系統發酵系統因“氨積累”失穩,產氣量小。試驗期內滲濾液各有機酸濃度為HBu>HAc>HPr> HVa。戊酸在垃圾厭氧消化過程中生成與轉化較為活躍,HAc/HVa變化較大且有明顯的拐點,拐點對應垃圾厭氧消化產甲烷初期。。
聚類樹分析得出生活垃圾樣品與滲濾液樣品中微生物種類及豐度都較為接近,有較近的親緣關系,且反應期越長相似度越高。垃圾厭氧消化系統中缺乏硝化螺旋菌門(),氨氮/硝酸鹽/亞硝酸鹽循環體系被中斷,導致環境惡化,不利于系統產氣。建議在垃圾耗氧分解階段接種硝化螺旋菌門()生物菌劑,強化垃圾發酵初期NH3-N硝化反應,降低消化系統后期氨的積累量,從而提升垃圾厭氧消化階段的穩定性。
[1] Comparetti A, Febo P, Greco C, et al. Italian potential biogas and biomethane production from of MSW [C]// IV International Conference Ragusa Shwa "safety, Health and Welfare in Agriculture, Agro-Food and Forestry Systems. 2015.
[2] Di M F, Gigliotti G, Sordi A, et al. Hybrid solid anaerobic digestion batch: biomethane production and mass recovery from the organic fraction of solid waste[J]. Waste Manag Res, 2013, 31(8):869-873.
[3] Aydi A, Abichou T, Zairi M, et al. Assessment of electrical generation potential and viability of gas collection from fugitive emissions in a Tunisian landfill[J]. Energy Strategy Reviews, 2015,8:8-14.
[4] Yu L, Wensel P C, Ma J W, et al. Mathematical modeling in anaerobic digestion (AD)[J]. Journal of Bioremediation and Biodegradation, 2014, 5 (S4): S4-003.
[5] Aguilar-Virgen Q, Taboada-González P, Ojeda-Benítez S. Analysis of the feasibility of the recovery of landfill gas: A case study of Mexico[J]. Journal of Cleaner Production, 2014, 79: 53-60.
[6] 楊國棟,蔣建國,黃云峰,等. 滲濾液回灌負荷對填埋場垃圾產氣效能的影響[J]. 環境科學,2006,27(10):2129-2134.
Yang Guodong, Jiang Juangu, Huang Yunfeng, et al. [Impact of leachate recirculation loadings on efficiency of landfill gas (LFG) generation][J]. Environmental Science, 2006, 27(10): 2129-2134. (in Chinese with English abstract)
[7] Townsend T G, Miller W L, Lee H, et al. Acceleration of landfill stabilization using leachate recycle[J]. Journal of Environmental Engineering, 1996, 122(4): 263-268.
[8] Wang Y, Pelkonen M. Impacts of temperature and liquid/solid ratio on anaerobic degradation of municipal solid waste: an emission investigation of landfill simulation reactors[J]. Journal of Material Cycles and Waste Management, 2009, 11(4): 312-320.
[9] Nikolaou A, Giannis A, Gidarakos E. Comparative studies of aerobic and anaerobic treatment of MSW organic fraction in landfill bioreactors.[J]. Environmental Technology, 2010, 31(12): 1381-1389.
[10] Reinhart D R, Mccreanor P T, Townsend T. The bioreactor landfill: its status and future[J]. Waste Management & Research, 2002, 20(2): 172-186.
[11] Sakita S, Nishimoto J, Nishimura K. A survey on characteristics of leachate pond in an offshore municipal solid waste disposal site[J]. Journal of Material Cycles & Waste Management, 2016, 18(2): 348-355.
[12] Arjun N. Effect of Leachate Blending on Anaerobic Digestion of Organic Fraction of Municipal Solid Waste[D]. Ottawa : University of Ottawa, 2013.
[13] Moletta R, Escoffier Y, Ehlinger F, et al. On-line automatic control system for monitoring an anaerobic fluidized-bed reactor: response to organic overload [J]. Water Science & Technology, 1994, 30(12): 11-20.
[14] Ahring B K, Sandberg M, Angelidaki I. Volatile fatty acids as indicators of process imbalance in anaerobic digestors[J]. Applied Microbiology & Biotechnology, 1995, 43(3): 559-565.
[15] 陳琳,李東,文昊深,等. 蔬菜廢棄物中溫厭氧發酵酸化失穩預警指標篩選[J]. 農業工程學報,2017,33(1):225-230.
Chen Lin, Li Dong, Wen Haosen, et al. Screening of early warning indicators of instability in anaerobic digestion of vegetable waste under mesophilic condition[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(1): 225-230. (in Chinese with English abstract)
[16] Zhang B, Deng H, Wang H, et al. Does microbial habitat or community structure drive the functional stability of microbes to stresses following re-vegetation of a severely degraded soil[J]. Soil Biology & Biochemistry, 2010, 42(5): 850-859.
[17] 焦學軍,邵軍,楊承休. 城市生活垃圾填埋產氣規律研究[J]. 上海環境科學,1996(9):30-33.
[18] Charles W, Carnaje N P, Cordruwisch R. Methane conversion efficiency as a simple control parameter for an anaerobic digester at high loading rates[J]. Water Science & Technology, 2011, 64(2): 534-539.
[19] He R, Wei X M, Chen M, et al. Effects of concentrated leachate injection modes on stabilization of landfilled waste[J]. Environmental Science & Pollution Research International, 2015, 23(4): 1-9.
[20] Sun Y, Sun X, Zhao Y. Comparison of semi-aerobic and anaerobic degradation of refuse with recirculation after leachate treatment by aged refuse bioreactor[J]. Waste Management, 2011, 31(6): 1202-1209.
[21] Sun Y, Sun X, Zhao Y. Comparison of semi-aerobic and anaerobic degradation of refuse with recirculation after leachate treatment by aged refuse bioreactor[J]. Waste Management, 2011, 31(6): 1202-1209.
[22] Kayhanian M. Ammonia inhibition in high-solids biogasification: An overview and practical solutions[J]. Environmental Technology, 1999, 20(4): 355-365.
[23] Kjeldsen P, Barlaz M A, Rooker A P, et al. Present and Long-Term Composition of MSW Landfill Leachate: A Review[J]. Critical Reviews in Environmental Science & Technology, 2002, 32(4): 297-336.
[24] Menkveld H W H, Broeders E. Recovery of ammonium from digestate as fertilizer[J]. Water Practice & Technology, 2017, 12(3): 514-519.
[25] Sprott G D, Patel G B. Ammonia toxicity in pure cultures of methanogenic bacteria[J]. Systematic & Applied Microbiology, 1986, 7(2): 358-363.
[26] Desloover J, Woldeyohannis A A, Verstraete W, et al. Electrochemical resource recovery from digestate to prevent ammonia toxicity during anaerobic digestion[J]. Environmental Science & Technology, 2012, 46(21): 12209-12216.
[27] Wang Y, Zhang Y, Wang J, et al. Effects of volatile fatty acid concentrations on methane yield and methanogenic bacteria[J]. Biomass & Bioenergy, 2009, 33(5): 848-853.
[28] Yeole T Y, Gokhale S, Hajarnis S R, et al. Effect of brackish water on biogas production from cattle dung and methanogens[J]. Bioresource Technology, 1996, 58(3): 323-325.
[29] Kim B C, Jeon B S, Kim S I, et al.., a bacterium capable of producing caproic acid from galactitol, isolated from a wastewater treatment plant[J]. International Journal of Systematic & Evolutionary Microbiology, 2015, 65(12): 4902.
[30] Liu M K, Tang Y M, Guo X J, et al. Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J]. Food Research International, 2017, 102: 68-72.
[31] Mali Sandip T, Khare Kanchan C, Biradar Ashok H. Enhancement of methane production and bio-stabilisation of municipal solid waste in anaerobic bioreactor landfill[J]. Bioresource Technology, 2012, 110: 10-17.
Properties of methane production process of municipal solid wastes by anaerobic bioreactor landfill
Zeng Yunmin1,2, Wang Li'ao1,2※, Xu Tengtun2, Song Xue2, Hu Chaochao2, Li Tong2
(1.,,400044,;2.,,400044,)
In this paper, bioreactor was used to simulate the municipal solid waste (MSW) biodegradation process of landfill, tracing and testing trash methanogenic process and characteristics of leachate during anaerobic digestion, exploring the relationship between the two processes, aiming to screen out the indicators that can predict the methane production process of anaerobic digestion. The results observed at the end of 250 days prevailed that the cumulative biogas production was 1 850.38 L. The MSW anaerobic digestion gas production rate exponentially declines, measured values were basically consistent with the curve fitting with 0.78 of correlation coefficient. The nonlinear regression of the biogas production rates and digestion time showed that Scholl Canyon model fitted the results well, and the biogas production rate constants and waste gas potential were 0.0149 d?1and 66.36 L/kg, respectively. Determination of leachate characteristics showed that the peaks of total organic carbon (TOC) concentration in leachate appeared two times, which corresponded to the hydrolysis of sugar and protein in MSW. The concentration of TN in leachate continued to increase, showing the trend of nitrogen accumulation. The pH value, total organic carbon/total nitrogen (TOC/TN), acetic acid/valeric acid (HAc/HVa) of leachate changed in the system of methane production process, which has some instructions for stability. At the initial stage of methane production from digestive system, the pH value of leachate stabilized at 5.77-5.91. During the peak of methanogenic period, the pH value of leachate rapidly rose to its peak. In the late stage of methane production, the pH value continued to decrease and was less than 5.8. When the TOC/TN value of leachate was larger than 11, the anaerobic fermentation system was stable and methanogenic was normal. However, when TOC/TN value of leachate was lower than 11, the fermentation system was unstable due to ammonia accumulation, biogas production was small. The concentration of volatile fatty acids in leachate was HBu>HAc>HPr>HVa during the test period. The synthesis and transformation of valerate in waste anaerobic digestion process was relatively active. The HAc/HVa ratio changed greatly and had a significant inflection point, which was corresponding to the initial stage of methane production by anaerobic digestion. In addition, this paper also studied the leachate samples from different reaction periods (hydrolytic acidification A (50thday), methane production peak B(190thday), methane production end C(250th)), and solid samples at end-state MSW and cover were analyzed by 16S rRNA gene tag pyrosequencing for microbial community assessment. Cluster tree analysis showed that MSW samples and leachate samples were relatively close in microbial species and abundance with close genetic relationship, and the longer the reaction period, the higher the similarity. The lack ofin the anaerobic digestion system led to the interruption of ammonia nitrogen/nitrate/nitrite cycle, which caused environmental degradation and was not conducive to system gas production. The cover layer was the main site of nitrification. The cover layer can be used as a biochemical reaction active layer, which can promote methane production in the anaerobic digestion system. The ammonia poisoning inhibited the activity of methanogenic bacteria, which was the main reason for the decrease of methane production capacity of the anaerobic digestion system.The inoculation ofbiological bacteria in the phase of MSW oxygen consumption can strengthen the NH3-N nitrification reaction at the initial stage of waste fermentation, reduce the accumulation of ammonia in the late digestive system and enhance the stability of the MSW anaerobic digestion.
wastes; methane; degradation;bioreactor landfill; anaerobic digestion; methane production; leachates; microbial community
曾韻敏,王里奧,胥騰屯,宋 雪,胡超超,李 彤. 生物反應器模擬生活垃圾填埋降解產甲烷性能[J]. 農業工程學報,2018,34(13):263-269. doi:10.11975/j.issn.1002-6819.2018.13.032 http://www.tcsae.org
Zeng Yunmin, Wang Li'ao, Xu Tengtun, Song Xue, Hu Chaochao, Li Tong. Properties of methane production process of municipal solid wastes by anaerobic bioreactor landfill[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(13): 263-269. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.13.032 http://www.tcsae.org
2018-01-31
2018-05-17
重慶市社會民主科技創新專項(cstc2016shmsax9004);國家科技支撐計劃項目(2014BAC29B01)
曾韻敏,博士生,從事固體廢物處理處置及資源化利用研究。Email:zengyunmin@cqu.edu.cn
王里奧,博導,教授,從事固體廢物處理處置及資源化利用研究。Email:wangliao@cqu.edu.cn
10.11975/j.issn.1002-6819.2018.13.032
X705
A
1002-6819(2018)-13-0263-07

