植物分枝發育調控的研究進展
付正莉, 劉 蕊, 王寧寧, 朱克明, 陳 松, 張潔夫, 譚小力
(1.江蘇大學生命科學研究院,江蘇鎮江 212013; 2.江蘇省農業科學院經濟作物研究所,江蘇南京 210014)
植物分枝(branching)是植物普遍存在的生長現象,腋芽形成后進一步生長形成側枝,側枝上的腋芽也可以發育成側枝,進而形成株系。植物分枝受基因、激素、自然環境、營養條件等多種因素的影響,也與作物的產量有關,可通過影響作物的結實量進而影響作物的產量。
腋生分生組織(axillary meristem,簡稱AM)的形成與腋芽的生長為植物分枝發育的2個階段。腋生分生組織在葉片的葉腋處生成,進而發育成腋芽,腋芽生長成為側枝。側枝具有與主莖相同的能力,如產生葉片、花等組織。由于植物的性質和種類有差異,植物的地上株型和分枝組成也各不相同。觀察植株的分枝形態,可以將所有的分枝歸為五大類:單軸分枝(monopodial branching)、合軸分枝(sympodial branching)、假二叉分枝(false dichotomous branching)、二叉分枝(dichotomous branching)、分蘗(tiller)。通過對植物分枝發育調控機制的研究,從水稻、擬南芥、番茄、玉米、矮牽牛突變體中得到一系列與分枝相關的基因。由于這些基因影響分枝發育的階段存在差異,將其歸納為三大類:第一類是參與腋生分生組織形成的基因,如MOC/LS、LAX、BLIND等;第二類是參與腋生分生組織生長的基因,如MAX、RMS、DAD等;第三類是對上述2個方面均有影響的基因,如TB1、SPS/BUS。
本文將從腋生分生組織的形成和生長2個方面著手,闡述參與調節植物分枝發育相關基因的研究進展,以期為植物分枝的分子機制研究提供參考。
1 調控腋生分生組織形成的基因
1.1 Lateral suppressor(簡稱LAS)與LS基因
LS基因調控腋生分生組織的形成,起初是從番茄突變體中被發現的。番茄LS突變體在營養生殖階段不能產生腋生分生組織,同時花的發育也會產生缺陷,導致花瓣喪失以致生育率下降[1]。LS基因編碼的蛋白屬于GRAS家族的VHIID轉錄因子,且GRAS蛋白僅在植物中被發現,在植物生長發育和信號轉導等方面具有重要作用[2]。LS和轉錄調節劑Goblet分級調控番茄葉基部異位分生組織的形成,異位分生組織形成導致芽數量的增加,增強了生存能力并打開了營養繁殖的途徑[3],Gob和Ls以分級方式行使功能,因為Ls轉錄物積累取決于Gob活性,但反之亦然。擬南芥Lateralsuppressor(簡稱LAS)基因是LS的同源基因,其在葉原基的近軸邊界處的帶型結構域中表達,是腋生分生組織形成的關鍵調節子,該基因突變后植株幾乎無分枝[4]。系統發育分析表明,LAS功能和調節在進化上是高度保守的。進一步研究表明,LAS的邊界特異性表達是由其開放閱讀框下游高度保守的增強子所控制的,并且調節序列在LAS和LS中是功能保守的[5]。
1.2 Monoculm1(簡稱MOC1)
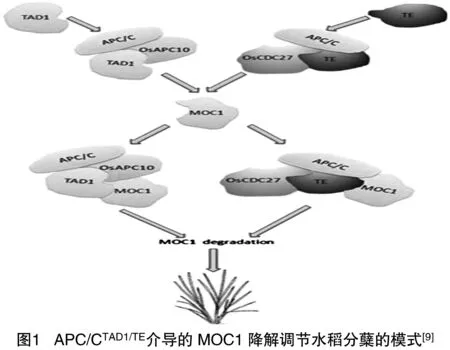
水稻MOC1與來自番茄和擬南芥的LS/LAS屬于同源基因,是通過圖位克隆方法從少分蘗水稻突變體植株中分離出來的[6]。MOC1定位在核內,編碼的蛋白屬于GRAS家族蛋白。水稻單稈突變體moc1為1個主莖且無分枝產生,而在野生型植株中過表達MOC1,植株分蘗大量增加,說明MOC1基因作為轉錄因子對水稻分蘗起到正調控的作用。MOC1基因參與調控水稻AM的起始和分蘗芽的生成,促進分蘗芽的伸長,且在營養生長和生殖生長時期都影響分枝發育。研究者近期報道了2個新型基因TAD1[7]和TE[8],這2個基因被證實作用于MOC1的上游,在葉腋處與MOC1共表達,并通過調控MOC1基因來決定水稻的分枝。TAD1從tad1(tilleringanddwarf1)分蘗矮化突變體中分離出來,該突變體表現為分蘗增多且植株矮化。研究表明,TAD1編碼1個后期促進復合物泛素連接酶(APC/C)的共激活因子,APC/CTAd1復合物與OsAPC10結合后作為APC/C的共激活因子作用于MOC1基因,以細胞周期依賴性方式使靶基因MOC1降解。從多分蘗突變體Te(tiller enhancer)中分離出TE基因,TE編碼1個水稻同源基因Cdh1,即泛素連接酶APC/C的輔激活因子。APC/CTE復合物與OSCDC27、MOC1相互作用,通過泛素化26S蛋白酶體途徑介導MOC1的降解。如圖1所示,水稻通過MOC1降解調節分枝,最終影響水稻谷粒產量[9]。
1.3 BLIND(簡稱BL)/RAX1
Blind番茄突變體表現為腋生分生組織的形成在莖和花序的發育時期受到抑制,進而使分枝數量減少。BLIND基因從番茄突變體blind中被分離出來,通過編碼MYB轉錄因子調節腋生分生組織的起始[10],同時其他側生分生組織的形成如側莖、合軸莖等均受到抑制。BLIND基因屬于MYB轉錄因子家族中的R2R3類,該家族參與調節植物次生代謝、細胞周期過程。比較基因組學研究發現,擬南芥分枝調節基因REGULATOROFAXILLARYMERISTEMS1(RAX1)與BLIND同源,屬于R2R3MYB基因家族。擬南芥rax1突變體表型與blind相似,即側生分生組織形成受阻,分枝減少。通過表達研究和互補試驗分析表明,BLIND、RAX基因由于啟動子分化,已經具有子功能或者新功能化。由功能獲得性突變植株得出,基因LS/LAS和BLIND/RAX均通過抑制生長發揮作用[11]。進一步研究發現,LS/LAS和BLIND/RAX功能在參與腋生分生組織AM的形成過程中具有冗余性[10]。同時,RAX1在LAS之前表達,并僅限于腋生分生組織的中心,是最早的腋生分生組織定位基因。
1.4 LAX/BA1
水稻LAX1(LAXPANICLE1)編碼轉錄調節因子,通過定位克隆方法從lax1突變體中分離出來[12]。水稻LAX1(LAXPANICLE1)突變體表現為花序較少、側生小穗缺失腋生分生組織導致其生長受抑制。進一步研究表明,LAX1在水稻生殖生長時期調節腋生分生組織的起始,在相同的遺傳途徑中,與SPA(smallpanicle)基因具有冗余性。lax/spa雙突變體植株表現為花序無分枝、分蘗數嚴重減少、腋生分生組織的形成被抑制。LAX1瞬時積聚在第四葉隔期腋生分生組織起始時,并嚴格調節mRNA的表達和控制隨后蛋白質的轉運[13]。LAX2基因通過圖位克隆的方法從lax2(laxpanicle2)突變體中被分離出來,并且與lax1具有相似的表型,即大多數側生小穗腋生分生組織缺失、花序減少。LAX2編碼1個核定位蛋白且與LAX1相互作用,共同調節水稻腋生分生組織的形成[14]。
玉米中barrenstalk1(簡稱ba1)基因與玉米LAX基因同源,編碼bHLH(basic helix-loop-helix)轉錄因子。ba1突變體側生分生組織的形成在營養和生殖生長時期被抑制,表型與lax突變體相似。研究證實,BA1可與BIF2(barren inflorescence 2)發生互作[15],BIF2基因編碼1個蛋白激酶,參與調節生長素信號運輸過程[16]。BA1直接受到BIF2磷酸化調節,被激活后進而調節下游基因Kn1(knotted1)表達和蛋白分布[17-19],Kn1屬于同源異形盒基因,編碼1種轉錄因子,在莖分生組織形成和維持中具有重要作用。如果BA1發生突變,下游基因Kn1無法發揮作用,最終導致AM的形成受阻,植株分枝減少[20-21]。
2 調控腋生分生組織生長相關基因
2.1 MAX/RMS/DAD/D
擬南芥moreaxillarygrowth(簡稱max)突變體相比于野生型植株分枝增多、株高降低,與豌豆ramosus(簡稱rms)基因、矮牽牛decreasedapicaldominance(簡稱dad)基因、水稻dwarf(簡稱d)基因突變體表型類似,max1、max3、max4在植株根部、莖部抑制分枝。MAX/RMS/DAD/D基因參與獨腳金內酯(strigolactones,簡稱SLs)生物合成和信號轉導過程。獨腳金內酯是一種調節植物生長發育的新型植物激素,在植物根部產生,沿莖干向上運輸,直接或間接抑制植物分枝發育。
擬南芥MAX3與水稻D17、矮牽牛DAD3、豌豆RMS5屬于同源基因[22-24],編碼類胡蘿卜素裂解雙加氧酶7(簡稱CCD7)。MAX3編碼1個質體定位蛋白,相比于在根中的表達水平,在莖和穗中的表達水平較高,同時還受到生長素的調節,且調節植物側枝發育具有保守性。MAX4編碼類胡蘿卜素裂解雙加氧酶8(簡稱CCD8),與水稻D10、矮牽牛DAD1、豌豆RMS1同源[25-26]。MAX4/D10/DAD1/RMS1定位在質體上,在植株中表達量低,也受生長素誘導[26]。MAX4參與SL的合成過程,并在CCD7的下游發揮作用[27]。MAX1/OsMAX1[28-29]編碼細胞色素蛋白P450,可抑制側枝的發育[30]。研究表明,MAX1/OsMAX1在MAX3/D17/RMS5/DAD3、MAX4/D10/RMS1/DAD1下游發揮作用,通過以CCD7和CCD8的反應產物或其他代謝物為底物,合成SLs復合物[31]。擬南芥MAX2與水稻D3[32]、豌豆RMS4屬于同源基因,MAX2編碼1種F-box蛋白。max突變體相比于野生型植株初級分枝數較少,腋芽分生組織生長受抑制。MAX2/D3/RMS4位于MAX1/OsMAX1、MAX3/D17/RMS5/DAD3、MAX4/D10/RMS1/DAD1M基因下游,在抑制分枝的過程中不可或缺。近期報道表明,水稻D53[33-34]、D27[35]、D14/D88/HTD2/AtD14/DAD2等基因也通過參與SL信號途徑調節植物的分枝發育。將上述基因按參與獨腳金內酯途徑功能不同歸類,即MAX3/D17/RMS5/DAD3、MAX4/D10/RMS1/DAD1、OsMAX1s/MAX1參與調控SL的合成;MAX2/D3/RMS4及D53、D14/D88/HTD2/AtD14/DAD2、MAX2/D3/RMS4調控SL的信號轉導。
2.2 WUS/OsWUS
擬南芥WUS(wuschel)基因屬于WOX家族,與水稻OsWUS、MOC3基因及玉米Zm-WUS1、ZmWUS2基因同源[36-37]。WUS在莖端分生組織中表達,誘導細胞增殖。WUS功能獲得性突變體植株表現為下胚軸細長,相反,WUS功能缺失性突變體下胚軸的伸長被抑制。研究表明,WUS基因在下胚軸異位表達時通過其靶基因GLUTAMINE-RICHPROTEIN23(GRP23)促進細胞分裂[38]。水稻OsWUS、MOC3基因與擬南芥WUS同源[37],OsWUS在調控水稻分蘗時其同源異形域起到關鍵作用[39]。水稻單稈基因MONOCULM3(MOC3)[40]是最近通過圖位克隆方法被分離出來的,在moc3中,分蘗芽的起始受到阻斷,植株幾乎沒有分蘗。MOC3定位在核內,編碼1個核定位轉錄因子,MOC3發生點突變,導致OsWUS的表達提前終止。研究表明,MOC3調控腋芽的形成受到細胞分裂素的誘導。MOC3功能缺失時,會影響細胞分裂素響應調節因子OsRRs、ORR的表達,且可與TPR(topless-related protein)蛋白發生互作,TPL/TPR是一類在植物中廣泛存在的轉錄共抑制子(co-repressor),在激素信號轉導途徑中起到基因轉錄抑制作用。而獨腳金內酯途徑中D53蛋白與TPL/TPR蛋白形成轉錄抑制復合體,協同抑制SL信號下游靶基因的表達[33],提示MOC3可能通過與TPR互作參與SL途徑,從而影響SL信號途徑下游基因的響應。
3 調控腋生分生組織形成和生長的基因
3.1 TB1/OsTB1
TB1(teosintebranched1)基因編碼1個含TCP[TCP為最先發現的3個該家族的蛋白名稱的首字母縮寫,分別是玉米中的TEOSINTE BRANCHED1(TB1)、金魚草中的CYCLOIDEA(CYC)和水稻中的PROLIFERATING CELL FACTORS(PCF)]。結構域的轉錄調控因子,屬于TCP蛋白家族一員。TCP結構域由1個螺旋-環-螺旋構型和DNA結合的基序組成[41]。玉米TB1基因可抑制側枝發育和雄花的形成,隨著植株生長,其表達量逐漸減少,即兩者呈負相關。玉米TB1的同源基因水稻OsTB1基因通過圖位克隆被分離得到。水稻中OsTB1作為分枝的負調控基因,明顯受到MOC1調節。從Ostb1轉基因水稻的表型來看,分蘗和圓錐花序的數量在過表達OsTB1水稻中減少,而在RNAi干擾OsTB1水稻中增多,進一步表明OsTB1對水稻分枝起負調控作用[42-44]。近期有報道表明,OsTB1調控OsIAA6的表達,Osiaa6干擾突變體表現出非正常分蘗生長,OsIAA是水稻Aux/IAA的同源基因,在莖基部的葉腋分生組織中特異表達,同時受到生長素轉運蛋白OsPIN1的調控作用。生長素轉運蛋白PIN介導生長素運輸,其中OSPIN1、OSPIN2和OsPIN3t/3a/10a、OsPIN5b參與生長素運輸和分布[45-48]。試驗結果表明,OsTB1調控生長素相關基因表達,進而調節生長素水平,維持植物激素平衡,參與到水稻分蘗生長調節的過程中[49]。
FC1(FINECULM1)[50]從多分蘗水稻細稈突變體fc1中被分離出來,編碼轉錄因子且與TB1基因同源,序列分析顯示,fc1的OsTb1開放閱讀框的第327位堿基(C堿基)缺失導致移碼突變,產生終止密碼子,引起了隨后的轉錄和翻譯終止。用獨腳金內酯類似物GR24處理fc1植株時,植株表型不受影響,說明FC1是SL抑制腋芽生長所必需的,在d3突變體中過表達水稻FC1,可以部分恢復d3的表型,提示FC1作用于SL的下游,其表達量受到D53基因的抑制[34]。此外,細胞分裂素和SL可快速地減少和增加腋芽中FC1的表達量,意味著FC1/TB1可能是細胞分裂素和SL途徑的共同靶目標[51]。
3.2 Supershoot(簡稱SPS)與bushy(簡稱BUS)
sps突變體和bus突變體均在擬南芥中被發現,表現為分枝和花序濃密。除此之外,bus突變體還表現出葉片皺縮、維管生長緩慢。在sps突變體中,細胞分裂素和生長素水平提高,SPS/BUS在植株葉腋處表達水平最高,說明SPS/BUS基因在葉腋處通過間接或直接調節植物激素水平進而調控植株腋生分生組織的形成發育[52-53]。SPS/BUS編碼的蛋白屬于細胞色素P450 CYP79F1亞家族成員,參與生長素的合成過程[52],將CYP79F1失活后,植株頂端優勢上升,生長素增多[54-55]。調節植物分枝發育基因的編碼蛋白及其功能等信息見表1。
4 討論
植物分枝基因包含在多個進程中:在蛋白降解途徑方面,探究蛋白與已知成分的相互作用在了解獨腳金內酯調節植物分枝機制方面也起到了關鍵作用;在植物激素途徑方面,通過改變激素的含量調節生長素、細胞分裂素的平衡等來起作用;有些基因屬于轉錄因子,通過調控其他基因的轉錄來發揮作用。隨著分子生物學和遺傳學的快速發展,植物腋生分生組織的形成和腋芽的生長調控機制已被了解。特別是通過篩選突變體而克隆出與植物分枝相關的新基因,然后用轉基因技術鑒定出包含在植物分枝過程中的這些基因,可為闡明植物分枝發育機制提供理論依據。人們希望通過對分枝調控網絡的了解,找出關鍵基因并進行改造,進而培育出抗倒伏、高產等具有優良農藝性狀的農作物。

表1 調節植物分枝發育的基因
目前,已有超過100種植物品種完成基因組測序工作,部分植株突變體庫也已建立,推進了植物分枝機制的研究進程和優良農作物的培育工作。近幾年來,科學家從重要的單子葉模式生物水稻中克隆出大量分枝相關基因,并將其與擬南芥比較,得到同源基因。通過對水稻突變體的研究,發現新的基因和新的分枝發育調節途徑,有助于對植物分枝發育機制的進一步研究。
通過科學家的不斷努力,植物分枝發育分子機制及信號通路中基因間的關系逐漸清晰。但植物分枝發生過程受到多途徑調控,包括基因、遺傳、激素、環境等相互作用的調節均可影響植株分枝的正常發育。因此,人們在植物分枝發育機制的研究中還需要付出很多努力。

