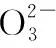復雜離子推斷題的思維模型
方大學
浙江
離子推斷是浙江省新高考必考內容,通常出現在第25題。題目綜合性較強,難度較大,它要求學生能初步學會收集各種證據,對物質的性質及其現象提出可能的假設;基于證據進行分析推理;能解釋證據與結論之間的關系,確定形成科學結論所需要的證據和尋找證據的途徑;能依據物質及其變化的信息建構模型,建立解決復雜化學問題的思維框架,考查了化學核心素養中的證據推理和模型認知。本文例理結合,分析建構復雜離子推斷題的思維模型。
一、典題引路,體驗解題思維過程

(1)一份固體溶于水得無色透明溶液,加入足量BaCl2溶液,得沉淀6.63 g,在沉淀中加入過量稀鹽酸,仍有4.66 g沉淀。
(2)另一份固體與過量NaOH固體混合后充分加熱,產生能使濕潤的紅色石蕊試紙變藍色的氣體0.672 L(標準狀況)。
下列說法正確的是
( )
B.該固體中一定沒有Cu2+、Cl-、Na+
D.根據以上實驗,無法確定該固體中有Na+

【答案】A
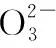

下列說法正確的是
( )
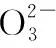
B.溶液X中一定不含Ca2+、Br-
D.在溶液X中依次滴入鹽酸、雙氧水和硫氰化鉀溶液后,溶液將變為紅色

【答案】B
二、總結提煉,建構解題思維模型
明確物質的性質及特殊反應現象是解決本類題的關鍵,根據物質的性質及題給信息來分析解答。通過“例1”“例2”分析與解答,使學生掌握如下解題思路:
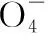

離子試劑現象注意沉淀法Cl-、Br-、I-AgNO3溶液和稀HNO3分別有:AgCl(白色)、AgBr(淡黃色)、AgI(黃色)沉淀生成SO2-4稀鹽酸和BaCl2溶液有白色沉淀生成先用鹽酸酸化Fe2+NaOH溶液先有白色沉淀生成,白色沉淀迅速變成灰綠色沉淀,灰綠色沉淀最終變成紅褐色沉淀Fe3+NaOH溶液有紅褐色沉淀生成

離子試劑現象注意氣體法NH+4濃NaOH溶液和濕潤的紅色石蕊試紙產生有刺激性氣味的氣體,且氣體能使濕潤的紅色石蕊試紙變藍要加熱CO2-3稀鹽酸和澄清石灰水澄清石灰水變渾濁SO2-3、HSO-3、HCO-3等離子有干擾SO2-3稀硫酸和品紅溶液產生有刺激性氣味的氣體,且氣體能使品紅溶液褪色,加熱品紅溶液又恢復為原色HSO-3有干擾

離子試劑現象注意顯色法I-氯水(少量),CCl4下層為紫紅色Fe2+①KSCN溶液和氯水②鐵氰化鉀溶液①先是無變化,滴加氯水后溶液變血紅色②生成藍色沉淀先加KSCN溶液,再加氯水Fe3+①KSCN溶液②苯酚溶液①血紅色②紫色Na+、K+Pt(Fe)絲和稀鹽酸火焰分別呈黃色、紫色檢驗K+要透過藍色鈷玻璃觀察焰色

第三步,根據電中性原則可知溶液呈中性,一定既有陽離子,又有陰離子,且溶液中正電荷總數與負電荷總數相等。利用電荷守恒,通過定量計算可幫助我們確定一些隱含的“一定有”的離子。
第四步,排除干擾離子,找出“不一定有”的離子。在實驗過程中,通常加入的試劑中引入的離子,或在實驗過程中反應生成的離子,可能會對后續實驗造成干擾。
通過上述分析,可得出如下表所示解題思維模型:

復雜離子推斷題的思維模型
三、觸類旁通,應用模型認知解題
模型最大的魅力在于普適性。應用該思維模型可以解答任何復雜的離子推斷題。對于簡單的離子推斷題可以靈活運用其中的某步或某幾步。
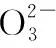

下列說法正確的是
( )
A.該混合物一定是K2CO3和NaCl
B.該混合物可能是Na2CO3和KCl
C.該混合物可能是Na2SO4和Na2CO3
D.該混合物一定是Na2CO3和NaCl