酶促酰化對錦葵啶葡萄糖苷呈色及熱降解規律的影響
彭非,鄧潔紅,*,劉永紅
(1.湖南農業大學食品科技學院,湖南長沙410128;2.食品科學與生物技術湖南省重點實驗室,湖南長沙410128;3.湖南生物機電職業技術學院,湖南長沙410127)
刺葡萄(Vitis davidii Fo?x.),植物學分類上是東亞種群葡萄屬(Vitis)[1],果皮為紫色,湖南省西北以及湘南地區分布廣泛。刺葡萄皮中蘊含豐富的花色苷,以錦葵色素為主,是制備花色苷單體的理想原料[2]。在自然條件下,花色苷通常由花色苷配基(花色素)與糖通過糖苷鍵相結合,僅有少部分以有機酸酰化的形式存在。酰化反應通常發生在與花色素相連的糖基上的羥基上,如Saito N等[3]從紫羅蘭花中分離出了5種酰基化花色苷,并發現是咖啡酸與其在3位和5位上的葡萄糖發生的酰化。植物中部分花色苷含酰基,是由于酰基轉移酶的作用,在植物生長過程中累積而成,但天然含酰基的花色苷數量較少。王維茜等[4]在分離純化刺葡萄花色素時,發現分離的4種刺葡萄花色苷單體僅有1種具有酰基結構。現有研究已證明花色苷穩定性與其酰基結構存在密切關系,由于內源酰基的輔色作用,單個花色苷依賴自身芳香酰基的存在,加強分子間的鍵合,使花色苷母核免遭水分子的攻擊,進而提高其穩定性[5]。Cevallos-Casals B A[6]的研究結果表明,紫甘薯酰化花色苷含量較豐富,因此其穩定性要優于非酰化的紫玉米花色苷。
花色苷的穩定性會受到溫度的影響,而熱處理是食品加工中的必要步驟,比如濃縮、干燥、滅菌等。因此,提高花色苷自身熱穩定性是擴大花色苷系列產品應用的關鍵。外源酰基的引入是改善花色苷穩定性的新思路。利用酶促反應實現花色苷糖苷酰化是提高花色苷結構穩定性的新方法。酶法對催化底物具有良好的專一性和選擇性,反應條件溫和,催化效率高,彌補了化學法酰化區域選擇性差、副產物多、產率低、需要基團保護和脫保護等諸多缺點[7],而且是不可逆反應,反應產物穩定,優于單純使用有機酸或酚酸酰化輔色。
花色苷在保存條件下的含量變化可以反映其結構穩定性,另外,花色苷呈色與含量也是息息相關[8]。結合花色苷的含量變化及測色指標,可以較為全面地反映花色苷的穩定特性。如González等[9]通過色差指標探究花色苷自聚反應及其輔色素對新鮮紅葡萄酒顏色的改變。
本文以錦葵啶-3,5-O-雙葡萄糖苷(分子式如圖1所示)單體為原料,對其進行酶促酰化反應。研究對比分析酶促酰化處理前后花色苷的熱穩定性及呈色特征,探究外源酰基對花色苷結構穩定性的影響。研究結果可為花色苷結構穩定化提供借鑒,為刺葡萄花色苷色素的擴大應用奠定基礎。
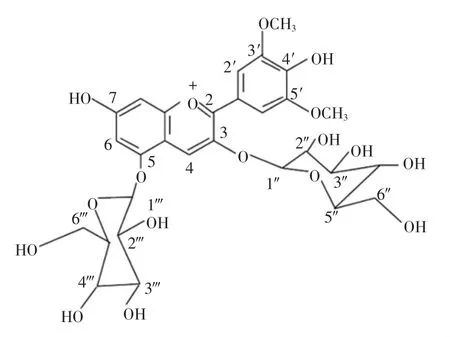
圖1 錦葵啶-3,5-O-雙葡萄糖苷分子式Fig.1 The molecular structure of malvidin-3,5-diglucose
1 材料與方法
1.1 材料
1.1.1 原料
刺葡萄:采于湖南省中方縣刺葡萄果園,自來水淋洗、晾干表面水分后手工剝皮,-24℃冷凍貯藏備用。
1.1.2 試劑
鹽酸、無水乙醇、乙酸乙酯、乙醚、甲醇(分析純)、三氟醋酸[trifluoric acetic acid,TFA,(色譜純)]、聚酰胺樹脂(100目~200目)、分子篩4A型(鈉-A型分子篩):國藥集團化學試劑有限公司;大孔吸附樹脂HP-20:日本三菱公司;2-甲基四氫呋喃[2-Methyltetrahydrofuran,2-MeTHF,(色譜純)]:上海阿拉丁生化科技股份有限公司;肉桂酸乙烯酯:梯希愛化成工業發展有限公司;南極假絲酵母脂肪酶B(candila antarctica,CAL-B 5萬U/g):諾維信生物技術有限公司。
1.1.3 主要儀器與設備
AEY-220電子分析天平:湘儀天平儀器設備有限公司;SX-4-10型箱式電阻爐:天津市泰斯特儀器有限公司;TDZ5臺式低速離心機:湖南赫西儀器裝備有限公司;UV-2450紫外分光光度計:日本島津;THZ-92A氣浴恒溫振蕩器:上海浦東物理光學儀器廠;RE-2000B旋轉蒸發儀:鞏義市予華儀器有限責任公司;HH-8數顯恒溫水浴鍋:上海浦東物理光學儀器廠;PHSJ-3F pH計:上海儀電科學儀器股份有限公司;層析柱(φ1.6×30 cm,B224/29):上海達豐玻璃儀器廠;SMY-2000測色色差計:北京天創尚邦儀器設備有限公司;KQ5200B超聲波清洗器:昆山市超聲儀器有限公司。
1.2 試驗方法
1.2.1 刺葡萄花色苷單體的制備
以刺葡萄皮為原料,以料液比1∶6(g/mL)加入80%乙醇(含0.03%鹽酸)提取,避光浸提24 h,抽濾。濾液于0.1 MPa真空度下40℃條件下濃縮回收乙醇,取色素濃縮液分別經過無水乙醚,無水乙酸乙酯萃取2次,脫除有機溶劑,真空蒸發得到花色苷粗提液。
錦葵花色苷的純化:HP-20樹脂預處理后濕法裝柱,花色苷粗提液進樣至吸附飽和(流出液吸光度值為上樣液的1/10時。)首先用2BV蒸餾水沖洗,再用酸化乙醇(體積分數80%、含0.05%鹽酸,8BV)洗脫,收集洗脫液于40℃真空濃縮,脫除乙醇。
錦葵花色苷的單體分離:Sephadex LH-20凝膠經預處理后濕法裝柱,脫除乙醇后的洗脫液經0.22 μm微孔濾膜過濾后進柱上樣,然后用酸化甲醇(體積分數50%、含0.1%的TFA)洗脫,分別收集得到3種色素,真空凍干,結構鑒定后,選取其一錦葵素-3,5-O-雙葡萄糖苷(malvidin-3,5-O-diglucoside)為試驗單體,純度為99.54%。
1.2.2 酶促酰化花色苷樣品制備
1.2.2.1 有機溶劑分子篩預處理
在350℃條件下活化4A分子篩8 h。冷卻后置于干燥器中,添加有機溶劑2-MeTHF過夜脫水12 h,取液體部分備用。
1.2.2.2 脂肪酶活性的測定
參考國家標準GB/T23535-2009《脂肪酶制劑》測定CAL-B435的活性。測得CAL-B435的酶活為0.25 U/mg。
1.2.2.3 酶促酰化花色苷制備
準確稱取錦葵素-3,5-O-雙葡萄糖苷單體13.10 mg,吸取肉桂酸乙烯酯36 μL,4 mL脫水后2-MeTHF、0.3 g分子篩,加入10 mL帶塞小瓶中,超聲波助溶。將帶篩小瓶置于45℃恒溫振蕩器中,加入80 U脂肪酶(CAL-B)啟動反應。避光振蕩反應2.5 h后中止反應。將濾液抽濾后置于0.1 MPa真空度下懸蒸1 h,回收2-MeTHF以及殘留的肉桂酸乙烯酯,備用。
1.2.3 酶促酰化對錦葵啶葡萄苷熱穩定性影響
稱取已制備的酶促錦葵啶花色苷粉末1.25 mg,用pH3.0磷酸鹽緩沖液溶解,稀釋搖勻,定容至25 mL。20℃條件下避光靜置1 h。于波長530 nm處測定初始吸光度值A0,然后將樣品分別置于3個不同溫度(60、80、100℃)的恒溫水浴鍋中,每隔1小時取樣,用自來水迅速冷卻至室溫后,在530 nm波長處測定其吸光度值At。以未酰化的錦葵素-3,5-O-雙葡萄糖苷單體進行對照。
1.2.4 花色苷保存率值計算
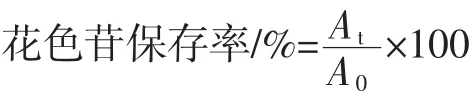
式中:A0為熱處理前溶液的吸光度;At為熱處理t h后溶液的吸光度。
1.2.5 色差值的測定
色澤以亮度L*值、紅綠a*值、黃藍b*值表示。取熱處理后的酶促酰化花色苷溶液5mL,用測色色差計測定其色澤。記錄L*、a*、b*數值。以未酰化的花色苷樣品為對照。
1.2.6 刺葡萄花色苷的測定
參照鄧潔紅[2]的方法,采用pH示差法測定花色苷含量。
1.2.7 酶促花色苷熱降解動力學參數
花色苷的降解動力學反應基本上符合零級或一級動力學模型[10]。花色苷溶液的吸光度與濃度成正比例關系,,得到花色苷含量的變化與處理時間的關系為:
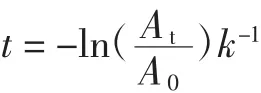
1.2.7.1 花色苷半衰期
花色苷半衰期公式如下:

式中:t為熱處理時間,h;A0為熱處理前溶液的吸光度;At為熱處理t h后溶液的吸光度;k為反應速率常數;Ct為花色苷初始濃度;C0為花色苷最終濃度。
1.2.7.2 活化能Ea
Arrhenius證明熱降解反應速率常數與反應溫度T之間存在聯系。活化能Ea計算公式如下:
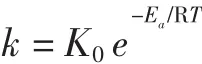
建立得到花色苷熱降解動力學模型:
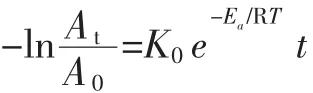
式中:K0為頻率常數,對于指定的反應,A與反應物的濃度和溫度無關;R為氣體常數,8.314×10-3kJ/(mol·K);Ea為活化能,kJ/mol;T 為絕對溫度,K;k 為反應速率常數。
1.2.7.3 溫度系數Q10
溫度系數Q10,表示溫度每升高10℃,反應速率變化的量比,見公式:
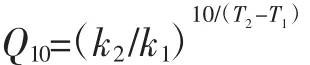
式中:Q10為溫度系數;k1、k2為分別為當溫度為T1、T2時的反應速率;T1、T2為熱處理前、后的溫度,℃。
1.2.8 數據處理分析
試驗設置2次重復,結果表示為平均值±標準差。試驗數據采用SPSS 17.0軟件進行分析(差異顯著性水平設置為 p<0.05)。
2 結果與分析
2.1 酶促酰化對錦葵啶葡萄糖苷溶液熱穩定性的影響
酶促酰化處理對錦葵啶葡萄糖苷保存率的影響如圖2所示。
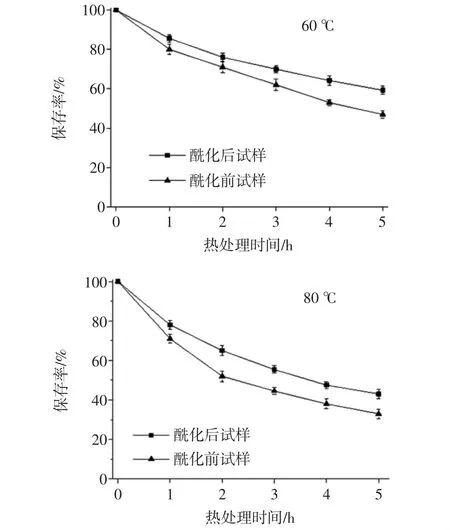

圖2 酶促酰化對錦葵啶葡萄糖苷熱穩定性的影響Fig.2 Effects of enzymatic acylation on the thermal stability of malvidin glucoside
由圖2可見,無論是酰化還是未酰化的樣品,花色苷保存率隨著加熱溫度的升高和加熱時間的延長均呈下降趨勢,但酶促酰化樣品下降較為遲緩。經過CAL-B酶促酰化后的錦葵啶葡萄糖苷溶液,在加熱條件為60、80、100℃的處理過程中,花色苷保存率顯著高于酶處理前(p<0.05)。100℃熱處理5 h,其花色苷保留率為37%,而未酰化樣品僅為20%,這表明在加熱條件下,酶促酰化使錦葵花色苷單體的熱穩定顯著提高,提高了花色苷單體的熱穩定性。
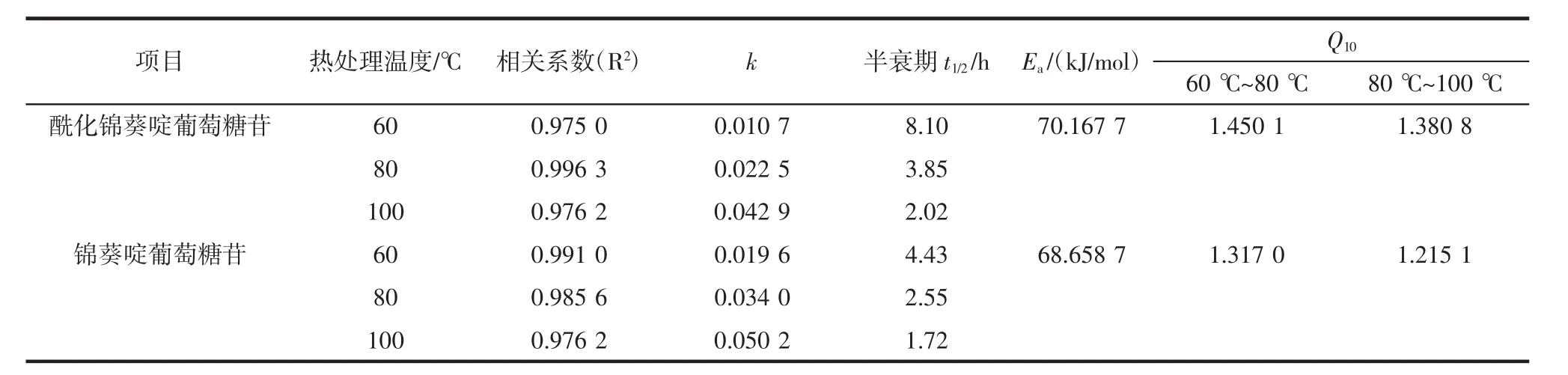
表1 酶促酰化對錦葵啶葡萄糖苷熱降解動力學參數的影響Table1 Effects of enzymatic acylation on the thermal degradation kinetics parameters of malvidin glucoside
2.2 酶促酰化對刺葡萄花色苷單體熱降解動力學參數的影響
2.2.1 酶促酰化錦葵啶葡萄糖苷單體熱降解動力學特征及熱降解動力學參數
分別用錦葵啶刺葡萄花色苷單體以及酶促酰化錦葵啶刺葡萄花色苷單體樣品,以-ln(Ct/C0)為縱坐標,熱處理時間t為橫坐標作圖線性回歸得到相關系數R2,兩者一級反應模型下的相關系數均R2>0.97,錦葵啶葡萄糖苷及其酶促酰化產物熱降解規律線性關系良好,符合熱降解動力學特征。酶促酰化對錦葵啶葡萄糖苷熱降解動力學參數的影響見表1。
由表1可知,酶促酰化處理錦葵啶刺葡萄花色苷單體前后兩者一級降解常數k數值均隨著溫度的升高均增大;半衰期t1/2隨著熱處理溫度升高急劇下降,符合花色苷一般熱降解規律。其次,酶促酰化能減少溫度對花色苷自聚合穩定作用的干擾,提高分子內輔色效應和提高溶液體系的耐熱性。在不同加熱溫度條件下,經酶促酰化處理的錦葵啶刺葡萄花色苷單體k值均小于未經處理的花色苷單體;同樣,經酶促處理的花色苷單體溶液半衰期時間也均大于未經處理的。當處理溫度為60℃時尤為明顯,經過酶促處理花色苷單體半衰期為8.10 h遠大于未經酶促處理花色苷單體溶液的4.43 h。
3個溫度(60,80,100℃)熱處理下酶促酰化錦葵啶葡萄糖苷半衰期比未酰化的樣品分別延長3.67、1.3、0.3 h。最后,在發生自聚合的花色苷溶液中,Ea(酶促酰化錦葵啶葡萄苷單體溶液)>Ea(錦葵啶葡萄苷單體溶液),Ea值分別為 70.167 7、68.658 7 kJ/mol。
Q10值反映了樣品熱反應速率常數k值對溫度升高的敏感程度。當加熱溫度從60℃提高至80℃、80℃提高至100℃時,花色苷的降解速度總體加快。酶促酰化后錦葵啶葡萄糖苷的Q10值相比未酰化樣品稍大,說明酶促酰化處理能提高花色苷在特定加熱溫度下的熱穩定性,但對鈍化其對加熱溫度變化的敏感性沒有明顯作用。
2.2.2 錦葵啶葡萄糖苷熱降解動力學方程的建立
根據表1的參數建立酶促前后錦葵啶葡萄糖苷自聚合熱降解動力學方程,即錦葵啶葡萄糖苷及酶促酰化產物熱降解動力學預測模型見表2。

表2 錦葵啶葡萄糖苷熱降解動力學方程式Table2 Thermal degradation kinetic equations of malvidin glucoside
2.3 酶促酰化對錦葵啶葡萄糖苷加熱條件下色差的影響
多數研究只對分子修飾后的花色苷的最大吸光度值進行檢測。要全面了解花色苷的熱穩定特性,對其呈色變化進行分析非常必要。研究選取80℃熱處理的樣品,進行色差指標的檢測,對比分析酶促酰化對錦葵啶葡萄糖苷呈色的影響。
2.3.1 酶促酰化對錦葵啶葡萄糖苷加熱條件下亮度L*的影響
80℃熱處理5 h內,錦葵啶葡萄糖苷樣品的亮度L*值如圖3所示。
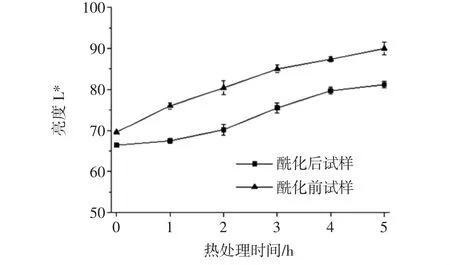
圖3 酶促酰化對錦葵啶葡萄糖苷樣品亮度L*的影響Fig.3 Effects of enzymatic acylation on L*of malvidin glucoside samples
由圖3可知,在熱處理條件下,酶促酰化前后的錦葵啶葡萄糖苷L*變化略有不同,但基本呈現相同規律。即隨著熱處理時間延長,亮度增加,花色苷顏色變淡。這與熱處理花色苷單體變化的規律結果相同,花色苷含量與L*值呈負相關性。其中,酶促酰化提高花色苷單體穩定性,錦葵啶刺葡萄花色苷單體亮度L*變化率(29.3%)遠大于酶促酰化處理的花色苷單體(22.3%)。
2.3.2 酶促酰化對錦葵啶葡萄糖苷酶熱處理條件下紅綠色調a*的影響
80℃熱處理5 h內,錦葵啶葡萄糖苷樣品的紅-綠色調a*值如圖4所示。

圖4 酶促酰化處理對錦葵啶葡萄糖苷樣品a*的影響Fig.4 Effects of enzymatic acylation on a*of malvidin glucoside samples
由圖4可知,隨著熱處理時間延長,錦葵啶花色苷a*變化規律與L*相反,即隨著熱處理時間延長,a*值降低,花色苷紅色色調變淡。但經酶促酰化引入外源酰基基團后,酰化錦葵啶花色苷a*值增加到19.02(未酰化錦葵啶花色苷a*值為17.21),與糖苷化與酰化能增強花色苷紅色色調研究結論相符[11]。并且,經酶促酰化后的錦葵啶葡萄糖苷熱穩定性更好。雖然a*值均隨著時間增長而減少,與未經酶促酰化的錦葵啶葡萄糖苷相比,變化幅度較小,下降速率更慢。
2.3.3 酶促酰化對錦葵啶葡萄糖苷熱處理條件下黃藍色調b*的影響
80℃熱處理5 h內,錦葵啶葡萄糖苷樣品的黃-藍色調b*值如圖5所示。
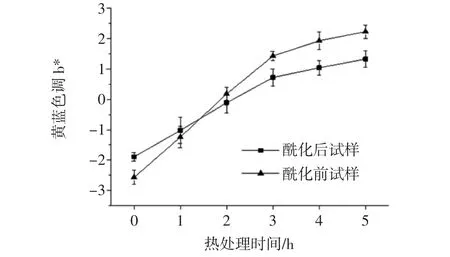
圖5 酶促酰化處理對錦葵啶葡萄糖苷樣品b*的影響Fig.5 Effect of enzymatic acylation on b*of malvidin glucoside samples
由圖5可知,隨著熱處理時間延長,錦葵啶葡萄糖苷以及經過酶促酰化葡萄糖苷溶液b*值變化均呈上升趨勢,藍色色調減弱,黃色色調增加,總體變化量酶促酰化后試樣整體變化量b*(3.22)小于酰化前試樣變化量b*(4.80);其次,經酶促酰化后錦葵啶葡萄糖苷b*值由(-2.57)變化到(-1.89),藍色色調增加。
3 討論
酰化前后錦葵啶葡萄糖苷熱降解反應仍符合一級反應動力學模型,與文獻報道的黑莓汁、桑葚等中的花色苷熱降解規律相一致[12-13]。無論是酰化還是未酰化的花色苷,隨著加熱溫度升高,花色苷溶液的穩定性呈下降趨勢,降解速率加快。有研究解釋說明花色苷發生熱降解失色,是由于花色苷母核結構受溫度影響,水解變成甲醇假堿形式,花色苷結構平衡被打破轉化成無色查爾酮結構[14-15]。研究表明,花色苷含量與a*值呈正相關性,與L*值呈負相關性,所以加熱條件下花色苷樣品的呈色指標發生相應變化,本文研究與相關文獻結論相符[16]。研究還發現,酶促酰化提高了錦葵啶葡萄糖苷的熱穩定性,可能是引入的外源酰基基團能降低花色苷分子的極性,而且由自身立體構型產生阻礙作用,降低花色苷對親核攻擊的敏感度。
4 結論
錦葵啶葡萄糖苷以及酶促酰化產物在熱處理條件下,降解規律均符合一級反應動力學模型,但酶促酰化反應提高了錦葵啶葡萄糖苷的熱穩定性。在中等溫度條件下,酰化錦葵啶葡萄糖苷自聚合效應使其耐熱性提高,但長時間處于高溫條件下,花色苷仍易分解。但酶促酰化處理延長花色苷的半衰期,且酰化樣品活化能Ea(70.167 7 kJ/mol)大于未酰化樣品Ea(68.658 7 kJ/mol);但高溫處理條件下,酶促酰化降低花色苷對溫度變化敏感度較未酰化錦葵啶葡萄糖苷不明顯。熱處理后錦葵啶葡萄糖苷受熱分解,花色苷含量降低,亮度L*值升高,a*值降低,b*值上升,經酶促酰化處理后的花色苷單體總體色差變化幅度較小。

