CCT在大鼠關節纖維化中的表達及其意義
易小友 何容涵 廖瑛揚 王哲 江詩海 王昆
關節纖維化是指關節手術或者關節長期制動導致的主動或被動的關節活動度(ROM)的喪失,臨床表現為持續性的主動及被動活動受限[1]。關節纖維化發生的機制目前尚未明確,公認的是,關節周圍原位成纖維肌活化并轉化為肌成纖維細胞[1-3]。組織學上主要表現為α-平滑肌肌動蛋白(α-SMA)陽性的肌成纖維細胞活化、聚集并分泌大量以Ⅰ型膠原為主的細胞外基質成分。因此,阻斷成纖維細胞向肌成纖維細胞的轉化、減少細胞外基質的沉積成為治療關節纖維化的主要方向。
含t復合多肽伴侶素亞基(CCT)是廣泛存在于真核細胞胞質中的一種重要分子伴侶,以維持相關蛋白在細胞內的正常功能[4-6]。任何亞基的變化均會導致細胞不同的生物學改變。前期研究顯示,CCT-7在成纖維細胞的活化過程中是高表達的,另有研究也顯示CCT-7在皮膚瘢痕形成、關節纖維化過程中亦是高表達的[4-6]。有研究顯示CCT-6參與皮膚瘢痕的形成[7]。CCT-6可以分為6a和6b。在肺的非小細胞肺癌中,CCT-6a已被證實能夠通過轉化生長因子-β(TGF-β)通路調節癌細胞的代謝,而TGF-β信號通路具有最強的致纖維化作用[8-10]。Rommelaere等[11]在動物的睪丸中最早發現CCT-6b高表達,但筆者見目前CCT-6b在纖維化方面缺乏相關研究,因此在本研究中,通過篩查關節纖維化的成纖維細胞中CCT家族各個亞基的表達,探索各亞基在關節纖維化中的可能作用,為臨床上治療關節纖維化指明方向。
材料與方法
一、主要實驗試劑
全蛋白提取試劑盒、蛋白定量試劑盒、細胞增殖及毒性檢測試劑盒(CCK-8試劑盒)購自Keygen公司,總RNA提取試劑盒購自Invitrogen公司,實驗抗體均購自Abclonal公司,一步法PCR試劑盒購自Takara公司,引物合成由谷歌生物公司合成。
二、方 法
1.關節纖維化動物模型的建立
本動物實驗通過中山大學附屬第三醫院醫學倫理委員會批準。成年SD大鼠(雌性)12只,體質量280~320 g,取其右下肢為固定組,左下肢為對照組。固定組以1%戊巴比妥鈉5 ml/kg腹腔注射麻醉后,沿膝關節內側切開皮膚,分離皮下組織和肌肉,顯露股骨遠端、膝關節內側及脛骨近端。保持膝關節屈曲至45°左右時放置聚甲醛樹脂板(POM板),以1.1 mm電鉆于股骨內側遠端、脛骨內側近端鉆孔,用POM板及2枚直徑1.2 mm、長16 mm不銹鋼螺釘將膝關節固定約45°(圖1A),隨后縫合傷口。對照組不作處理。在8周時間內常規飼養大鼠(圖1B)。
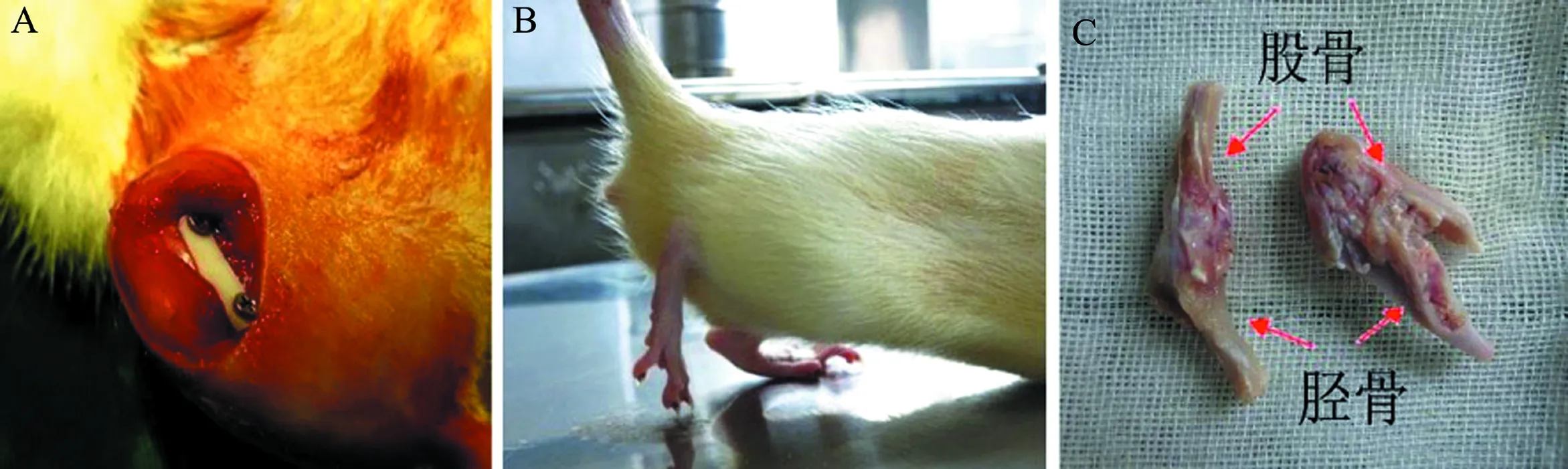
圖1 大鼠膝關節纖維化模型的建立
2.大鼠膝關節最大伸直角度的測量
手術8周后,采用頸椎脫臼法處死大鼠,取出不銹鋼螺釘和POM板,小心剔除膝關節周圍的肌肉、韌帶等組織,保證膝后方關節囊完好。用角度測量器測量固定組和對照組膝關節的活動度(ROM),完全伸直的膝關節記為180°,比較2組膝關節的最大伸直角度,以評估關節纖維化的嚴重程度(圖1C)。
3.大鼠膝關節囊原代細胞的培養
分離大鼠膝關節后方關節囊,用大量含雙抗(100 U/ml青霉素,100 μg/ml鏈霉素)的磷酸鹽緩沖液(PBS)沖洗組織塊,去除肌肉、肌腱、脂肪等周圍組織,將組織剪碎成1 mm×1 mm大小,均勻鋪至25 cm2培養瓶底部,倒置放入體積分數為5%二氧化碳的37 ℃細胞培養箱中,約3 h后取出,組織塊貼壁后再加入含10%胎牛血清的高糖Dulbecco改良Eagle培養基(DMEM),將培養瓶平置放入培養箱中。每隔2 d取出換液。約第7日可鏡下觀察到部分貼壁組織塊周邊有成纖維樣細胞爬出,約第14日,可見成纖維樣細胞大量接觸成片,即為原代成纖維細胞。常規消化細胞傳代,放入培養箱中進行細胞培養,此后每隔2 d取出細胞換液1次。
4.Transwell細胞遷移實驗
取2組細胞饑餓培養12 h,調整細胞密度為2.5×105個/ml,取200 μl細胞懸液加入Transwell小室中,下層小室加入600 μl含10%胎牛血清的高糖DMEM,每組細胞設置4個復孔,置于細胞培養箱培養。24 h后取出上層小室,用PBS清洗2次,再用4%多聚甲醛固定10 min后,清洗小室2次,用0.1%結晶紫染色15 min,洗去多余染劑,置于倒置顯微鏡下觀察,隨機選取5個高倍鏡視野(×100)進行拍照及細胞計數。以穿過Transwell小室微孔細胞的數量代表該組細胞的遷移能力。
5.CCK-8細胞增殖實驗
取2組細胞調整細胞密度為1×105個/ml,取100 μl細胞懸液加入96孔板中,每組細胞設置5個復孔,置于細胞培養箱培養。24 h后取出96孔板,按試劑盒說明書操作。用酶標儀在450 nm波長下測定吸光度(OD450)在各個孔的讀數,計算每組細胞的增殖活力。
6.蛋白免疫印跡試驗
采用蛋白免疫印跡實驗檢測2組成纖維細胞的α-SMA、Ⅰ型膠原蛋白(COL-1)表達水平及CCT家族各亞基表達水平。提取2組細胞總蛋白溶液,根據目的蛋白分子量選擇分離膠為12%濃度、濃縮膠5%濃度,設定電壓80 V電泳30 min,待樣品進入分離膠后改電壓為120 V電泳約30 min。按恒定電流200 mA轉膜60 min,用TBST配制5 % 脫脂牛奶作為封閉液,封閉1 h。按1∶1 000稀釋一抗,4 ℃孵育過夜。按1∶5 000稀釋二抗,室溫孵育60 min。洗膜后取出浸沒于5 ml增強化學發光法(ECL)發光液中約1 min,可置入Fluor Chem M多色熒光蛋白免疫印跡成像系統,進行自動曝光成像。
7.實時熒光定量PCR
采用實時熒光定量PCR檢測2組細胞的CCT家族各亞基基因表達,提取2組細胞的總RNA,使用一步法反轉錄試劑盒(One Step SYBR Prime Script RT-PCR Kit),根據目的基因的序列設計并合成引物,按試劑盒說明書操作,組成20 μl real-time PCR反應體系,以甘油醛-3-磷酸脫氫酶(GAPDH)作為內參(表1)。應用Applied Biosystems 7500 Fast實時熒光定量PCR系統,按說明書設定條件。PCR反應共進行40個循環。待反應結束后讀取每個孔的CT值做分析,以2-ΔΔCT計算2組細胞每個目的基因的mRNA的相對表達量。
三、統計學處理

表1 實驗使用的PCR引物序列
結 果
一、固定組與對照組大鼠膝關節最大伸直角度比較
術后8周時間內2組大鼠均無死亡、局部感染、固定松動等情況。拆除內固定后,比較2組膝關節的最大伸直角度,固定組12個關節的膝關節最大伸直角度為(97.7±6.5)°,對照組12個關節的膝關節最大伸直角度為(158.3±8.2)°,2組比較差異有統計學意義(t=17.570,P<0.001)。
二、固定組與對照組大鼠成纖維細胞的表型差異
組織貼壁法分離的原代細胞,細胞為長梭形的成纖維樣,經過消化傳代后,固定組和對照組細胞均為貼壁生長的成纖維樣,細胞外形、生長特點基本一致,呈長梭形。與對照組相比,固定組細胞觸角伸展更多,體積更大,細胞接觸相對更緊密,見圖2。
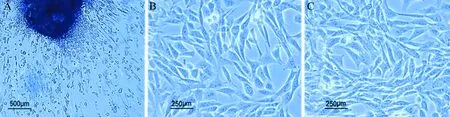
圖2 膝關節后方關節囊原代成纖維細胞光鏡下形態
三、固定組與對照組大鼠成纖維細胞遷移能力比較
Transwell細胞遷移實驗結果顯示,固定組細胞在高倍鏡(×100)視野下平均遷移出小室的細胞數量為(84±7)個、對照組成纖維細胞為(51±5)個,2組比較差異有統計學意義(t=11.635,P<0.001)。即固定組成纖維細胞遷移能力增強,見圖3。
四、固定組與對照組大鼠成纖維細胞增殖活力比較
固定組成纖維細胞的OD450為1.131±0.016,對照組為0.698±0.018,2組比較差異有統計學意義(t=18.010,P<0.001),見圖4。
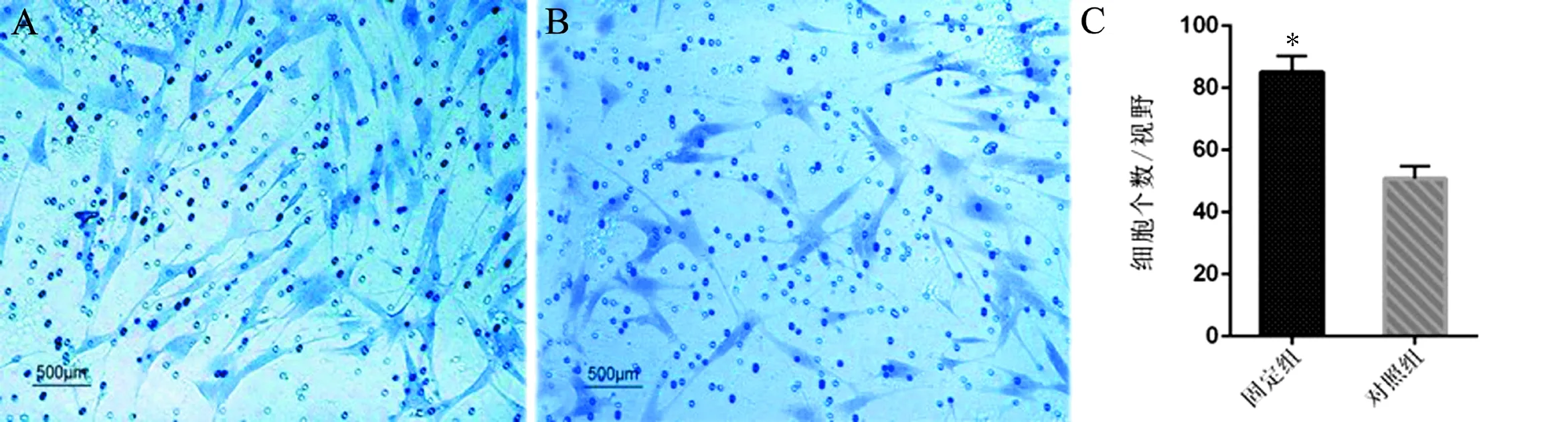
圖3 Transwell細胞遷移實驗結果
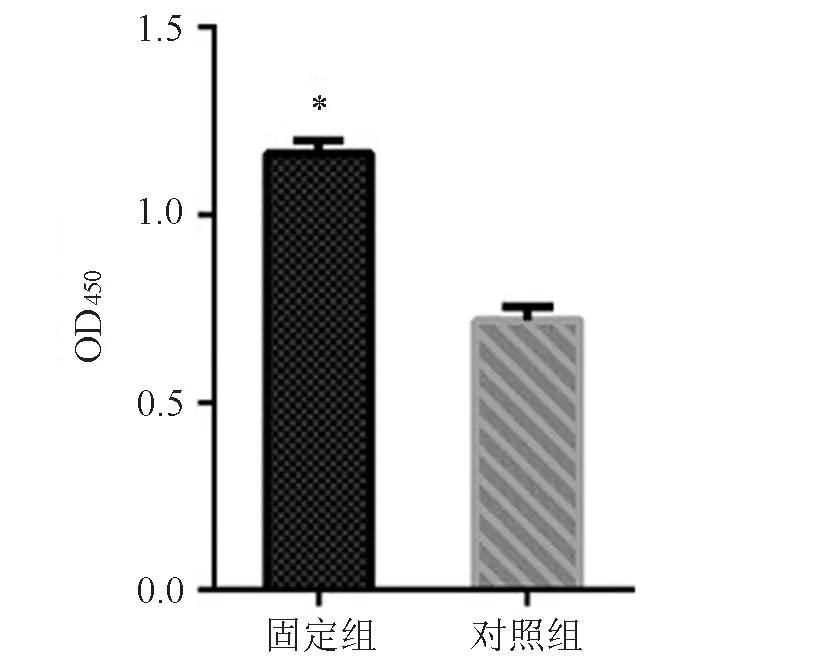
圖4 細胞增殖實驗結果
五、固定組與對照組大鼠成纖維細胞α-SMA、COL-1表達的比較
固定組α-SMA表達灰度值為0.482±0.025,對照組為0.130±0.007,2組比較差異有統計學意義(t=13.57,P<0.001);固定組COL-1表達灰度值為1.235±0.060,對照組為0.356±0.019,2組比較差異有統計學意義(t=13.96,P<0.001),見圖5A。
固定組α-SMA的基因表達為對照組的(5.399±0.096)倍(t=44.65,P<0.001);COL-1的基因表達為對照組的(1.615±0.050)倍(t=12.28,P<0.001),見圖5B。
六、固定組與對照組細胞表達CCT家族各亞基情況的比較
固定組成纖維細胞CCT-6b蛋白表達灰度值較對照組低(P<0.001),CCT-1、CCT-2、CCT-4、CCT-6a、CCT-7則較高(P均<0.05),見表2、圖6。
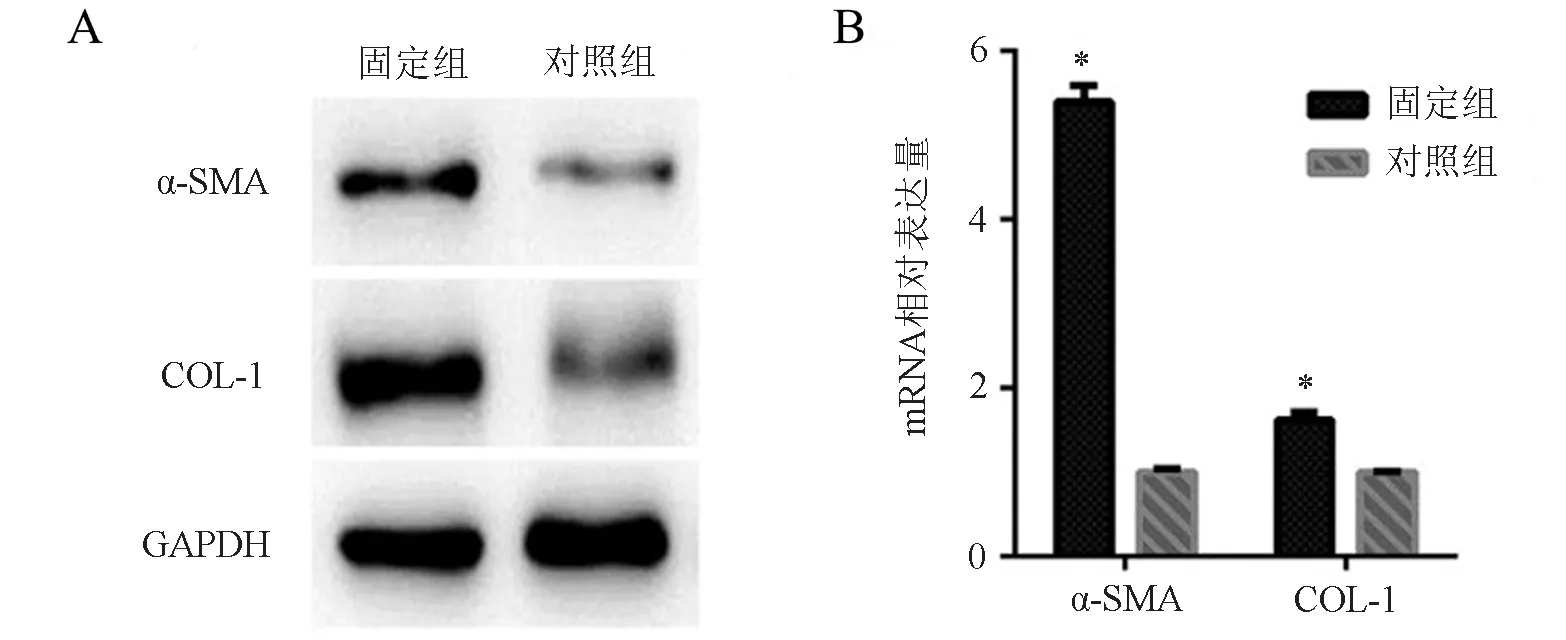
圖5 α-SMA、COL-1蛋白和基因表達情況
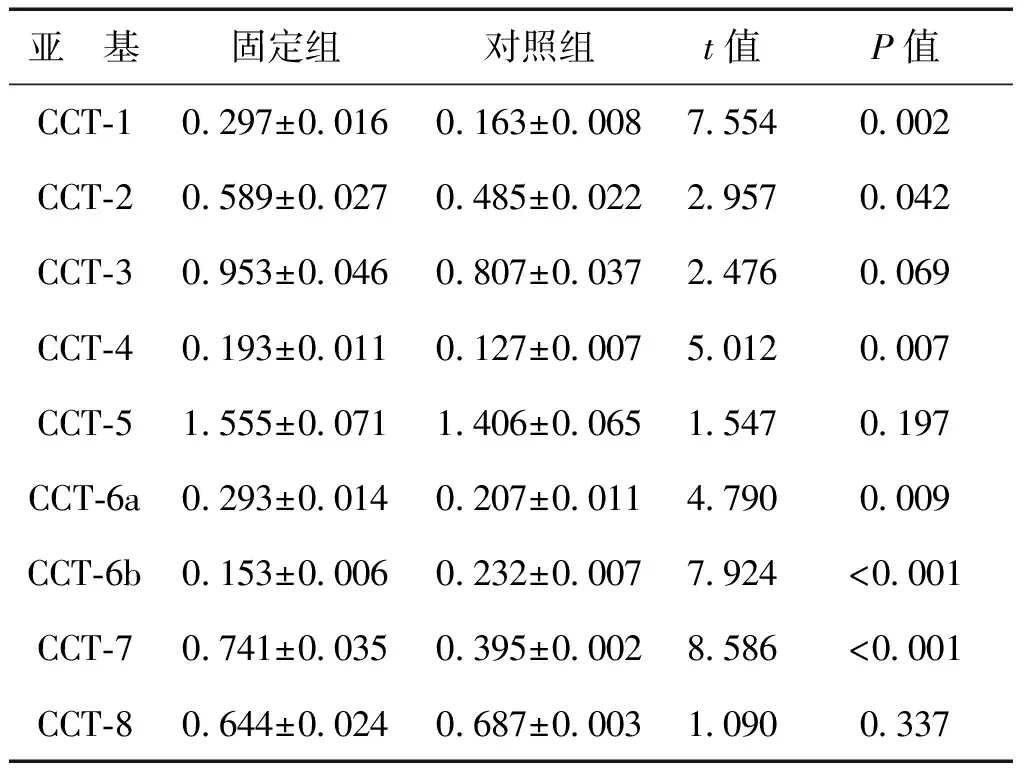
表2 固定組與對照組大鼠CCT各亞基蛋白表達灰度值比較
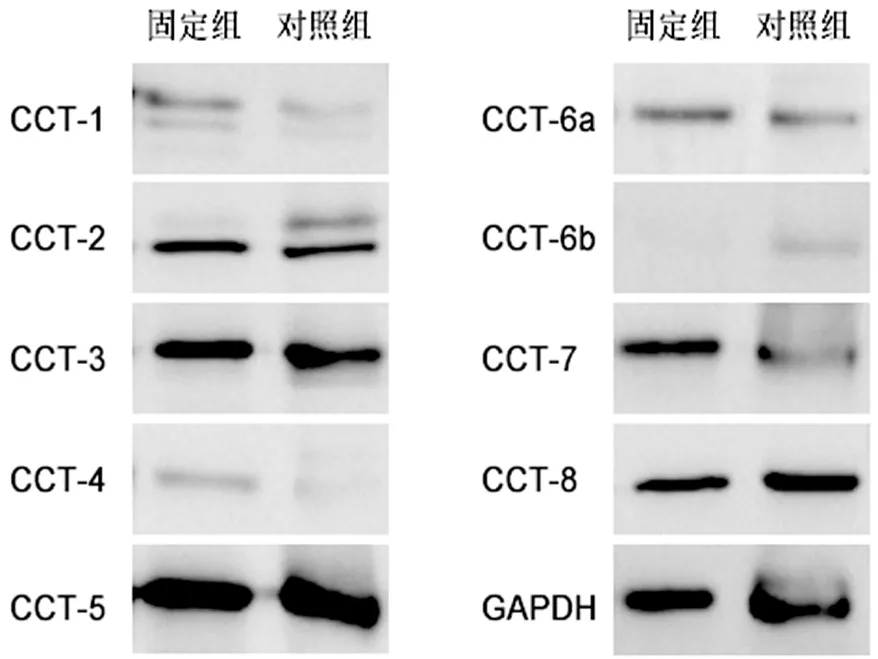
圖6 蛋白免疫印跡顯示CCT家族各亞基的蛋白表達變化
七、固定組與對照組大鼠細胞表達CCT家族各亞基基因表達的比較
固定組成纖維細胞CCT-6b基因表達較對照組低(P<0.001),CCT-7基因2組比較無差異,其余亞基固定組均較對照組高(P均<0.05),見表3、圖7。
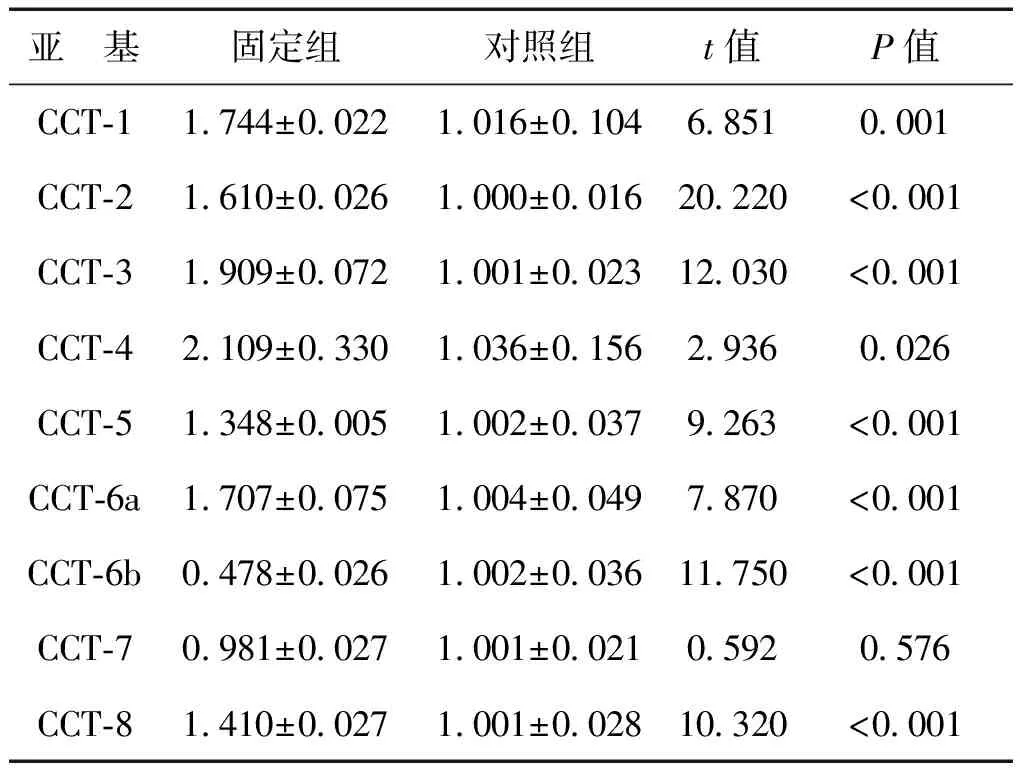
表3 固定組與對照組CCT各個亞基mRNA表達的相對定量值
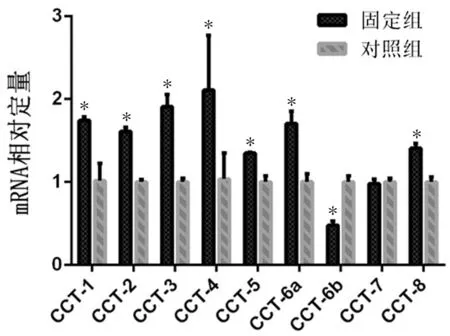
圖7 實時熒光定量PCR結果顯示CCT家族各亞基的基因表達變化,與對照組比較,*P<0.05
討 論
目前關節纖維化的治療方法主要是通過手術松解纖維組織以及物理治療,達到增加關節活動度的目的,但是物理治療效果不佳,手術也存在術后加重關節攣縮以及感染、出血等風險。既往研究表明,在心臟、肝臟、皮膚、肺臟等器官的纖維化過程中,成纖維細胞受到刺激轉化為肌成纖維細胞,表達并分泌大量α-SMA、COL-1,且細胞的增殖活力、遷移能力增強[1-3,12-13]。本研究結果顯示,在固定大鼠膝關節8周后,測量膝關節最大伸直角度發現固定組關節活動度降低,固定組細胞相對于對照組細胞在細胞表型上更接近于肌成纖維細胞,并且細胞遷移能力、增殖活力增高,在蛋白水平和基因水平上均表達更多的α-SMA、COL-1,以上結果均與既往研究結果相同[4]。因此,本研究大鼠膝關節纖維化動物模型建立成功,細胞適用于關節纖維化疾病的進一步研究。
CCT家族在真核細胞中普遍存在并參與了許多生物學過程。有研究者已證實CCT-7在纖維化疾病中是升高的,干擾CCT-7表達后細胞纖維化指標明顯下降[4]。在本研究中,筆者篩查了關節纖維化的成纖維細胞CCT家族各亞基的表達變化,發現與對照組比較,固定組CCT-6b蛋白和基因表達均較低,CCT-1、CCT-2、CCT-4、CCT-6a、CCT-7蛋白表達較高,CCT-1、CCT-2、CCT-4、CCT-6a基因表達較高。而Satish等(2008年)的研究證實,CCT-2在其它CCT亞基發生變化時的變化較小。目前缺乏CCT-6b在纖維化疾病中的相關研究,既往Walkley等(1996年)對CCT-6的研究顯示,CCT-6在折疊肌動蛋白和微管蛋白中具有關鍵作用,而且與CCT-3具有54%的基因相似程度。有研究顯示,在口腔黏膜損傷修復過程中,CCT-6的基因表達水平明顯高于未損傷的對照組[7]。另一項研究則顯示CCT-6基因在正常胎兒皮膚中高表達,而成年人皮膚中相對低表達,提示CCT-6可能與皮膚瘢痕形成(皮膚纖維化)有一定關系。因此在本研究中的大鼠關節纖維化模型中,固定組成纖維細胞CCT-6b表達下調可能是成纖維細胞活化過程的標志,提示了CCT-6b可能參與了成纖維細胞纖維化的過程,并可能是抗纖維化因子,但其中的具體變化還有待進一步實驗驗證。
目前關節纖維化的發病機制尚未闡明,其病理生理學過程未得到合理的解釋,這也是臨床上預防和治療關節纖維化效果不佳的主要原因。本研究通過構建關節纖維化動物模型,發現固定后的成纖維細胞遷移能力、增殖能力增強,表達α-SMA、COL-1增高,CCT-6b的蛋白和基因表達下調,提示CCT家族參與了關節纖維化的發生,其中CCT-6b可能作為抗纖維化因子參與了細胞纖維化過程。

