L-鼠李糖異構酶的研究進展及應用前景
陳佳俊,陳自衛,張文立,江波,張濤,沐萬孟
(江南大學,食品科學與技術國家重點實驗室,江蘇 無錫,214122)
L-鼠李糖異構酶(EC 5.3.1.14,L-rhamnose isomerase,L-RI)具有廣泛的底物譜,能夠可逆催化包括L-鼠李糖與L-鼠李酮糖以及D-阿洛糖與D-阿洛酮糖在內的多對五元、六元酮醛糖之間的異構化反應[1],在生物轉化法生產稀有糖中具有重要作用。稀有糖(rare sugar)是一類重要的碳水化合物,在食品、醫藥、化工等領域中具有非常重要的作用。國際糖協會(ISRS)對稀有糖的定義為“在自然界中存在但含量極少的一類單糖及其衍生物”[2]。D-阿洛糖是一種很有應用前景的稀有糖,其在結構上和D-葡萄糖在C-3互為差向異構體,同時和D-阿洛酮糖互為醛酮糖異構體(見圖1),具有清除活性氧自由基、抑制高鹽誘導類高血壓、冷凍防護、免疫抑制、抑制腫瘤、抗炎癥等生理功能[3]。

圖1 D-葡萄糖、D-阿洛糖和D-阿洛酮糖的Fisher投影式Fig.1 Fisher projection formulas of D-glucose, D-allose and D-psicose
研究表明,L-RI在生物法工業化生產D-阿洛糖中具有巨大的潛力,文中綜述了近年來國內外關于L-RI的結構功能、催化機理、酶學性質及其應用于生物法生產D-阿洛糖方面的研究進展。
1 L-RI的結構
KORNDORFER等人在2000年首次通過多重同晶置換法成功解析了來自大腸桿菌(E.coli)的L-RI晶體結構(PDB登錄號:1D8W)[4]。來自E.coli的L-RI在晶體中以緊密的四聚體形式存在(見圖2-a),表觀相對分子質量在188 kDa左右,E.coliL-RI的單亞基結構由420個氨基酸組成,亞基結構大體包括3個功能域:N-端結構域、中心結構域和C-端結構域。中心結構域是由8個α-螺旋(見圖2-b,α1-α8)和8個β-折疊(見圖2-b,β1-β8)共同組成的(β/α)8桶狀核心區域。N-端和C-端的殘基通過幾段α-螺旋無規卷曲成一個小結構域(見圖2-b,藍色為N-端殘基,紅色為C-端殘基),參與單體間的相互作用及活性部位的構成。E.coliL-RI結構中還存在兩個可能用于金屬離子結合的位點,一個稱作“Zn2+”點,被認為是酶的底物結合位點,用于幫助穩定底物的構象,參與協調的關鍵氨基酸殘基為Glu234、Asp267、His294和Asp334;另一個“Mn2+”點則被認為是酶的催化位點,用于幫助質子轉移來實現底物的催化過程,參與協調的關鍵氨基酸殘基為His262和Asp296。這些組成L-RI活性中心的關鍵氨基酸殘基在已報道的L-RI中均高度保守。
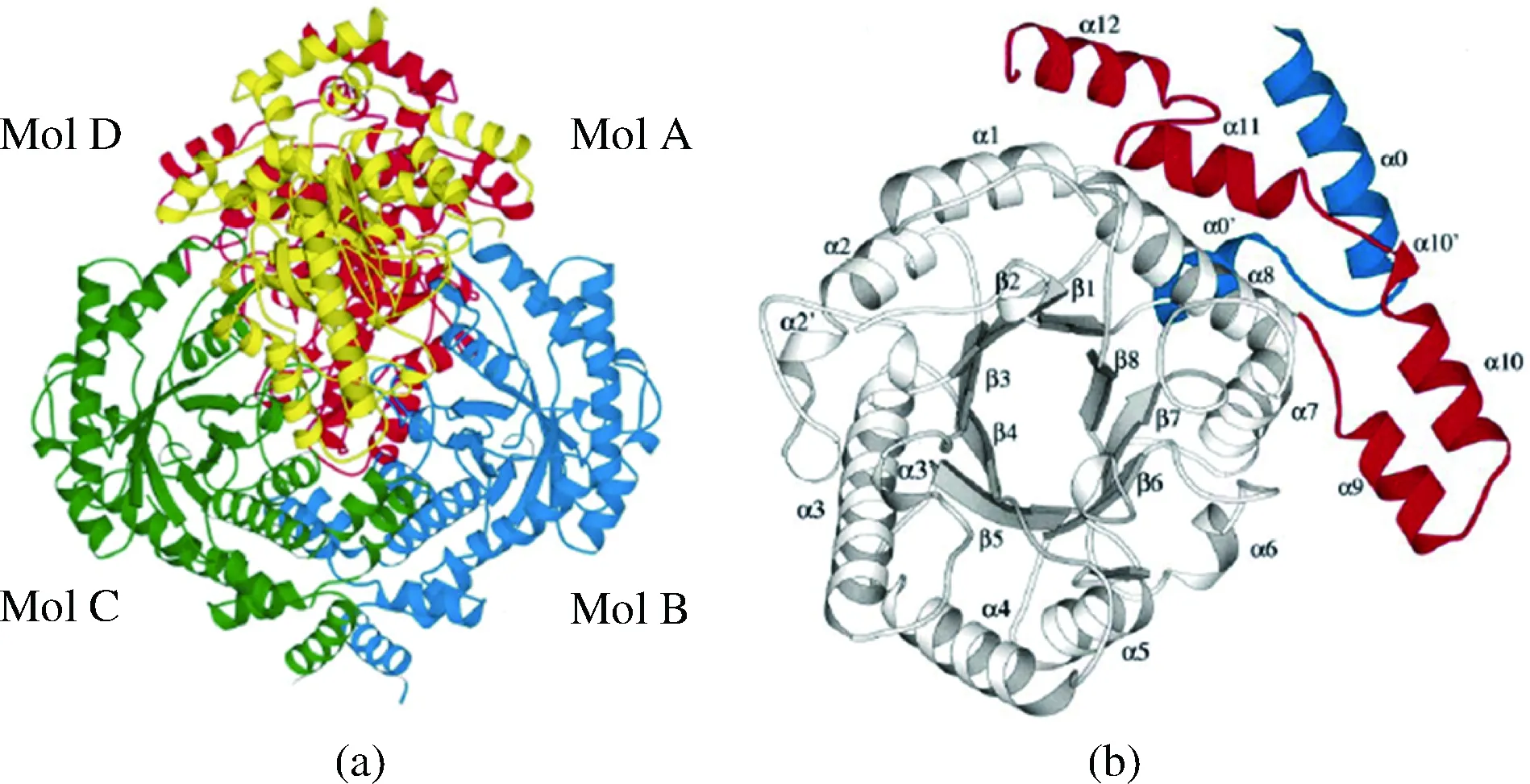
圖2 E. coli L-RI的四聚體結構(a)與亞基結構(b)[4]Fig.2 Tetrameric structure (a) and subunit structure (b) of L-RI from E. coli[4]
同時,海藻糖異構酶(fucose isomerase, PDB登錄號:1FUI)[5],磷酸甘油醛異構酶(triose phosphate isomerase, PDB登錄號:1TIM)[6],6-磷酸葡萄糖異構酶(glucose 6-phosphate isomerase, PDB登錄號:1PGI)[7],磷酸甘露糖異構酶(phosphomannose isomerase, PDB登錄號:1PMI)[8]和木糖異構酶(xylose isomerase, PDB登錄號:3XIM)[9]等醛酮糖異構酶的晶體結構已經被陸續報道。通過同源性比較發現,E.coliL-RI的晶體結構與木糖異構酶(D-xylose isomerase,D-XI)最為接近,序列相似度達到13%,推測二者來源于同一前體基因。二者的(β/α)8桶狀核心區域十分相似,但與D-XI不同的是,E.coliL-RI在活性中心區域周圍存在一些強疏水性的氨基酸殘基(Val53、Ile105、Tyr106、Phe336),這一特殊的疏水環境對應在底物的C-6附近,推測是用于底物識別,從而解釋了E.coliL-RI對L-鼠李糖的底物親和力高于L-甘露糖。
2 L-RI的催化機理
KORNDORFER等人通過對E.coliL-RI晶體結構的分析,推測金屬離子介導的負氫離子轉移機制可能是L-RI催化L-鼠李糖異構化生成L-鼠李酮糖的主要反應機制[4]。YOSHIDA等人又對P.stutzeri來源的L-RI晶體結構進行了解析,并研究了該酶與反應產物L-鼠李糖和D-阿洛糖在結晶狀態下的結合情況來推測其催化機理[10]。3年后該團隊又通過X射線結構分析,進一步對P.stutzeriL-RI的催化過程進行了研究,得到如圖3所示的催化預測過程[11]。
他們認為,L-RI活性中心的催化位點(見圖3 Mn2)存在兩種形式,即AD型和BC型(見圖3-A和圖3-D),并通過金屬離子位移的方式實現兩種形式之間的互換。其中AD型用于識別五元環的酮糖底物(見圖3-B),底物的O-1、O-2和O-3與金屬離子Mn1和Mn2形成配位鍵,Asp327參與呋喃糖的開環,并協助質子從O-2轉移至O-5。開環后,具有催化活性的水分子(W4)介入協助從O-1到O-2的質子轉移,再通過Trp179保護的負氫離子(H-)進攻C-2,實現酮糖到醛糖的異構化反應。而BC型則用于識別六元環的醛糖底物(見圖3-E),底物的O-2, O-3與金屬離子Mn1形成配位鍵。與AD型不同,參與吡喃糖開環的是具有催化活性的水分子。開環后,通過Mn2的位移使催化位點由BC型變為AD型,激活W4介入協助從O-2到O-1的質子轉移,再由H-進攻C-1,完成醛糖到酮糖的異構化反應。
3 L-RI的微生物來源及其酶學性質
3.1 L-RI的微生物來源
研究發現,L-RI廣泛存在于各種微生物中,包括E.coli[12]、Lactobacillusplantarum[13]、Pseudomonassp. strain LL172[14]、Pseudomonasstutzeri[15]、BacilluspallidusY25[16]、ThermoanaerobacteriumsaccharolyticumNTOU1[17]、ThermotogamaritimaATCC 43589[18]、MesorhizobiumlotiTono[19]、BacillushaloduransATCC BAA125[20]、CaldicellulosiruptorsaccharolyticusATCC 43494[21]、DictyoglomusturgidumDSMZ6724[22]、BacillussubtilisATCC 23857[23]、B.subtilisstr.168[24]、ThermobacilluscompostiKWC4[25]、CaldicellulosiruptorobsidiansisOB47[26]和Clostridiumstercorarium[27],表1給出了已經被報道的L-RI的十多種微生物來源,并概括了這些不同微生物來源的L-RI的酶學性質。

表1 不同微生物來源的L-RI酶學性質比較Table 1 Comparison of biochemical properties of L-RIs from various microbial sources
注:NR: 未見報道。
3.2 L-RI的酶學性質
3.2.1L-RI反應最適溫度
反應溫度是生物催化醛酮糖異構反應中一個非常重要的參數,D-阿洛糖與D-阿洛酮糖之間的異構化反應發生在較高的溫度可以適當提高反應速率,使反應平衡向生成D-阿洛糖的方向移動,提高產物產量,還可以降低D-阿洛酮糖的黏度,提高D-阿洛酮糖的溶解度。但是過高的溫度容易增加非酶褐變,生成副產物,導致生產成本大幅提高,無法滿足實際工業化生產的需求。
來源于不同微生物的L-RI的最適溫度均保持在較高的溫度(≥60 ℃),例如來自B.subtilisATCC 23857[23]、T.maritimaATCC 43589[18]和C.saccharolyticusATCC 43494[21]的L-RI,最適溫度分別為60、85和90 ℃。C.saccharolyticusATCC 43494[21]是迄今為止報道的最為耐熱的L-RI。但不同微生物來源的L-RI,其高溫耐熱性存在明顯差異,通過比較發現嗜熱微生物來源的D.turgidumDSMZ6724[22]、T.maritimaATCC 43589[18]和C.saccharolyticusATCC 43494[21],其L-RI的最適溫度和高溫耐熱性相當高,具備工業化生產D-阿洛糖的潛力。
3.2.2L-RI反應最適pH值
目前已經被鑒定報道的十多種不同微生物來源的L-RI的最適pH均在中性及堿性范圍內。B.haloduransATCC BAA-125[20]、C.saccharolyticusATCC 43494[21]和T.saccharolyticumNTOU1[17],這三者來源的L-RI最適pH值均為7.0;來自M.lotiTono[19]和P.stutzeri[15]的L-RI,其最適pH達到9.0。而C.saccharolyticusATCC 43494[21]的L-RI在pH 6.0時僅能殘留20%左右的相對酶活。總體來說,目前鑒定報道的L-RI大多能在中性及堿性范圍內進行催化作用,在酸性范圍內催化活力相對較低。
目前工業上生物法合成D-阿洛糖主要是利用兩步酶反應來實現,先利用D-阿洛酮糖3-差向異構酶(D-psicose 3-epimerase, DPE)將D-果糖差向異構化為D-阿洛酮糖,再利用L-RI將D-阿洛酮糖酮醛異構化為D-阿洛糖[3]。因為DPE的最適pH值為7.5~9.0[28],L-RI最適pH值大多為7.0~8.5。所以D-阿洛糖的工業生產反應pH值最好為7.5~8.5之間催化環境不宜過堿,否則會大大增加底物的非特異性褐變,同時催化環境也不能過酸,過酸的情況下會對L-RI催化過程的質子解離產生不利影響。
3.2.3 金屬離子與L-RI
金屬離子是醛酮糖異構酶重要的輔因子,通常結合在酶的活性中心,對于醛酮糖異構酶蛋白空間結構的穩定具有重要作用。L-RI與其他醛酮糖異構酶一樣,通常需要金屬離子的參與來發揮酶活。研究表明不同微生物來源的L-RI大多數都呈現出嚴格的金屬離子依賴性,Mn2+和Co2+是常見的兩種依賴離子。如來自C.saccharolyticusATCC 43494和T.saccharolyticumNTOU1的L-RI,這兩種L-RI在當金屬離子濃度很低(0.1 mmol/L)或不添加金屬離子時,不具備催化活力,而適當添加Co2+則會明顯提高酶活力[17, 21]。
YOSHIDA[10]等人通過對P.stutzeriL-RI晶體結構的解析發現在L-RI的活性區域內,存在2個供金屬離子結合的位點(見圖4, M-1、M-2),金屬離子與配體結合形成六配位的畸變八面體構型,與M-1結合的配體包括Glu219、Asp254、His281、Asp327和2個水分子(W-1、W-2),與M-2結合的配體包括His257、Asp289和4個水分子(W-2、W-3、W-4、W-5)。結合位點M-1用于穩定底物的構象,促進酶與底物的結合;催化位點M-2用于幫助質子轉移來實現底物的催化。

圖4 P. stutzeri L-RI的金屬離子結合位點[10]Fig.4 Metal-binding site of the P. stutzeri L-RI[10]
3.2.4L-RI的酶反應動力學參數
L-RI具有廣泛的底物譜,能夠催化包括多對五元、六元酮醛糖之間的異構化反應,表2中比較了不同來源的L-RI對3種底物的動力學參數。
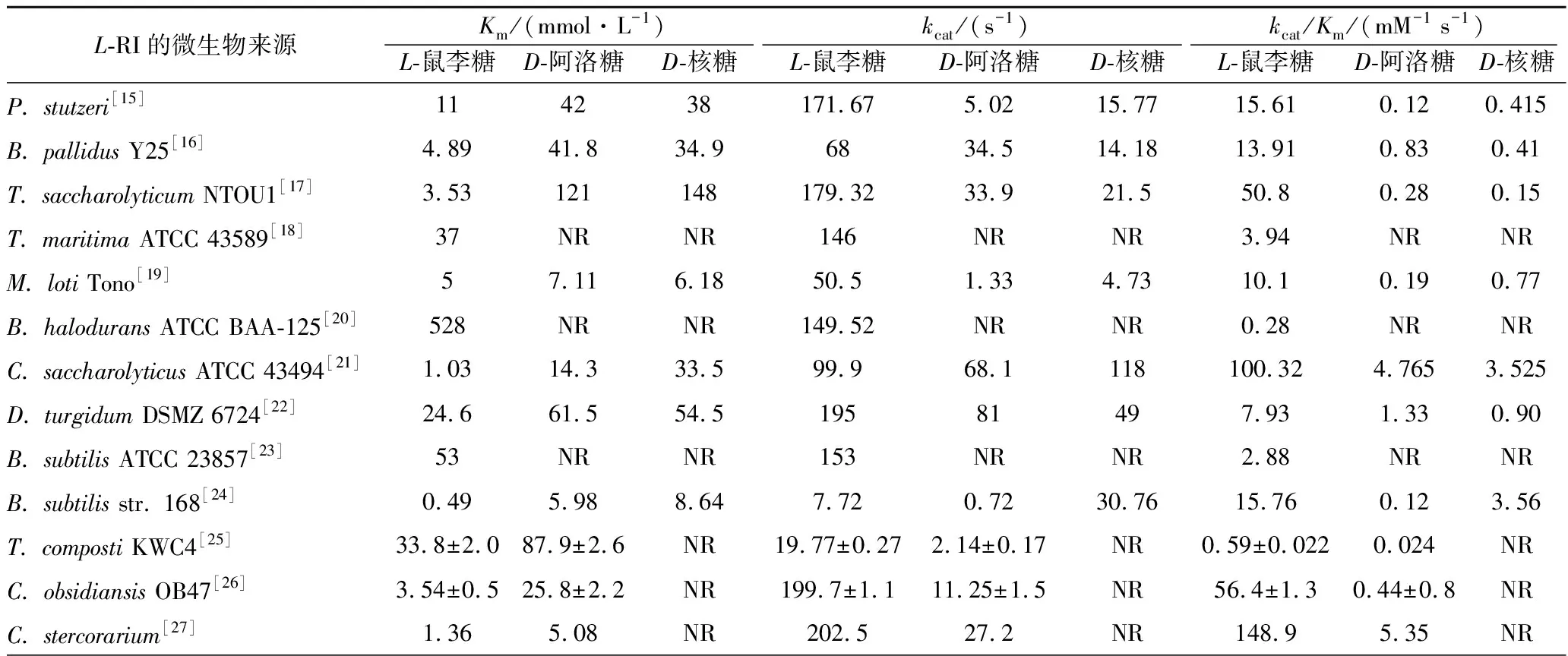
表2 不同微生物來源的L-RI動力學參數比較Table 2 Comparison of kinetic parameters of L-RI from various microbial sources
注:NR:未見報道。
所有報道的微生物來源的L-RI具備一個共同點,即對L-鼠李糖都有更高的親和力,更易催化L-鼠李糖到L-鼠李酮糖的異構化反應。同時,不同微生物來源的L-RI對各種底物的特異性存在一定的差異,例如來源于E.coli的L-RI能催化L-鼠李糖、L-來蘇糖和L-甘露糖的異構化反應,但D-阿洛糖和D-核糖都無法作為底物,而來源于P.stutzeri的L-RI則有著更廣泛的底物譜[4,10]。KORNDORFER和YOSHIDA等人通過對L-RI晶體結構的解析發現,E.coliL-RI中存在1個由Val53、Ile105、Tyr106和Phe336形成的特殊疏水腔來識別底物,導致其具有嚴格的底物特異性[4]。而P.stutzeriL-RI的底物結合位點與底物1、2和3位置的結合形式與E.coliL-RI一致,而與底物4、5和6位置的結合形式更接近于D-木糖異構酶(D-XI),不存在疏水腔,底物僅僅與鄰近的Phe66形成疏水相互作用,因而具有更廣泛的底物特異性[10]。
YOSHIDA等人還發現329位的絲氨酸(Ser)對于P.stutzeriL-RI催化過程的底物特異性影響較大。研究中,引入突變體S329F(突變為苯丙氨酸,等效對應于E.coliL-RI)、S329K(突變為賴氨酸,等效對應于D-XI)、S329L(突變為亮氨酸)和S329A(突變為丙氨酸,設計為空白對照)[29]。結果發現,突變體L-RI的米氏常數Km均有不同程度的增加,同時催化效率kcat/Km均有不同程度的降低,表明該位置影響著酶與底物的結合和催化。同時,還發現將P.stutzeriL-RI的C端截去2個殘基(I429、I430)后的突變體,其催化效率有了一定的提高,可能是由于疏水的C端正處于P.stutzeriL-RI亞基與亞基分子的表面,部分覆蓋了活性部位,阻礙了底物的結合以及產物的釋放。
4 L-RI與D-阿洛糖的生產
目前為止,利用不同微生物來源的酶進行D-阿洛糖合成的情況如表3所示。由表3可以發現,目前已經報道的能以D-阿洛酮糖為底物合成D-阿洛糖的微生物來源的酶主要包括半乳糖-6-磷酸異構酶(Galactose-6-phosphate isomerase, GPI),核糖-5-磷酸異構酶(ribose-5-phosphate isomerase, RPI)和L-鼠李糖異構酶(L-RI)。來自C.thermocellum和來自T.lettingae的RPI分別能夠在pH 7.5,50 ℃和pH 8.0,70 ℃下獲得33%和32%的平衡轉化率[32-34]。來自L.lactis的GPI能夠在pH 7.0,30 ℃下以100 g/LD-阿洛酮糖生成25 g/LD-阿洛糖,但其最適反應溫度較低,僅僅為30 ℃,且會伴隨副產物D-阿卓糖的生成[35]。P.stutzeriL-RI是最早報道的用以生產D-阿洛糖的L-RI。為了提高D-阿洛糖的生產效率,MENAVUVU和MORIMOTO等人利用戊二醛交聯法,對P.stutzeriL-RI進行了固定化,采用固定化酶連續反應器的方式后,P.stutzeriL-RI平衡轉化率由游離態下的25%,提高到了30%,但無論是游離態,還是固定化態,P.stutzeriL-RI在催化D-阿洛酮糖生產D-阿洛糖過程中始終伴隨著副產物D-阿卓糖的產生[30-31]。

表3 利用不同微生物來源的酶以D-阿洛酮糖為底物生產D-阿洛糖Table 3 D-allose production from D-psicose by enzymes from various microbial sources
繼P.stutzeriL-RI的研究后,對微生物來源的生產D-阿洛糖的L-RI的研究工作不斷開展。來自T.saccharolyticumNTOU1的L-RI,在pH 7.0,75 ℃時有最大酶活,轉化D-阿洛酮糖為D-阿洛糖時,平衡比例為66∶34,75 ℃時半衰期為2 h,無副產物產生[17]。重組T.compostiKWC4 L-RI最適pH為7.5,最適溫度為65 ℃,65 ℃半衰期為3.65 h,沒有副產物生成,平衡轉化率為23.34 %[25]。在目前報道的能以D-阿洛酮糖為底物生產D-阿洛糖的微生物來源的L-RI中,重組C.stercorariumL-RI具有最高的比活力和催化效率(kcat/Km),在pH 7.0,75 ℃時有最大酶活,轉化D-阿洛酮糖為D-阿洛糖時平衡轉化率為33%,時空產率高達79.6 g/(L·h),無副產物生成[27]。這些酶在pH值、耐熱性方面與P.stutzeriL-RI相比有了明顯改善,且催化D-阿洛酮糖生成D-阿洛糖的反應過程中沒有副產物的生成,減少了下游分離產物和底物的成本,因此在生物轉化法工業化生產D-阿洛糖中具有巨大的潛力。
由于生物法生產D-阿洛糖的底物——D-阿洛酮糖本身是一種很有應用前景的稀有糖,在食品、保健和醫療領域具有重要的應用價值[28],,因此將D-阿洛酮糖作為底物,生產代價過高,不能滿足工業化生產的要求。韓文佳等人提出的雙酶偶聯轉化系統,即利用D-阿洛酮糖3-差向異構酶(DPE)和L-鼠李糖異構酶(L-RI)雙酶偶聯反應,以2%的D-果糖為底物,反應經10 h達到平衡,得到D-阿洛酮糖和D-阿洛糖的產量分別為5.12和2. 04 g/L,將果葡糖漿等富含果糖的低附加值原料轉化為含有功能性稀有糖的高附加值混合糖液,是D-阿洛糖工業化生產中降低底物成本的有效方案[36]。
5 研究展望
雖然L-RI在生物轉化法生產D-阿洛糖中具有巨大的潛力,但要利用L-RI實現D-阿洛糖的大規模工業化生產,還有一些技術和方法需要進一步研究完善。
(1)分子改造方面。目前還沒有能在偏酸性范圍內催化D-阿洛酮糖轉化為D-阿洛糖的L-RI的報道,堿性的催化環境會增加底物的非特異性褐變,導致底物成本上升,不利于工業化生產;另外,目前被報道的微生物來源的L-RI大多都呈現出嚴格的金屬離子依賴性,催化時都需要二價金屬離子的存在來保證最大酶活,而過多添加金屬離子不利于L-RI的實際生產應用。
隨著L-RI 晶體結構的解析,進一步確定酶的反應機制及酶活性中心的氨基酸,并根據活性中心氨基酸殘基及可能影響酶活性中心的氨基酸殘基, 選擇性地進行定點突變設計以L-RI的最適pH以及減少L-RI對金屬離子的依賴性將對D-阿洛糖的工業化生產具有重要的現實意義。
(2)L-RI的固定化研究。盡管已有些較成熟的L-RI 的固定化方法被建立,但由于被研究的L-RI種類及固定化方法有限,固定化L-RI生產對D-阿洛糖的研究仍具有很大的空間。新種屬酶或分子改造的優質酶的不斷涌現及新固定化方法的研究都將會使固定化L-RI生產D-阿洛糖的技術不斷創新。
(3)食品級基因工程菌的構建與應用。L-RI的食品級基因工程菌的研究仍然是L-RI研究中未涉足的領域,大腸桿菌仍然是目前用于表達L-RI的首選宿主,但D-阿洛糖作為一種新型的功能性稀有糖,用大腸桿菌作為宿主菌存在著安全隱患,因此L-RI食品級基因工程菌的構建與應用將成為新的研究熱點。

