病毒類疫苗的無菌生產工藝布局
徐 哲 李錦秀
(中國航空規劃設計研究總院有限公司,北京100120)
0 引言
無菌是生物技術中的一個重要概念。培養基、發酵設備等只有處于無菌前提下,微生物接種后,才能實現純種培養,最終得到所需的產品。
生物疫苗可分為細菌類疫苗和病毒類疫苗。細菌類疫苗以培養、發酵工藝為主,病毒類疫苗以細胞培養、病毒擴增工藝為主,這兩類疫苗的工藝生產具有相似性。
本文針對不同生產工藝的、非最終滅菌的病毒類生物疫苗產品,對其生產車間的工藝布局進行了分析,提出了更經濟、更高效、更合理的工藝布局模式。
1 生產工藝流程及設備分析
1.1 工藝流程分析
病毒類疫苗的生產流程(圖1)可以分為以下幾個階段:(1)細胞復蘇培養及擴增,該生產過程為無毒生產過程;(2)細胞擴增到一定程度后進行細胞洗滌,并加入病毒液接種,然后帶毒培養,并不斷洗滌;(3)細胞培養好后,收集疫苗液;(4)如果制作滅活疫苗則需要進行病毒滅活、制作過程,如果生產活疫苗則不需要該過程;(5)配制疫苗原液;(6)分裝入庫。同時,病毒接種前需要經過復蘇培養及擴增階段。
1.2 工藝設備分析
目前,病毒類生物疫苗的原液生產工藝主要包括:轉瓶培養、細胞工廠培養以及生物反應器培養(罐培養)等。
轉瓶培養技術是傳統的細胞培養技術,工藝相對落后。現國內各企業通過工藝的優化升級,逐步將傳統的轉瓶培養工藝升級為細胞工廠培養或者生物反應器培養工藝。
細胞工廠培養技術,對貼壁細胞的大規模培養有著明顯優勢。首先,采用細胞工廠培養工藝,適用于擴大生產,無需添加生產設備,大大縮短了從研發到生產的時間。其次,細胞工廠培養工藝的一次性投入很少,無需大型昂貴設備,也無需復雜的管道設計。此外,細胞工廠培養工藝能夠靈活地根據市場需求,安排生產規模。因此,越來越多的疫苗生產廠家采用細胞工廠培養技術大規模培養細胞。
生物反應器培養技術,作為現階段比較先進的一種技術,與傳統的轉瓶培養技術以及細胞工廠培養技術相比,具有如下優點:(1)單位體積內的有效工作細胞數量增加;(2)全密閉、管道化的系統生產流程及過程自動化監控、控制技術,不僅減少了污染細胞的可能性,而且減輕了勞動力強度,減少了人為誤操作因素的影響;(3)生物反應器容積的擴大,提升了終端產品的均一性,結合后期純化工藝,不但產品產量明顯提高,產品質量也獲得提升;(4)生產疫苗所用勞動力和車間、水、電、原材料、能源等成本遠低于傳統的轉瓶培養工藝,綜合成本大大降低。

圖1 病毒類疫苗生產流程
2 不同生產工藝步驟的潔凈室級別
某一工藝步驟需滿足的潔凈室級別取決于各工藝步驟的執行情況,主要有兩種基本情況:開放系統的操作(開放工藝步驟)和密閉系統的操作(密閉工藝步驟)。
這兩種情況的具體設計理念如下:密閉工藝步驟要求產品在整個工藝步驟持續時間內裝在完全關閉、密封的容器(或罐等)中,需通過泄漏試驗對容器(或罐等)進行氣密性驗證。如有必要的話,可以采用經完整性檢測并且被用作阻擋容器(或罐等)外潔凈室空氣接觸的屏障——除菌級通風過濾器對容器(或罐等)進行通風。如果在密閉工藝步驟中必須向產品中添加物質或取樣,就需使用適當的無菌裝置,例如蒸汽穿閥裝置,一次性無菌連接、無菌取樣系統或熔管器/密封器。如果滿足這些前提條件,所有密閉工藝步驟可在D級環境下進行。D級是GMP指南中所定義的用于如CIP/SIP之前進行拆卸和組裝設備的最低潔凈室級別。
對于開放工藝步驟和系統,基于產品染菌風險,一般區分為兩種情況:
情況1:如果產品明顯暴露于潔凈室空氣中,就是完全開放的工藝步驟或系統。例如,產品置于瓶中,但瓶蓋被移開進行取樣;或產品置于罐中,但人孔(檢修孔)蓋被打開用于添加溶液。
情況2:關閉的但非密封的容器、罐等也被視為開放系統,相關工藝步驟也被定義為開放式步驟。例如,產品置于帶蓋的玻璃瓶中,但瓶和蓋之間沒有保證氣密性的膠墊。但此種情況下的產品染菌風險遠遠低于情況1。
通常情況下,產品滅菌前的開放式工藝步驟應該在C級環境下完成。C級比D級高一個級別(D級適用于密閉工藝步驟),更重要的是,C級是第一個對動態粒子有要求的房間級別。
產品滅菌前,上述情況2的系統/工藝步驟可以在C級潔凈室下進行,不需額外的保護處理。然而情況1的系統/工藝步驟,由于產品染菌的風險高,需要借助UAF(單向流)裝置進行額外的局部保護。
產品滅菌后,情況1的開放式工藝,需在B+A環境下進行(或A級隔離器,二選一)無菌操作。情況2的開放式工藝,不適用于無菌產品生產,需確保A級環境外的產品容器完全密封。
需要注意的是,所有不直接與產品生產相關的工藝步驟,即非關鍵步驟,如設備清潔、工裝清洗、滅菌密封等將在D級區完成。必要時,清潔品的開放處理可在D級區域內的UAF裝置保護下完成。
3 不同生產工藝的工藝布局分析
非最終滅菌的不可除菌過濾的病毒類生物疫苗產品,鑒于其產品特性,不可最終除菌過濾及滅菌,要求在原液生產過程中,在最后一步可除菌或滅菌工藝之后,全程無菌操作以滿足無菌要求。
非最終滅菌的不可除菌過濾的病毒類生物疫苗的生產工藝一般包括:轉瓶培養工藝、細胞工廠培養工藝以及生物反應器培養工藝。
3.1 轉瓶培養工藝的工藝布局
受傳統慣例、對GMP等法規認識不深、無菌概念不清晰等因素的影響,傳統的轉瓶培養工藝一般在C級環境下的局部層流保護下生產。
根據法規要求,C級環境下的局部層流保護環境,不可作為無菌操作環境,其層流保護下的環境不是無菌環境,在該環境下生產,產品染菌風險較高,影響產品質量及收率。
如按照無菌操作要求,將生產車間環境提升至B級背景下的A級環境,則會大大增加造價以及運行成本。由于轉瓶培養工藝的收率相對較低,在增加成本的同時,不能有效提高收率,因此車間整體的布局經濟性、可行性較低。
現階段各企業經過工藝優化升級,逐步淘汰了轉瓶培養工藝的大規模生產,僅在病毒培養等局部工藝或小規模生產中采用。傳統轉瓶培養工藝的車間局部工藝布局如圖2所示。

圖2 傳統轉瓶培養工藝的車間局部工藝布局
由圖2可以看出,傳統的轉瓶培養工藝均是在C級環境下的層流保護下進行,無菌環境的保證性較差。因此需對傳統的轉瓶培養工藝的工藝布局進行優化升級,如圖3所示。優化升級后的工藝布局,將裝瓶培養無菌操作設置在B級背景下的局部A級層流保護中,實現無菌操作,保證了產品質量。培養箱設備放置在低級別的D級區,開口設在B級區,在方便使用的同時,減少了對B級區的影響,便于設備維修、維護。退出部分設置前室,對操作間僅開設一個門,降低對操作間無菌環境的影響。
3.2 細胞工廠培養工藝的工藝布局
細胞工廠培養工藝在連接、換液等操作環節不能夠實現密閉操作。傳統的國內原液生產車間,以二倍體細胞狂犬疫苗為例,其車間工藝布局如圖4所示。將細胞培養、毒種接種以及培養等工藝設置在C級環境中,在C級背景下的局部層流保護下進行生產暴露操作,僅將最后的純化操作設置在B級環境下。這種操作不能實現無菌,染菌風險較大。由于二倍體狂犬病毒疫苗不可最終除菌過濾,生產過程如果不能實現全程無菌化操作,則產品質量不能得到有效控制。

圖3 優化升級后的轉瓶培養工藝車間局部工藝布局
D級環境下進行,因此有兩種選擇:
(1)將培養設置在B級環境下,這樣方便操作和使用,物料無需反復進出B級區,但能耗較大,在大規模生產中可行性不高。
(2)為了保證無菌環境,充分考慮能耗等因素以及物料如何有效進出B級區,B級區需要采用VHP滅菌、濕熱滅菌等有效的滅菌手段以控制無菌環境。根據VHP的特性,進出時長在1 h以上,不利于細胞、病毒的培養。同時,細胞工廠反復進出B級區,在增加工作量的同時,也不利于B級環境的保持。因此,考慮將操作間與恒溫室采用背靠背的模式,利用穿墻連接,實現物料在B級操作間內無菌操作的同時,在D級環境下培養。優化后的細胞工廠車間局部工藝布局如圖5所示。
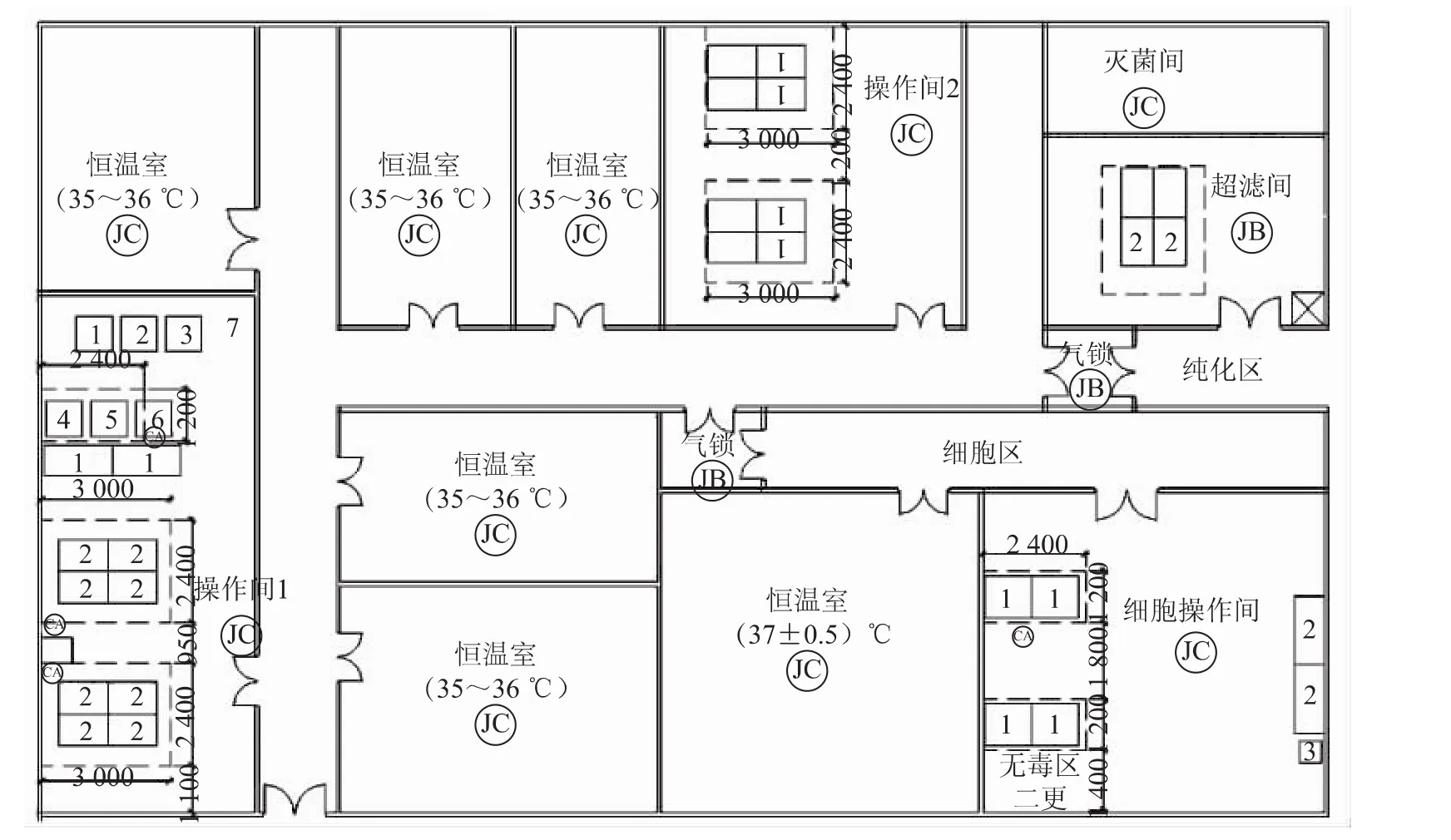
圖4 原細胞工廠培養工藝的生產車間局部工藝布局
根據無菌操作要求,原液生產一般在B級背景下的A級環境下完成。操作完成后,放置于恒溫室內恒溫培養一段時間后,反復進行換液等操作,若干次后收獲原液。恒溫培養時,細胞工廠處于密閉狀態,因此在D級環境下的恒溫室培養即可。
由于細胞操作在B級環境下進行,恒溫培養在
3.3 生物反應器培養工藝的工藝布局
根據反應器的性能及特點,生物反應器可分為兩類:一類是非全密閉反應器,即反應器本身培養過程是全密閉化的,但不可實現在線清洗等操作;另一類是全密閉反應器,即反應器可實現全密閉化生產、清洗、操作等。因此,需根據不同的反應器類型,有針對性地進行工藝布局。

圖5 優化后的細胞工廠車間局部工藝布局
非全密閉生物反應器,是一種多用于小規模生產下的小容量生物反應器,一般為玻璃等材質。根據無菌要求,其生產操作需要在B級背景下的A級環境中進行。非全密閉生物反應器局部工藝布局如圖6所示。

圖6 非全密閉生物反應器局部工藝布局
從圖6可以看出,非全密閉生物反應器的生產操作間為B級環境,能耗較大,適用于不可完全密封、在線清洗的操作場合。而生物反應器經過長期發展,優化升級,可實現全密閉培養和操作,實現在線清洗、滅菌等。通過生物反應器的優化升級,可降低對環境的要求,如果全過程實現密閉操作,則生產環境可降為D級,全密閉生物反應器局部工藝布局如圖7所示。
從圖7可以看出,全密閉生物反應器的生產操作間為D級環境,能耗較低。

圖7 全密閉生物反應器局部工藝布局
4 結語
隨著GMP的深入發展及其對產品質量要求的不斷提高,無菌概念越來越受到關注與重視。本文針對不同生產工藝要求的病毒類疫苗的無菌生產,對其工藝布局進行了分析和優化,提出了經濟、有效、可行性較高的工藝布局模式。在滿足無菌操作要求的基礎上,充分考慮車間運行成本,減少了高級別空調區域的面積,提高了工藝布局的經濟性與可行性。

