螺旋斷層和旋轉調強技術在小細胞肺癌*腦預防放射治療海馬保護的劑量學研究
黃 祥 徐 偉 陳高翔 曲寶林* 杜樂輝 馬 娜
小細胞肺癌(small cell lung cancer,SCLC)是常見的肺癌類型,初治患者腦轉移發生率為15%~20%,存活2年以上患者腦轉移發生率>80%[1]。腦預防放射治療(prophylactic cranial irradiation,PCI)可以推遲腦轉移時間,提高總生存率(overall survival,OS),尤其是對于放化療后達完全緩解(complete remission,CR)患者[2-3]。然而,PCI后多數患者會出現不同程度的記憶力和認知功能損害[4]。
目前,越來越多的研究表明,海馬區損傷是全腦放射治療(whole brain radiotherapy,WBRT)后神經認知功能障礙的主要原因[5-6]。隨著放射治療技術的進展,PCI同時避讓海馬區成為可能[7]。本研究探討螺旋斷層(TOMO)和旋轉調強(RapidArc)技術在SCLC的PCI海馬保護的劑量學特點,為臨床選擇理想的放射治療技術提供依據。
1 資料與方法
1.1 一般資料
選取2017年1-12月解放軍總醫院放射治療科收治的8例局限期SCLC患者,其中男性7例、女性1例;年齡51~71歲,中位年齡60歲。所有患者進行了至少4周期的化療及胸部放射治療,其中5例CR,3例部分緩解(partial remission,PR),增強磁共振成像(magnetic resonance imaging,MRI)掃描排除腦轉移,見表1。
1.2 儀器設備
采用大孔徑螺旋CT(德國西門子公司)掃描,采用Discovery 750W(3.0T)型MRI(美國GE公司)定位。
1.3 定位方法
患者取仰臥位,熱塑頭頸肩膜固定,大孔徑螺旋CT掃描。掃描范圍:上界為頭頂,下界為第3頸椎下緣,掃描層厚1 mm。同時行MRI定位,頭頸肩膜固定掃描,序列選擇BRAVO和CUBE,層厚1 mm。將獲得的三維CT及MRI圖像傳至MIM融合軟件。
1.4 靶區和危及器官的界定
參照國際放射輻射單位和計量測量委員會(international commission on radiation units and measurements,ICRU)發布的50號及62號文件勾畫靶區:全腦臨床靶區(clinical target volume,CTV),外擴3 mm,避開海馬區形成計劃靶區(planing target volume,PTV)。
常規勾畫危及器官(organ at risk,OAR),包括腦干、內耳、眼球、晶體、視神經及視交叉。
MIM軟件融合定位CT及MRI的BRAVO序列。勾畫雙側海馬,以側腦室下角首先出現的層面開始,勾畫內側的T1低信號灰質區,沿側腦室內下側走行,杏仁核在其前上方至四疊體池外側,向上延伸至側腦室下角內側中部,在側腦室底部繞脈絡膜裂形成一弓形隆起,最后形成“半月形”圖形,分別命名為Hip-L及Hip-R,外擴5 mm形成海馬減量區,命名為Hip-L-0.5及Hip-R-0.5,如圖1所示。
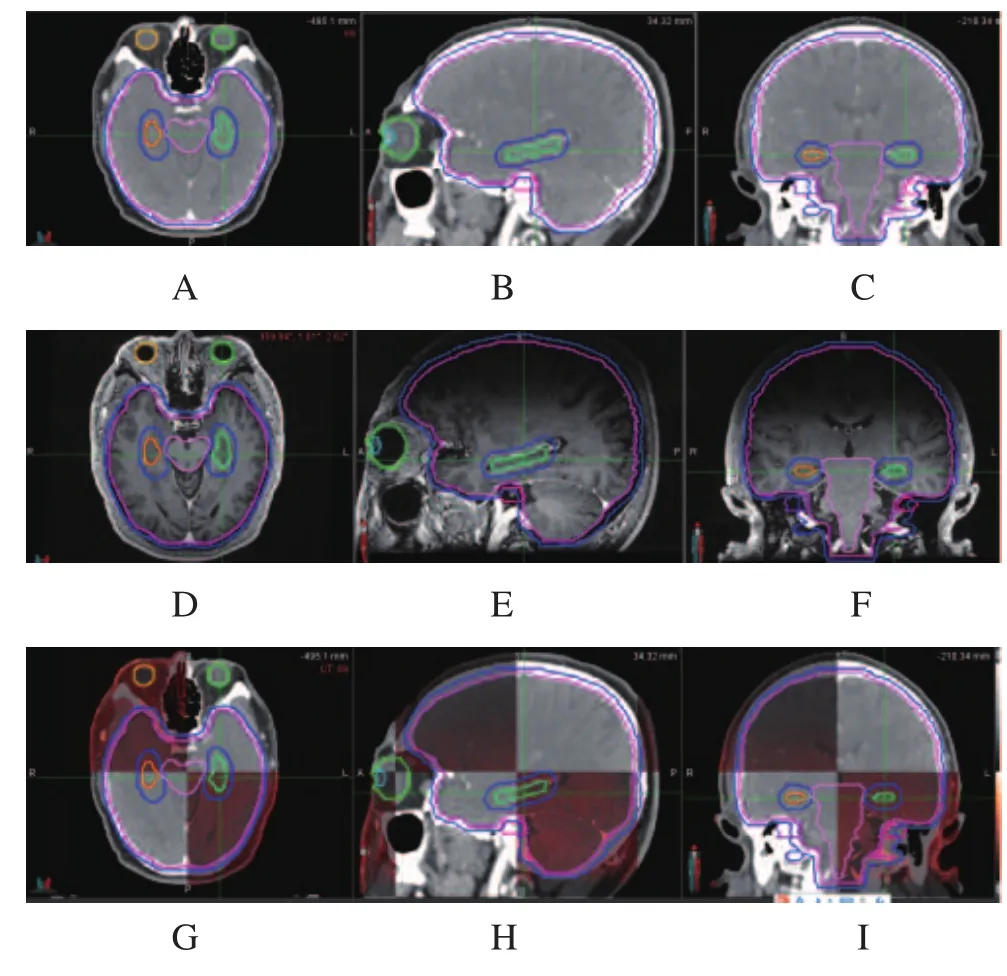
圖1 CT及MRI定位及融合圖像
1.5 處方劑量及OAR限量
(1)兩種放射治療計劃處方劑量均設定為25 Gy/10 F,要求至少95%的PTV接受處方劑量。
(2)OAR限量:晶體最大劑量(Dmax)<9 Gy,越小越好;海馬受量盡可能低,滿足Hip-L的Dmax<17 Gy,Hip-L的平均劑量Dmean<10 Gy;Hip-R的Dmax<17 Gy,Hip-R的Dmean<10 Gy。
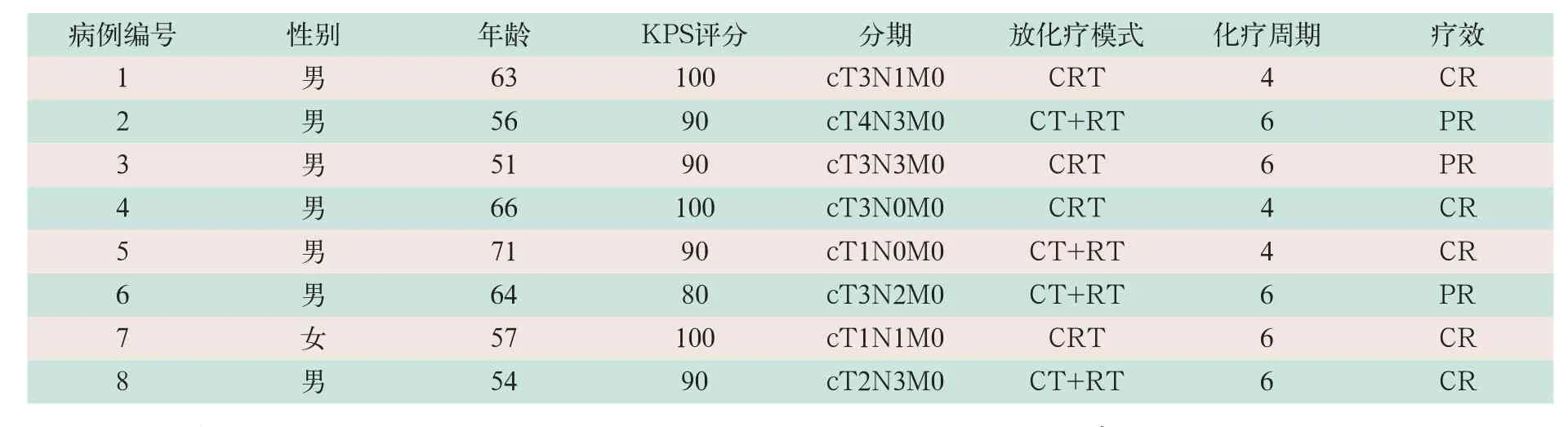
表1 局限期SCLC患者一般資料
1.6 放射治療計劃設計
(1)由2名物理師對每例患者的同一套CT圖像分別設計TOMO和RapidArc兩種計劃,并反復校準優化,在滿足最佳劑量分布的同時盡可能壓低周圍正常組織的受量。
(2)RapidArc計劃:采用4弧調強。
(3)TOMO計劃:鉛門寬度(field width)為2.5 cm,螺距(helical pitch)為0.35 cm,束流強度調制因子(modulation factor)為2.4,采用360°旋轉照射方式。
1.7 物理學參數和劑量學評估
(1)靶區適形指數(conformity index,CI)。CI值在0~1之間,CI值越小表明等劑量線包括的靶區體積越少;當CI值越接近1時,表明劑量線與靶區體積越貼合;當CI值為1時,等劑量線所包括的區域和靶區體積完全重合[8]。CI的計算為公式1:
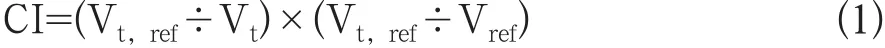
式中Vt,ref為參考等劑量曲面所包繞靶區的體積;Vt為靶區體積;Vref為參考等劑量曲面包繞的所有區域的體積。
(2)靶區均勻指數(homogeneity index,HI)。HI值越小,靶區均勻性越好[9]。HI的計算為公式2:

式中D2%、D98%和D50%分別為2%、98%和50%的靶區體積受到的照射劑量。
(3)比較海馬及海馬減量區Dmax、Dmean;比較腦干、內耳、眼球、晶體、視神經及視交叉的Dmax。
(4)統計并分析兩種計劃的機器跳數和治療時間,評估其臨床治療效率。
1.8 統計學方法
應用SPSS 22.0軟件進行分析,數據使用均數±標準差表示,兩種計劃劑量學結果的比較采用配對t檢驗分析方法,以P<0.05為差異有統計學意義。
2 結果
2.1 靶區劑量分布和參數
RapidArc和TOMO技術均能滿足95%的靶區體積接受處方劑量的照射,兩者的靶區覆蓋率分別為(95.00±0.54)%和(94.63±0.52)%,差異無統計學意義(t=1.426,P>0.05);TOMO的靶區Dmean優于RapidArc,且差異有統計學意義(t=3.512,P<0.05);TOMO的HI值優于RapidArc,其差異有統計學意義(t=3.594,P<0.05);兩者的CI值相差無幾,其TOMO的靶區分布具有一定優勢,見表2。
表2 PTV劑量參數比較
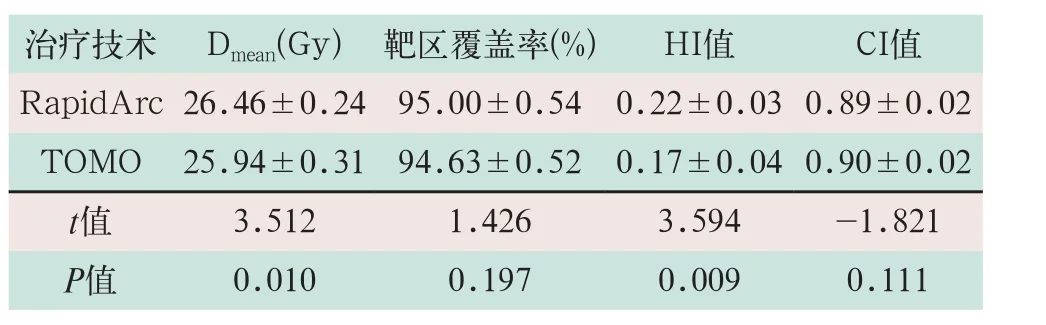
表2 PTV劑量參數比較
注:表中Dmean為PTV的平均劑量;HI為靶區均勻指數,CI為靶區適形指數。
治療技術 Dmean(Gy) 靶區覆蓋率(%) HI值 CI值RapidArc 26.46±0.24 95.00±0.54 0.22±0.03 0.89±0.02 TOMO 25.94±0.31 94.63±0.52 0.17±0.04 0.90±0.02 t值 3.512 1.426 3.594 -1.821 P值 0.010 0.197 0.009 0.111
2.2 海馬及海馬減量區劑量學參數
海馬的平均體積為4.75 cm3,占PTV靶體積的0.27%。海馬減量區平均體積為31.67 cm3,占PTV靶體積的1.80%。TOMO的左右海馬Dmax、Dmean及左右海馬減量區的Dmax、Dmean均明顯低于RapidArc,其差異有統計學意義(t=13.254,t=4.545,t=19.656,t=4.533,t=9.965,t=9.149,t=8.402,t=8.212;P<0.05),見表3。
表3 海馬及海馬減量區劑量參數比較

表3 海馬及海馬減量區劑量參數比較
注:表中Dmax為最大劑量;Dmean為平均劑量。
RapidArc TOMO t值 P值左海馬Dmax 16.74±0.48 12.38±0.6713.254 0.000左海馬Dmean 10.02±0.49 9.03±0.63 4.545 0.003右海馬Dmax 17.28±0.51 12.34±0.5019.656 0.000右海馬Dmean 10.05±0.49 9.03±0.67 4.533 0.003左海馬減量區Dmax 25.00±0.53 20.04±1.30 9.965 0.000左海馬減量區Dmean15.11±0.92 12.00±0.95 9.149 0.000右海馬減量區Dmax 25.29±0.28 20.44±1.54 8.402 0.000右海馬減量區Dmean15.13±0.92 12.07±0.95 8.212 0.000
2.3 OAR劑量參數
TOMO的左右晶體Dmax、左右視神經Dmax、視交叉Dmax、腦干Dmax及左內耳Dmax均低于RapidArc,差異有統計學意義(t=16.912,t=26.043,t=4.495,t=3.451,t=4.495,t=3.378,t=3.444;P<0.05);左右眼球Dmax和右內耳Dmax差異無統計學意義(t=0.256,t=0.496,t=1.289;P>0.05),見表4。
2.4 治療時間和機器跳數比較
治療時間和機器跳數主要用來評價加速器執行效率和射線利用率,其中治療時間包括出束時間和機架旋轉時間。RapidArc在治療時間和機器跳數上具有明顯的優勢,其差異有統計學意義(t=-14.364,t=-50.644;P<0.05),見表5。
表4 OAR劑量參數比較
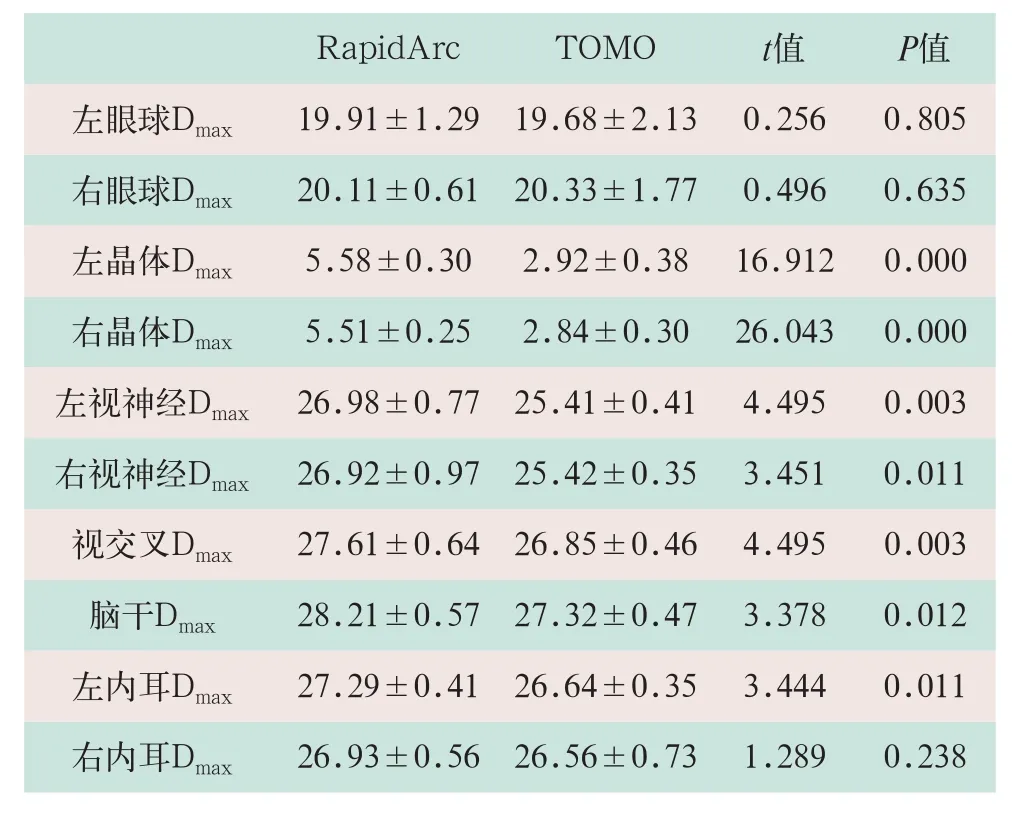
表4 OAR劑量參數比較
注:表中Dmax為最大劑量;Dmean為平均劑量。
RapidArc TOMO t值 P值左眼球Dmax 19.91±1.29 19.68±2.13 0.256 0.805右眼球Dmax 20.11±0.61 20.33±1.77 0.496 0.635左晶體Dmax 5.58±0.30 2.92±0.38 16.912 0.000右晶體Dmax 5.51±0.25 2.84±0.30 26.043 0.000左視神經Dmax 26.98±0.77 25.41±0.41 4.495 0.003右視神經Dmax 26.92±0.97 25.42±0.35 3.451 0.011視交叉Dmax 27.61±0.64 26.85±0.46 4.495 0.003腦干Dmax 28.21±0.57 27.32±0.47 3.378 0.012左內耳Dmax 27.29±0.41 26.64±0.35 3.444 0.011右內耳Dmax 26.93±0.56 26.56±0.73 1.289 0.238
表5 治療時間和機器跳數比較
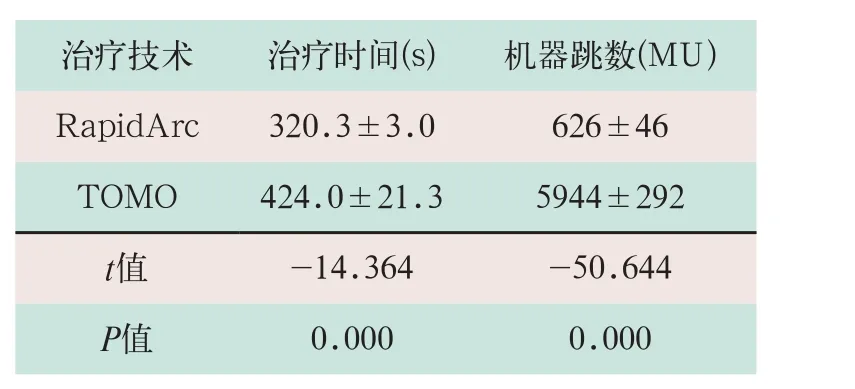
表5 治療時間和機器跳數比較
治療技術 治療時間(s) 機器跳數(MU)RapidArc 320.3±3.0 626±46 TOMO 424.0±21.3 5944±292 t值 -14.364 -50.644 P值 0.000 0.000
3 討論
隨著腫瘤綜合治療的進展,SCLC患者生存期逐漸延長,WBRT導致的神經認知功能損傷日益凸顯。海馬在機體的記憶儲存、學習、認知及情感方面有著重要的作用,降低海馬區受量理論上可以減輕神經功能損傷。
保護海馬區安全性和風險是研究者關注的問題。Wan等[10]報道了488例患者2270個腦轉移灶,其中SCLC占9%,海馬轉移率只有0.44%。Kundapur等[11]分析了59例SCLC腦轉移患者,海馬區轉移率為5%(3/59),其中20例患者WBRT后顱內進展,只有1例患者海馬區轉移(1/20)。Gondi等[12]設計的RTOG 0933試驗證實,保護海馬區全腦放射治療(hippocampalavoidance whole brain radiotherapy,HA-WBRT)可以減輕神經認知功能障礙,記憶力下降率從歷史對照30%降至9%,海馬區轉移率4.5%。
2010年,Gondi等[13]對海馬區勾畫進行了初步嘗試,通過定位CT與顱腦MRI融合,對海馬回區進行了勾畫,初步定義了海馬回區的勾畫規則。本研究中采用了定位核磁,薄掃1 mm的3D Bravo序列,與常規的3D FSPGR相比,3D BRAVO對反轉過程中K空間的填充順序做了優化,腦灰白質對比極佳,海馬區顯示特別清晰。
海馬毗鄰顱底,位置深在,給限制海馬受量增加了難度,為現代放射治療技術的進展提供了可能。Gondi等[13]對比了TOMO與IMRT技術在HA-WBRT中的應用,兩者在正常組織受量上相近,海馬Dmean分別為5.5 Gy和7.8 Gy,海馬Dmax分別為12.8 Gy和15.3 Gy,TOMO均有明顯的優勢;Rong等[14]比較了IMRT、TOMO和RapidArc三種技術在HA-WBRT中的劑量學差異,TOMO的HI優于IMRT和RapidArc(分別是0.15、0.28和0.22),海馬區平均劑量TOMO低于IMRT和RapidArc,分別為8.0 Gy、8.7 Gy和8.6 Gy;海馬區Dmax比較RapidArc低于TOMO和IMRT,分別為13.6 Gy、15.1 Gy和14.9 Gy,TOMO與IMRT相近,但無統計學差異。
本研究對比了TOMO和RapidArc兩種技術,靶區覆蓋率均在95%左右,TOMO的海馬Dmax和Dmean均明顯低于RapidArc,很大程度上歸因于TOMO技術的劑量調制能力更強,更快速劑量跌落,而RapidArc由于實現調強方式以及子野數限制等因素,與TOMO計劃相比海馬劑量(包括減量區劑量)降低的幅度方面有所不及。
TOMO的海馬Dmean在9 Gy,相較于國外研究略高,主要原因可能是鉛門寬度的選擇,國外研究鉛門寬度1.0 cm,而本研究選擇2.5 cm,考慮到臨床治療效率,鉛門1.0 cm治療時間過長。本研究TOMO治療時間在420 s,仍高于RapidArc治療時間320.3 s,治療效率上RapdiArc有明顯優勢。
本研究認為,TOMO和RapidArc均能實現良好的劑量分布,滿足靶區和OAR劑量限制要求,均可用于SCLC患者HA-WBRT。TOMO技術劑量調制能力更強,海馬和正常組織受量具有一定的優勢,對于有條件的單位建議選用TOMO;而RapidArc技術具備效率優勢,更適用于無法堅持較長時間治療的患者,并能提高治療效率,降低設備損耗。

