激活AMPK通過下調microRNA?21水平抑制肺癌細胞增殖及侵襲能力
王波


【摘要】? 目的 探討激活腺苷酸活化蛋白激酶(AMPK)是否可抑制人肺腺癌A549細胞增殖、遷移和侵襲及其具體作用機制,為防治肺癌尋求新靶點。方法 以培養的人A549肺腺癌細胞株為研究對象,外源性給予AMPK激動劑二甲雙胍干預細胞,采用噻唑藍(MTT)比色法檢測各組細胞的增殖情況,采用逆轉錄(RT)?PCR法檢測各組細胞微小RNA?21(miR?21)水平,蛋白免疫印跡法檢測各組細胞p?/t?AMPK、PTEN、p?/t?Akt水平,Transwell實驗檢測遷移及侵襲情況。結果 二甲雙胍可抑制A549細胞增殖、遷移及侵襲能力,對穿膜細胞數計數后進行統計學分析,組間存在差異(P均<0.05,與對照組比較);二甲雙弧可通過激活AMPK下調細胞miR?21水平,上調PTEN表達,抑制Akt活性抑制A549細胞增殖及遷移侵襲(P均<0.05,與對照組比較);轉染miR?21 mimics可逆轉AMPK的作用(P均<0.05,與二甲雙胍組比較)。結論 通過上調PTEN表達,下調miR?21水平可抑制A549細胞的增殖及遷移侵襲,提示激活AMPK具有潛在治療肺癌的作用,為研發新的靶向治療藥物提供了思路。
【關鍵詞】? 肺癌;腺苷酸活化蛋白激酶;微小核糖核酸?21;PTEN
【Abstract】? Objective? To discuss whether the activation of AMP?activated protein kinase(AMPK)can inhibit the proliferation,migration and invasion of A549 cells and unravel the underlying mechanism,aiming to provide a novel target for lung cancer therapy. Methods? Human lung adenocarcinoma A549 cells were intervened with the AMPK agonist of metformin. MTT assay was applied to analyze the proliferative ability of tumor cells in different groups. qRT?PCR was utilized to measure the expression level of microRNA?21 (miR?21). Western blot was performed to detect the expression levels of p?/t?AMPK,PTEN and p?/t?Akt proteins. Transwell invasion assay was utilized to analyze the migration and invasion of A549 cells. Results? Metformin could inhibit the proliferation,migration and invasion of A549 cells. The quantity of trans?membrane cells significantly differed among different groups (all P<0.05,compared with the control group). Metformin could down?regulate the expression level of miR?21,up?regulate the expression level of PTEN,suppress the Akt activity and inhibit the proliferation,migration and invasion of A549 cells by activating the AMPK signaling pathway (all P<0.05,compared with the control group). Transfection with miR?21 mimics reversed the effect of AMPK (all P<0.05,compared with the metformin group). Conclusions? Metformin inhibits the proliferation,migration and invasion of A549 cells by up?regulating the expression of PTEN and down?regulating the expression of miR?21,prompting that activating the AMPK signaling pathway serves as a potential therapeutic target to treat lung cancer,providing evidence for exploring novel target medicines.
【Key words】? Lung cancer;AMP?activated protein kinase;MicroRNA?21;PTEN
原發性支氣管肺癌(以下簡稱肺癌)是當今世界范圍內最常見的惡性腫瘤之一,發病率及病死率均高居首位,嚴重威脅人類生命健康。據統計近年來我國新發肺癌病例數73.33萬(男性50.93萬,女性22.40萬),因肺癌死亡人數達到61.02萬(男性43.24萬,女性17.78萬)[1]。腺苷酸活化蛋白激酶(AMPK)被認為是真核生物的“細胞能量調節器”,可調節下游通路中與膽固醇代謝、脂肪酸合成及蛋白質合成相關基因的表達,發揮其能量調節器的功能[2]。近年來的研究表明,激活AMPK信號通路對腫瘤生長和存活有抑制作用。實體腫瘤中,AMPK活性往往較低。Zheng等[3]研究發現,肝癌中AMPK雖然有表達,但其活性缺失卻是一個普遍存在的現象。目前的研究顯示AMPK有望成為非小細胞肺癌治療的靶點,但其具體的分子機制仍需要進一步的探究[4]。本研究以培養的人A549肺腺癌細胞株為研究對象,外源性給予AMPK激動劑二甲雙胍干預細胞,通過MTT、逆轉錄(RT)?PCR、蛋白免疫印跡法及Transwell等方法研究二甲雙胍對人肺腺癌細胞株A549增殖、遷移侵襲以及對microRNA-21(miR?21)水平及其下游PTEN?PI3K/Akt信號通路的影響,旨在為論證激活AMPK作為治療肺癌的潛在途徑提供依據。
材料與方法
一、細胞株和試劑選擇
人A549肺腺癌細胞購自中國科學院典型培養物保藏委員會細胞庫,二甲雙胍購自Selleck,Compound C 購自Merck Millipore ,RNA提取試劑盒購自陜西先鋒生物科技有限公司,逆轉錄試劑盒及TaqDNA聚合酶購自TaKaRa公司,PTEN、p?Akt、t?Akt、p?AMPK、t?AMPK、GAPDH抗體購自CST,細胞培養板購自Corning,PCR擴增儀及Western電泳儀購自BIO?RAD,MTT試劑購自西唐生物科技有限公司。
二、試驗方法
1. 細胞培養
A549細胞用含有10%滅活胎牛血清,青霉素(100 U/ml),鏈霉素(100 μg/ml)的DMEM培養基,置于37℃、5% CO2 培養箱中培養。
2.? ?噻唑藍(MTT)比色法檢測細胞活性
將處于對數生長期的A549細胞消化貼壁細胞后,加入含10%血清的培養基,制成單細胞懸液并計數,以約6×103個/孔細胞數接種于96孔培養板中,將培養板放入37℃、5% CO2培養箱內孵育24 h,細胞全部貼壁后,棄去上清,取出96孔板,每孔加入MTT溶液(5 mg/ml)20 μl,然后置于37℃ 、5% CO2培養箱中繼續孵育4 h,棄去上清,每孔加DMSO 150 μl,置于搖床上低速振蕩10 min,使結晶物充分溶解;設定空白對照孔調零,選擇490 nm波長,在酶聯免疫檢測儀上測定各孔的光吸收值(OD值)。并計算平均增殖率,增殖率=實驗孔OD值/對照孔OD值×100%,整理保存數據。
3.? ?RT?PCR檢測miR?21水平
用RNAfast1000?總RNA極速抽提試劑盒提取細胞總RNA,配制逆轉錄cDNA反應液用于miR?21及U6的檢測,將逆轉錄好的cDNA稀釋10倍至50 ng/μl以下應用BIO?RAD PCR實時定量擴增儀的操作方法進行反應,分析溶解曲線,計算結果。
4.? ?蛋白免疫印跡法檢測細胞內PTEN及p?Akt水平
按實驗設計干預細胞后提取蛋白,用BCA法測定蛋白含量、變性,SDS?PAGE電泳,轉印后取出硝酸纖維素膜進行免疫反應,膜用濾紙吸干,將預先配制的發光液均勻滴上,BIO?RAD成像系統檢測條帶,分析結果。
5.? ?Transwell小室遷移及侵襲實驗測定腫瘤細胞遷徙及侵襲能力
用Matrigel膠與無血清培養基按1∶7稀釋,每個Transwell小室上加入100 μl稀釋液,37 ℃孵育箱孵育 Transwell 小室至少1 h 使膠凝固,制備細胞懸液,在細胞培養箱中常規培養(遷移實驗培養24 h,侵襲實驗培養48 h),顯微鏡下取小室的上、下、左、右、中心5個視野部位計數,統計結果。
三、統計學處理
采用SPSS 18.0統計分析。正態分布數據以x±s表示,2組間比較采用獨立樣本t檢驗,多組間比較采用單因素方差分析,多重比較采用LSD?t檢驗。P<0.05為差異有統計學意義。
結果
一、二甲雙胍抑制肺癌細胞的侵襲能力
將A549細胞分為對照組、二甲雙胍組,進行Transwell遷移及侵襲試驗,結果顯示二甲雙胍干預后,A549細胞的遷移及侵襲能力明顯受到抑制。對穿膜細胞數計數后進行統計分析,組間差異有統計學意義(P<0.05),見圖1。
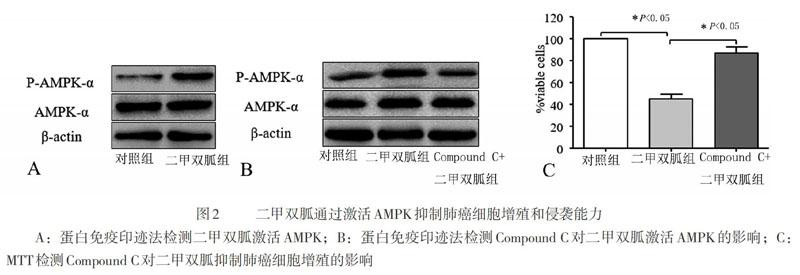
二、二甲雙胍通過激活AMPK抑制肺癌細胞增殖和侵襲能力
將A549細胞分為對照組及二甲雙胍組,提取細胞總蛋白,蛋白免疫印跡法檢測各組細胞p?AMPK水平,與對照組比較,二甲雙胍組p?AMPK水平明顯升高(圖2A,P<0.05)。預先給予AMPK抑制劑Compound C可抑制二甲雙胍誘導的p?AMPK水平上調(P<0.05,圖2B)。MTT檢測細胞增殖情況,結果表明特異性抑制AMPK,二甲雙胍抑制A549細胞增殖的作用被逆轉(圖2C,P<0.05,與二甲雙胍組比較)。
預先給予AMPK抑制劑Compound C可逆轉二甲雙胍抑制A549細胞遷移及侵襲的能力。對穿膜細胞計數后進行統計分析,組間差異有統計學意義(圖3,P<0.05,與二甲雙胍組比較)。
三、激活AMPK抑制肺癌細胞增殖和侵襲能力的分子機制
1.miR?21水平
與對照組相比,二甲雙胍干預可下調細胞中miR?21水平(P<0.05),而預先給予AMPK抑制劑Compound C可逆轉二甲雙胍對miR?21水平的影響(圖4,P <0.05,與二甲雙胍組比較)。
2. PTEN/PI3K/Akt信號通路
與對照組相比,二甲雙胍干預可明顯上調細胞中PTEN水平,而預先抑制AMPK可逆轉二甲雙胍對PTEN水平的影響;二甲雙胍干預可下調A549細胞中p?Akt水平,而預先給予Compound C 可以逆轉二甲雙胍對p?Akt的抑制作用,見圖5。
3.? miR?21介導了激活AMPK抑制肺癌細胞增殖的作用
為了進一步明確激活AMPK是否通過下調miR?21水平抑制A549細胞增殖。用miR?21 mimics轉染A549細胞,培養48 h后提取總RNA,qRT?PCR檢測細胞miR?21水平。結果表明miR?21 mimics可明顯上調A549細胞中miR?21水平(圖6A,P<0.05,與對照組比較)。二甲雙胍處理可明顯抑制A549細胞增殖(P<0.05,與對照組比較),而預先給予miR?21 mimics可逆轉二甲雙胍抑制細胞增殖的作用(P<0.05,與二甲雙胍組比較),見圖6B。
為了進一步明確激活AMPK是否通過下調miR?21水平抑制A549細胞侵襲,將A549細胞分為對照組、二甲雙胍組、miRNA mimics NC+二甲雙胍組、miR?21 mimics +二甲雙胍組,Transwell小室實驗檢測肺癌細胞遷移及侵襲能力。結果表明二甲雙胍處理可明顯抑制A549細胞遷移及侵襲,而預先給予miR?21 mimics可逆轉二甲雙胍的抑制作用,對穿膜細胞計數后進行統計分析,組間比較差異有統計學意義(圖7,P<0.05,與二甲雙胍組比較)。
將A549細胞分為對照組、二甲雙胍組、miRNA mimics NC+二甲雙胍組、miR?21 mimics +二甲雙胍組。miRNA mimics NC或miR?21 mimics 預轉染細胞24 h,然后加入10 ml吡格列酮干預24 h,提取蛋白質,檢測PTEN和p?/t?Akt水平。結果顯示二甲雙胍處理可上調PTEN水平,而預先給予miR?21 mimics可逆轉二甲雙胍對PTEN水平的影響(圖8A)。二甲雙胍處理可下調p?Akt水平,而預先給予miR?21 mimics可逆轉二甲雙胍對p?Akt水平的影響(圖8B)。
討論
miR?21基因是最早在人類基因組中檢測到的miRNA之一,在多種不同類型腫瘤組織中均明顯上升,與腫瘤細胞的增殖、遷移侵襲、血管生成和抗藥性等生物學行為相關,在腫瘤的發生發展過程中發揮重要作用。近年來,miR?21在肺癌發病和治療過程中的作用逐漸引起關注[5?9]。PTEN是miR?21的重要靶蛋白之一,miR?21可以通過下調PTEN水平誘導多種細胞增殖。PI3K/Akt信號通路參與細胞增殖、遷移、分化、血管生成等一系列病理生理過程。研究表明,Akt可通過磷酸化調控下游靶蛋白的活性或功能[10?11]。例如,Akt可磷酸化雙微基因2蛋白,抑制p53蛋白的功能,促進細胞存活;可通過磷酸化BAD、FXKR抑制其生物活性,抑制細胞凋亡;促進NF?κB磷酸化,抑制細胞凋亡;可通過磷酸化mTOR,上調Skp2水平,下調p27,促進細胞增殖。本研究未系統檢測Akt下游關鍵靶蛋白的活性變化,但大量的研究已建立了它們之間的相關性。
作為腫瘤重要的惡性生物學行為之一,遷移及侵襲加劇了腫瘤的發展進程,影響預后。研究發現在胰腺癌中miR?21表達的上調,加劇了腫瘤細胞的遷移及侵襲[12]。本研究中,Transwell實驗結果證實過表達miR?21可以逆轉二甲雙胍對A549細胞遷移及侵襲能力的抑制作用。
綜上所述,二甲雙胍可通過激活AMPK下調miR?21水平,進而負性調控PTEN?PI3K/Akt信號通路抑制肺癌細胞增殖;此外,二甲雙胍還可抑制肺癌細胞的侵襲能力,機制也與激活AMPK,下調miR?21水平有關,提示AMPK可能是防治肺癌的新靶點,但要應用于臨床過程,尚需進一步研究、驗證。
參 考 文 獻
[1]Chen W,Zheng R,Baade PD,Zhang S,Zeng H,Bray F,Jemal A,Yu XQ,He J. Cancer statistics in China,2015. CA Cancer J Clin,2016,66 (2): 115?132.
[2]Kahn BB,Alquier T,Carling D,Hardie DG. AMP?activated protein kinase: ancient energy gauge provides clues to modern understanding of metabolism. Cell Metab,2005,1 (1): 15?25.
[3]Zheng L,Yang W,Wu F,Wang C,Yu L,Tang L,Qiu B,Li Y,Guo L,Wu M,Feng G,Zou D,Wang H. Prognostic significance of AMPK activation and therapeutic effects of metformin in hepatocellular carcinoma. Clin Cancer Res,2013,19 (19): 5372?5380.
[4]Han D,Li SJ,Zhu YT,Liu L,Li MX. LKB1/AMPK/mTOR signaling pathway in non?small?cell lung cancer. Asian Pac J Cancer Prev,2013,14 (7): 4033?4039.
[5]Zhang J,Zhang C,Hu L,He Y,Shi Z,Tang S,Chen Y. Abnormal expression of miR?21 and miR?95 in cancer stem?like cells is associated with radioresistance of lung cancer. Cancer Invest,2015,33 (5): 165?171.
[6]Yang Z,Fang S,Di Y,Ying W,Tan Y,Gu W. Modulation of NF?kappaB/miR?21/PTEN pathway sensitizes non?small cell lung cancer to cisplatin. PLoS One,2015,10 (3): e0121547.
[7]Shen H,Zhu F,Liu J,Xu T,Pei D,Wang R,Qian Y,Li Q,Wang L,Shi Z,Zheng J,Chen Q,Jiang B,Shu Y. Alteration in Mir?21/PTEN expression modulates gefitinib resistance in non?small cell lung cancer. PLoS One,2014,9 (7): e103305.
[8]Jiang Y,Chen X,Tian W,Yin X,Wang J,Yang H. The role of TGF?beta1?miR?21?ROS pathway in bystander responses induced by irradiated non?small?cell lung cancer cells. Br J Cancer,2014,111 (4): 772?780.
[9]Xu L,Huang Y,Chen D,He J,Zhu W,Zhang Y,Liu X. Downregulation of miR?21 increases cisplatin sensitivity of non?small?cell lung cancer. Cancer Genet,2014,207 (5): 214?220.
[10]? ? 姜蓬壘,常冰梅.PI3K?Akt信號通路與腫瘤化學耐藥性. 國際腫瘤學雜志,2014,41(5):324?327.
[11]? ? 張雨,陸紅玲,徐剛.PI3K?AKT通路在非小細胞肺癌順鉑耐藥中的作用. 中國肺癌雜志,2014,15(8):635?642.
[12]? ? Liu Z,Zhang J,Hong G,Quan J,Zhang L,Yu M. Propofol inhibits growth and invasion of pancreatic cancer cells through regulation of the miR?21/Slug signaling pathway. Am J Transl Res,2016,8 (10): 4120?4133.
(收稿日期:2018?07?10)
(本文編輯:楊江瑜)

