硝苯吡啶在鐵超載HK-2細胞氧化應激中的作用及機制
呂小梅 冉兵 楊茂 李雪森 藺艷,
西南醫科大學1生理學教研室,2腫瘤醫學研究所(四川瀘州 646000)
鐵超載是鐵代謝紊亂的一種病理表現,多種疾病如:小紅細胞性貧血、溶血性貧血、腎炎綜合征和多次輸血等都可引起鐵超載[1-3]。機體鐵超載會引起過量的游離鐵在肝臟、胰腺、心臟、腦垂體、腎臟等薄壁器官沉積,促進氧自由基的產生,并引起氧化應激等病理生理過程的發生[4]。用鐵螯合劑降低血清及細胞內鐵含量一直是臨床治療鐵超載的主要方式。硝苯吡啶作為一種鈣通道抑制劑在臨床主要被用于高血壓,冠心病等心血管疾病的治療[5-7],但近年來有研究[8]顯示硝苯吡啶可抑制離體心肌和心室肌細胞L-型鈣通道介導的非轉鐵蛋白結合鐵的攝取,可顯著刺激COS-7細胞和HEK293T細胞的鐵轉運,增加鐵超載模型大鼠尿鐵排泄[9]等,提示心肌或腎小管細胞攝取鐵或與鈣通道有關,有學者甚至提出或許可用鈣通道抑制劑聯合鐵螯合劑來治療心肌鐵超載[8]。所以L-型鈣通道抑制劑——硝苯吡啶在鐵超載性疾病中的一些新的藥理特性就越來越受到了人們的關注。但硝苯吡啶對鐵超載腎小管細胞鐵轉運的作用機制是什么,一直都非常不清楚,硝苯吡啶對鐵超載性氧化應激是否有作用亦未見報道,本研究用HK-2細胞為對象,研究硝苯吡啶對腎小管細胞氧化應激的作用及可能的機制,以期為探明硝苯吡啶在鐵超載性疾病中的藥理特性提供實驗和理論依據。
1 材料與方法
1.1 主要材料和試劑 HK-2細胞、FAC和Nifedipine購自上海延慕實業公司,CCK-8試劑盒購自Dojin,硝酸購自科龍試劑公司,普魯士藍伊紅染色試劑盒購自北京solarbio試劑公司,總超氧化物歧化酶(T-SOD)、丙二醛(MDA)、還原性谷胱甘肽(GSH)均購自南京建成試劑公司,鼠抗人單克隆DMT1(ab117544)和羊抗人多克隆FPN1(ab205376)抗體購自Abcam公司,鼠抗人β-actin單克隆抗體和羊抗鼠熒光標記IgG抗體購自Gene公司,兔抗羊辣根過氧化物酶(horseradish peroxidase,HRP)標記IgG抗體購自北京博奧森生物技術有限公司,DAB顯色試劑盒為購自MILLIPORE公司。
1.2 方法
1.2.1 細胞分組及處理 將對數生長期的HK-2細胞隨機分成4個組,分別為空白組、鐵超載組、硝苯吡啶組、共處理組。鐵超載組用檸檬酸鐵銨(ferric ammonium citrate,FAC)300 μmol/L 處 理24 h,硝苯吡啶組用硝苯吡啶10 μmol/L處理24 h,共處理組用硝苯吡啶處理1 h后加入FAC共同處理24 h,空白組用等體積的溶劑處理。
1.2.2 氧化應激試驗 收集分組處理好的細胞在冰上超聲波破碎,功率80 W,超聲時間5 s,間歇10 s,重復4次,獲取細胞破碎液,按照試劑盒說明書用硫代巴比妥酸(TBA)法檢測細胞內的MDA含量、羥胺法檢測細胞內T-SOD活性、微量酶標法檢測細胞內GSH的含量。
1.2.3 感應耦合等離子體原子發射光譜儀測細胞內鐵含量 HK-2細胞照1.2.1的方法分組處理,每組8個復孔。消化收集細胞,細胞計數后,用PBS清洗3遍,每管加入純硝酸200 μL,混勻,37℃過夜,用超純水250倍稀釋后,用感應耦合等離子體原子發射光譜儀在259.94 nm波長下測發射光強度,根據發射光強度與鐵含量的標準曲和樣品的發射光強度換算鐵含量。儀器參數設置為:發射功率1 150 W,載氣流量0.7 L/min,輔助氣流量1.0 L/min,冷卻氣流量12 L/min。
1.2.4 Western blot法檢測二價金屬離子轉運蛋白 1(divalent metal transporter 1,DMT1)和膜鐵轉運蛋白1(ferroportin,FPN1)的表達 收集分組處理的細胞蛋白樣品。制取PAGE-SDS膠,分離膠10%,濃縮膠5%,每孔蛋白上樣量60 μg,按Western blot常規方法操作,一抗用鼠抗人β-actin單克隆抗體(1∶2 000),羊抗人FPN1多克隆抗體(1∶500),鼠抗人DMT1多克隆抗體(1∶500),二抗用兔抗鼠熒光標記IgG(1∶5 000)和羊抗兔HRP標記IgG(1∶2 000),在成像儀下曝光成像。
1.3 統計學方法 數據采用SPSS 17.0軟件進行統計處理,結果用x±s表示,多組比較采用單因素方差分析,組間各指標比較采用LSD法檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 各組細胞MDA、SOD和GSH含量的比較用FAC處理HK-2細胞24 h后,與空白組相比,鐵超載組細胞內MDA含量增多,SOD活性降低,GSH含量減少,差異具統計學意義(P<0.05)。硝苯吡啶組MDA含量,SOD活性和GSH含量與空白組比較差異不具統計學意義(P>0.05),但與鐵超載組相比MDA含量降低,SOD活性增加,GSH含量增多,差異具統計學意義(P<0.05)。共處理組與空白組相比,MDA含量增加(P<0.05),SOD活性和GSH含量差異不具統計學意義(P>0.05),但與鐵超載組相比MDA含量降低,SOD活性增加,GSH含量增多,差異具統計學意義(P<0.05,表1)。表明硝苯吡啶單獨處理對MDA、SOD和GSH無顯著影響,但能抑制FAC對MDA、SOD和GSH的影響。
表1 HK-2細胞中MDA、T-SOD、和GSH的含量Tab.1 The contents of MDA,T-SOD,and GSH in HK-2 cells(n=6) ± s
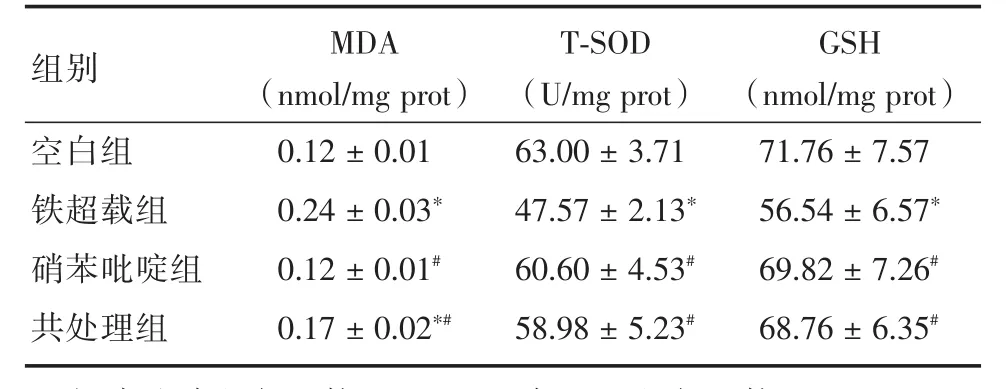
表1 HK-2細胞中MDA、T-SOD、和GSH的含量Tab.1 The contents of MDA,T-SOD,and GSH in HK-2 cells(n=6) ± s
注:與空白組相比較,*P<0.05;與FAC組相比較,#P<0.05
組別空白組鐵超載組硝苯吡啶組共處理組MDA(nmol/mg prot)0.12±0.01 0.24±0.03*0.12±0.01#0.17±0.02*#T-SOD(U/mg prot)63.00±3.71 47.57±2.13*60.60±4.53#58.98±5.23#GSH(nmol/mg prot)71.76±7.57 56.54±6.57*69.82±7.26#68.76±6.35#
2.2 細胞內鐵含量的比較 用FAC和(或)硝苯吡啶處理HK-2細胞24 h后,用感應耦合等離子體原子發射光譜儀測各組鐵濃度,結果顯示:鐵超載組鐵含量升高,硝苯吡啶組與空白組和鐵超載組相比鐵含量降低,共處理組與空白組相比鐵含量升高,但與鐵超載組相比鐵含量降低,以上結果差異均具有統計學意義(P<0.05,圖1)。表明硝苯吡啶處理能降低HK-2細胞內鐵含量。
2.3 各組細胞DMT1表達水平的比較 HK-2細胞分組處理后,用Western blot法檢測DMT1的表達量。結果顯示鐵超載組DMT1的表達水平降低(P<0.05),硝苯吡啶組的DMT1的水平升高(P<0.05),共處理組與空白組相比DMT1表達水平無顯著變化(P>0.05),但與鐵超載組相比DMT1表達水平明顯升高(P<0.05)。表明硝苯吡啶可增加HK-2細胞DMT1的表達量。見圖2。
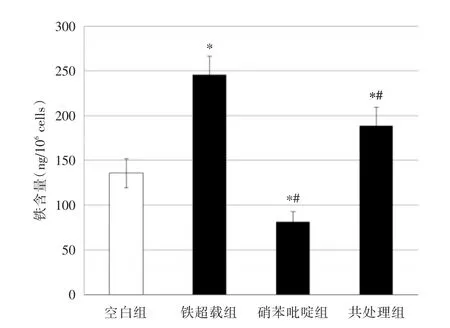
圖1 各組細胞內鐵含量的比較Fig.1 Iron contents in HK-2 cells
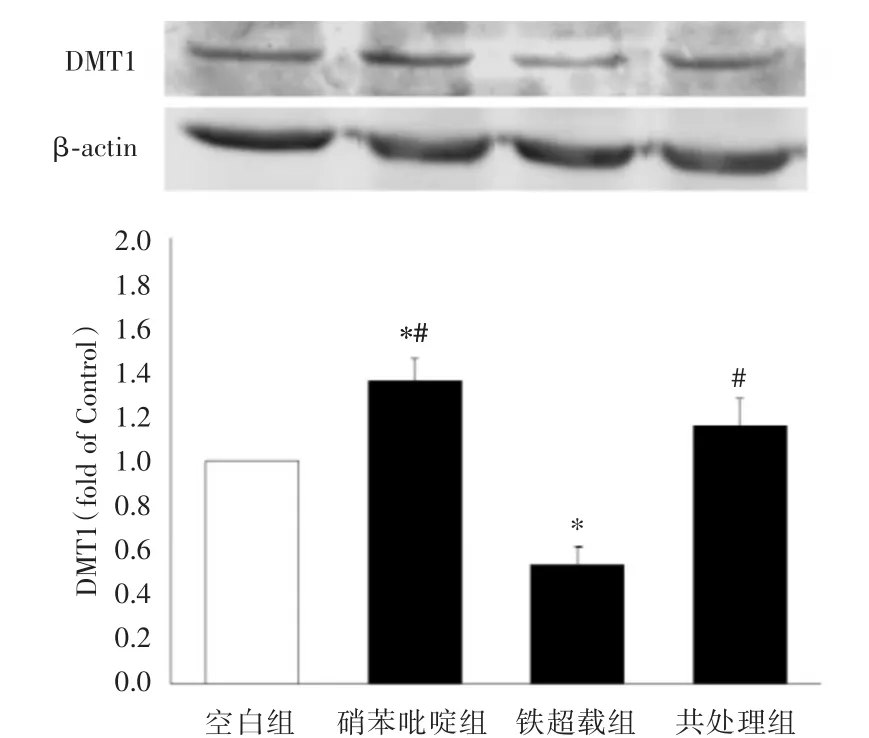
圖2 DMT1在HK-2細胞中的表達Fig.2 Expression of DMT1 protein in HK-2 cells
2.4 各組細胞FPN1表達水平的比較 HK-2細胞分組處理后,用Western blot法檢測FPN1的表達水平。結果顯示與空白組相比鐵超載組、硝苯吡啶組和共處理組FPN1的表達水平均升高(P<0.05),硝苯吡啶組和共處理組與高鐵組相比差異無統計學意義(P>0.05)。見圖3。
3 討論
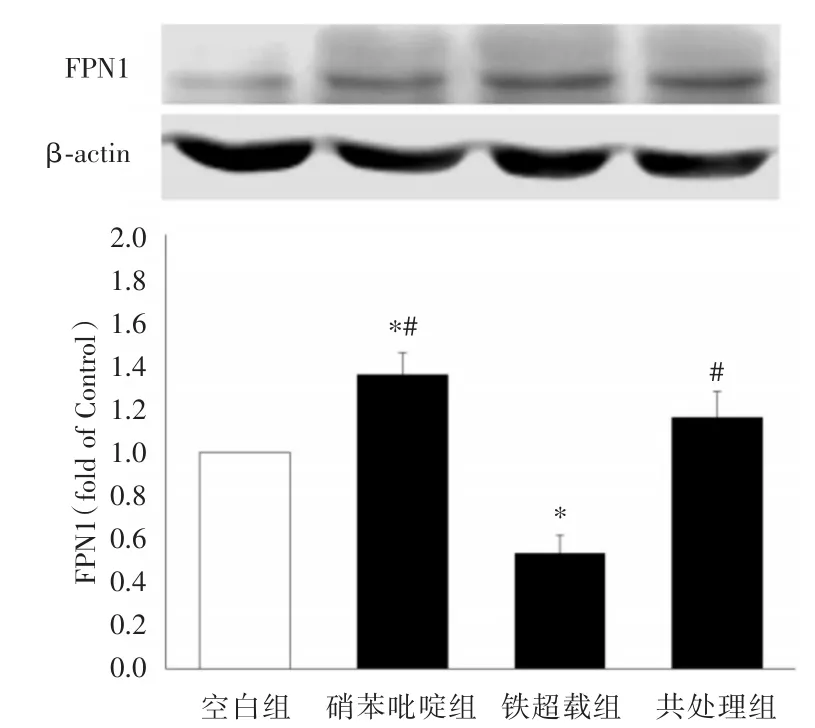
圖3 FPN1在HK-2細胞中的表達Fig.3 Expression of FPN1 protein in HK-2 cells
氧化應激(oxidative stress,OS)是指體內氧化-抗氧化反應失衡,ROS增多,對抗與清除氧自由基的能力減弱,細胞修復能力降低,膜脂質發生過氧化損害。MDA含量可反映細胞脂質過氧化損害的程度[10],T-SOD和GSH可間接反應機體清除氧自由基的能力[11]。本研究用FAC處理HK-2細胞24 h所致鐵超載模型細胞內MDA含量增加,T-SOD活性降低,GSH含量降低,表明鐵超載可致細胞內發生氧化應激。硝苯吡啶單獨處理時對MDA、SOD和GSH這幾個指標無顯著影響,但與FAC聯合處理時細胞中MDA含量比鐵超載組明顯降低,SOD活性和GSH含量比鐵超載組明顯增加,表明硝苯吡啶本身并不能增加HK-2細胞抗氧化的能力,但能使FAC引起的細胞脂質過氧化損害明顯減弱,在HK-2細胞鐵超載促發的氧化應激中具有保護作用。
為了探明硝苯吡啶減輕HK-2細胞氧化應激性損傷的機制,本研究關注了硝苯吡啶對細胞內鐵含量和鐵代謝相關蛋白DMT1和FPN1的表達的影響。經典的鐵轉運途徑是轉鐵蛋白-轉鐵蛋白受體(Tf-TfR)循環:血漿中Fe3+與轉鐵蛋白結合形成Tf-Fe3+,Tf-Fe3+與細胞膜上的TfR形成Tf-Fe3+-TfR復合物,經內吞作用進入細胞形成內吞小體(內涵體),在質子泵作用下,內吞小體PH值下降,Fe3+從Tf中釋放出來,脫鐵后的Tf被運回胞外,Fe以Fe2+的方式被內涵體膜上的DMT1轉運至胞漿中,Fe2+或進入鐵蛋白中儲存,或進入線粒體參與代謝,或由FPN1轉出細胞并被氧化成Fe3+重新回到血漿中[3]。此外少量Fe2+在心肌、肝臟、胰腺還可以通過L-型鈣通道,DMT1,ZIP4等[12]方式被轉運入細胞中。研究證實鐵超載時,TfR表達下調[13],經典的Tf-TfR途徑鐵轉運減少,旁路途徑增加,但具體哪些細胞各自有哪些途徑和通道,目前并不十分清楚。本研究中硝苯吡啶作為一種L-型鈣通道抑制劑顯著降低HK-2細胞內鐵含量,與DAS等[8]觀察到的硝苯吡啶可減少大鼠心肌細胞通過L-型鈣通道攝取鐵的結果相似,提示HK-2細胞轉運鐵或許也有鈣通道途徑,硝苯吡啶可能是通過抑制鈣通道而減少鐵攝取,從而降低HK-2細胞內鐵含量,但這一猜測和機制還需要更多的實驗證據來闡明。
DMT1通常被認為是調節鐵攝取的一個重要的轉運蛋白,它在不同細胞不同部位具有不同的功能:(1)在腸腔上皮細胞刷狀緣膜上介導Fe2+的攝取;(2)在外周神經系統和紅細胞膜上負責非轉鐵蛋白結合鐵(non-Tf-boundiron,NTBI)的吸收[14];(3)在內涵體膜上負責將Fe2+轉出到胞漿中[15];(4)在線粒體外膜上負責將鐵攝入線粒體中[16]。ABOUHAMED等[17]用熒光免疫染色的方法發現DMT1在腎近端小管上皮的表達主要位于晚期內涵體/溶酶體膜上,并不出現在細胞膜上,所以它似乎并不負責腎小管細胞攝取鐵[17],而是主要負責將晚期內涵體/溶酶體內的鐵轉運至胞漿中。本研究中硝苯吡啶促進HK-2細胞DMT1的表達,可增強細胞內的鐵轉運,亦將有利于逆轉鐵蓄積,減輕鐵超載所引發的氧化應激性損傷。
FPN1是目前研究認為的唯一負責細胞內鐵轉出的蛋白[18],在小腸、肝臟、脾、巨噬細胞和腎小管細胞中廣泛表達[19]。FPN1在腎近端小管細胞的胞漿和靠近基底膜的部位表達[20],可能與腎臟重吸收鐵的功能相關[20]。本實驗中硝苯吡啶增加鐵輸出蛋白FPN1的表達,將有利于增加鐵的轉出,幫助降低細胞內鐵含量,從而減少鐵超載促發的氧化應激性損傷。
綜上所述,筆者認為硝苯吡啶在鐵超載HK-2的氧化應激中有保護作用,這一作用與硝苯吡啶促進DMT1和FPN1的表達,增加細胞內鐵的轉運及轉出,降低細胞內鐵含量有關。了解和探明硝苯吡啶在鐵超載腎小管細胞中的作用以及對鐵代謝的影響機制將為臨床用治療鐵超載性腎病提供新的思路和方法。
[1]GORDAN R,WONGJAIKAM S,GWATHMEY J K,et al.Involvement of cytosolic and mitochondrial iron in iron overload cardiomyopathy:an update[J/OL].Heart Fail Rev,2018 Apr 19.
[2]PIETRANGELO A.Ineffective erythropoiesis:anemia and iron overload[J].Hematol Oncol Clin North Am,2018,32(2):213-221.
[3]ANDERSON G J,FRAZER D M.Current understanding of iron homeostasis[J].Am J Clin Nutr,2017,106(6):1559S-1566S.
[4]AZIZA S A,MELS A,ELSHALL S K.Ameliorating role of rutin on oxidative stress induced by iron overload in hepatic tissue of rats[J].Pak J Biol Sci,2014,17(8):964-977.
[5]UMEIZUDIKE K A,OLAWUYI A B,UMEIZUDIKE T I,et al.Effect of calcium channel blockers on gingival tissues in hypertensive patients in lagos,nigeria:A pilot study[J].Contemp Clin Dent,2017,8(4):565-570.
[6]SHAWKAT E,MISTRY H,CHMIEL C,et al.The effect of labetalol and nifedipine MR on blood pressure in women with chronic hypertension in pregnancy[J].Pregnancy Hypertens,2018,11:92-98.
[7]TSUBURAYA R,TAKAHASHI J,NAKAMURA A,et al.Beneficial effects of long-acting nifedipine on coronary vasomotion abnormalities after drug-eluting stent implantation:The NOVEL study[J].Eur Heart J,2016,37(35):2713-21.
[8]DAS S K,OUDIT G Y.Votathy:L-type age-gated Ca2+channals as key mediators of iron-transport and iron-verload cardiomyopvs.T-type Ca2+channels[J].Eur J Haematol,2012,88(6):476-477.
[9]LUDWICZEK S,THEURL I,MUCKENTHALER M U,et al.Ca2+channel blockers reverse iron overload by a new mechanism via divalent metal transporter-1[J].Nat Med,2007,13:448-454.
[10]宋園園,劉劍波.依達拉奉對肺栓塞患者血清HMGB1、MDA和LPA水平的影響[J].實用醫學雜志,2016,32(22):3779-3782.
[11]藺艷,何濤,毛曉燕,等.還原型谷胱甘肽對腎急性缺血再灌注性損傷的作用[J].實用醫學雜志,2016,32(8):1233-1236.
[12]COATES T D.Physiology and pathophysiology of iron in hemoglobin-associated diseases[J].Free Radic Biol Med,2014,72:23-40.
[13]YU SS,JIANG L R,LING Y,et al.Nifedipine increases iron content in WKPT-0293 Cl.2 cells via up-regulating iron influx protein[J/OL].Front Pharmacol,2017,13:8-60.
[14]VIOT R M,GOITIA B,USACH V,et al.DMT1 as a candidate for non-transferrin-bound iron uptake in the peripheral nervous system[J].BioFactors,2013,39(4):476-484.
[15]KHALIL S,HOLY M,GRADO S,et al.A specialized pathway for erythroid iron delivery through lysosomal trafficking of transferrin receptor 2[J].Blood Adv,2017,1(15):1181-1194.
[16]WOLFF N A,GARRICK M D,ZHAO L,et al.A role for divalent metal transporter(DMT1)in mitochondrial uptake of iron and manganese[J].Sci Rep,2018,8(1):211.
[17]ABOUHAMED M,GBUREKJ,LIU W,et al.Divalent metal transporter 1 in the kidney proximal tubule is expressed in late endosomes/lysosomal membranes:implications for renal handling of proteinmetal complexes[J].Am J Physiol Renal Physiol,2006,290(6):F1525-1533.
[18]WILLEMETZ A,BEATTY S,RICHER E,et al.Iron-and hepcidin-independent downregulation of the iron exporter ferroportin in macrophages during Salmonella infection[J/OL].Front Immunol,2017,8:498.
[19]ANTONELLO P.Ferroportin disease:pathogenesis,diagnosis and treatment[J].Haematologica,2017,102(12):1972-1984.
[20]藺艷,錢忠明,科亞.腎臟鐵代謝蛋白的表達與功能[J].生物化學與生物物理進展,2011,38(2):113-118.

