銀屑病發病機制相關信號通路研究進展
姜蔚蔚 張春雷
銀屑病是一種臨床表現為紅斑、斑塊、鱗屑的慢性炎癥性皮膚病;表皮角化過度、角化不全、棘層增厚和真皮炎癥是其組織病理特征。其發病機制至今不清,目前認為與遺傳、環境和免疫等多因素相關。全基因組關聯研究顯示,超過20個易感位點均參與銀屑病的發病。目前認為銀屑病是一個累及多環節多通路的疾病,以下就現有關于銀屑病發病機制中的信號通路及其相關調節器的研究做一綜述,為其進一步靶向治療的研究探索思路。
1 炎癥介導途徑
1.1 IL-23/IL-17A-Th17軸(Interleukin-23/Interleukin-17A-T Helper type 17 cells axis) 基于臨床、實驗和基因方面的研究發現由IL-23發揮主要誘導功能的Th17細胞介導的慢性炎癥在銀屑病的發病機制中起重要作用[1]。IL-23在調節Th17細胞終端效應分子的功能上扮演重要角色,主要包括維持Th17細胞的功能及其促炎因子的產生,而發揮此功能的主要原因則是保護性的IL23R381等位基因的存在[2],IL-23與受體的結合產生的相關信號同時也刺激了下游STAT-3通路的活化[3]。近年來又有研究表明,IL-17A在銀屑病樣炎癥小鼠模型中也起誘導表皮增生的作用[4],在今后的研究中可將IL23R作為預測治療效果的表面信號分子。
早期生長反應因子-1(Early growth response-1,Egr-1)是一種在細胞生長、分化、生存和免疫反應中起重要作用的轉錄因子。已發現Egr-1在銀屑病皮損中高表達,現有研究通過微陣列分析發現,在銀屑病患者和體外培養的人角質形成細胞中均顯示IL-17A導致Egr-1的高表達,且IL-17A誘導的Egr-1的表達可被細胞外信號調節激酶(Extracellular signal-regulated kinase,ERK)抑制劑抑制,針對Egr-1的小分子干擾RNA可導致IL-17A誘導的銀屑病素下調,證明Egr-1可能是IL-17A介導銀屑病免疫反應的潛在的重要調節器[5]。
最近有研究發現,轉錄輔激活物IkappaBzeta在IL-17A介導的免疫效應中起重要作用,提示IkappaBzeta可能是銀屑病發病中的一個新的調節機制,在未來銀屑病或其他IL-17A介導的疾病靶向治療中有廣闊的研究前景[6]。
1.2 IFN-γ/TNF-Th1軸(interferon-γ/Tumor necrosis factor-T Helper type 1 cells axis) IFN-γ以及隨后出現的IL-17A/Th17軸被認為是參與銀屑病機制的中心細胞因子。早期一些研究數據表明,IFN-γ誘導了STAT-1和p48兩條信號通路[7]。后來又有研究證實,有生物活性的sTNF(可溶TNF)和tmTNF(跨膜TNF)與相應受體結合啟動了三個主要的免疫調控通路,首先是NF-kappaB活化和炎癥的產生,其次是MAPK(促分裂原活化蛋白激酶)通路和癌基因氨基端激酶的活化,隨后促進細胞的分化、增殖和凋亡,最后則與死亡信號有關[8,9]。細胞的生長、幸存和凋亡是在同一個細胞內通過同一個細胞因子的凋亡和抗凋亡信號共同刺激活化而實現的,在銀屑病的發病中起重要作用。
1.3 TGF-β(Transforming growth factor,TGF-β1)信號通路 TGF-β信號可通過其下游的Smad依賴和非依賴通路發揮生物效應。據報道,在動物模型中其過表達導致了銀屑病樣皮損,關于發生此生物作用的具體機制,有研究發現,在TGF-β轉基因的小鼠中,給予Smad抑制劑刺激,則會導致銀屑病皮損明顯改善以及相關浸潤細胞因子的減少,所以認為TGF-β介導銀屑病樣皮損是通過Smad依賴途徑,且應用Smad抑制劑靶向阻斷TGF-β/Smad信號通路可能是銀屑病的一個新的治療靶點[10]。
去泛素化酶泛素特定肽酶15(ubiquitin specific peptidase-15, USP15)是TGF-β信號通路的調節劑,整個通路需要依賴TGF-β信號的抑制因子Smad7以及TGF-β受體1(TbetaR-I)實現。USP15在許多腫瘤的機制中被認為發揮重要作用,有研究發現在銀屑病皮損和細胞系中USP15和Smad7的表達高度正相關,而USP15與TbetaR-I以及Smad7與TbetaR-I的表達呈負相關,同時在Hacat細胞系中轉染USP15則導致TbetaR-mRNA上調以及Smad7的下調,可以認為USP15在銀屑病的發病中起重要作用,且可能通過調控TbetaR-I/Smad7或其他通路實現[11]。
2 激酶傳導途徑
2.1 JAK/STAT(Janus kinase/signal transducer and activator of transcription)酪氨酸激酶信號轉導及轉錄激活蛋白 大量研究顯示此信號通路參與包括造血和免疫反應在內的多種生理過程,調節JAK/STAT信號的基因突變可導致多種炎癥反應的失調以及骨髓增生性疾病,同時此信號通路及相關細胞因子在銀屑病發病機制中也被證實有至關重要的作用,可能是一個潛在的新的治療靶點[12]。JAK/STAT信號通路在銀屑病中發揮作用的主要為JAK/STAT1和JAK/STAT3,調控通路的細胞因子包括IFN-γ、IL-17、IL-22、IL-6等,且此通路不僅在T細胞中發揮作用,在角質形成細胞中也發揮重要作用。JAK/STAT3通路抑制劑枸櫞酸托法替布在銀屑病的應用已完成相關臨床試驗。銀屑性是一種T細胞介導的炎癥反應,JAK3主要表達在T細胞中,研究證實[13]在銀屑病樣小鼠中選擇性阻斷JAK3信號可導致臨床上銀屑病皮損減輕及銀屑病組織標志物的減少,引起導致銀屑病相關細胞因子如IL-17、IL-22、IL-23以及TNF-α等細胞因子的顯著降低[14-16]。
IL-22是由不同種類的淋巴細胞(如活化T細胞,Th17、Th22、NK細胞等)產生的IL-10細胞因子家族的成員,其發揮功能主要是通過IL22-IL22R復合物的形成以及隨后的JAK傳感器和JAK-STAT信號通路的活化。有研究證實其在包括銀屑病在內的多種自身免疫性疾病中有至關重要的作用[17],其主要通過抗菌蛋白促進形成生物屏障以及干擾終端角質層細胞的分化、募集中性粒細胞誘導細胞因子的產生等方式調節角質形成細胞的功能[18]。
有研究將豚鼠分為銀屑病組和正常組,用流式細胞分析技術分別檢測外周血中的Th17/IL-17的比例,同時運用免疫組化和蛋白印跡檢測STAT和血管內皮生長因子(Vascular endothelial growth factor,VEGF)的濃度,結果銀屑病組Th17的表達顯著高于正常對照組,Th17相關因子STAT3和VEGF也較正常對照組顯著升高,和Th17的表達正相關,結果提示Th17細胞在銀屑病的發病中發揮作用可能是通過STAT3-VEGF通路實現的[19]。
微囊蛋白-1(caveolin-1,CAV-1)參與信號轉導的調節,異常的CAV-1表達參與很多疾病的發病,關于是否參與銀屑病的發病,有研究發現銀屑病患者皮損表皮中CAV-1的表達顯著降低;而使體外角質形成細胞中CAV-1基因沉默則顯示出STAT-3信號通路強烈的活化,以及角蛋白16和幾種銀屑病相關細胞因子(如TNF-α)的高表達;此外,在銀屑病樣小鼠模型中控制CAV-1區域肽段則會改善皮膚表型、降低表皮厚度和浸潤細胞計數,且相關細胞因子TNF-α、IL17A和IL23等均顯著被抑制。綜上研究證實CAV-1可能通過STAT3信號通路和細胞因子網絡在銀屑病的發病機制中起作用[20]。
2.2 MAPK(Mitogen-activated protein kinase)絲裂原激活的蛋白激酶通路 趨化因子樣因子-1(Chemokine-like factor 1,CKLF1)被認為參與銀屑病的局部炎癥和細胞增殖。有研究發現銀屑病患者皮損中CKLF1及其受體CCR4的表達均升高,且在其誘導的C端肽(C19和C27)的刺激下,人原始臍靜脈內皮細胞顯示高度增殖,此外,肽的增強作用還伴隨著ERK1/2-MAPK信號通路的活化,因此我們認為CKLF1通過促進微血管內皮細胞的增殖參與銀屑病的發生,且可能是通過ERK1/2-MAPK的活化來實現的[21]。
另外,新發現的數據顯示p38 MAPK、ERK1/2(Extracellular signal-regulated kinase1/2)和JNK(c-Jun N-terminal kinase)在銀屑病的發生發展中發揮潛在作用[22]。
2.3 PI3K/mTOR(Phosphatidyl Inositol 3-kinase/Mammalian Target Of Rapamycin)/Akt磷脂酰肌醇-3-羥激酶激酶/雷帕霉素靶蛋白/蛋白激酶B信號通路 腫瘤抑制磷酸酶和張力蛋白同族體(Tumor suppressor phosphatase and tensin homolog,PTEN)可通過PI3K/Akt信號通路抑制細胞的增殖,其功能缺失和突變在許多腫瘤中得到驗證。在銀屑病的研究中發現,相較于正常皮膚對照組,銀屑病患者皮損組PTEN的mRNA水平降低,PTEN蛋白也低表達,結合前期有研究證實,銀屑病皮損中Akt的活化高于正常對照組,得出結論,PTEN的下調可能通過在銀屑病皮損中過度活化PI3K/Akt信號通路發揮作用,與銀屑病角質形成細胞的過度增殖密切相關[23]。
現有證據表明,中樞神經系統與免疫系統在銀屑病的發病機制中存在雙向作用,而皮膚神經系統在其中的作用卻尚未明了。近期有研究發現,將神經生長因子(Nerve growth factor, NGF)作用于銀屑病樣細胞模型中,出現低氧誘導因子-1α(Hypoxia-inducible factor-qα)和VEGF的升高,而且mTOR抑制物雷帕霉素預處理之后不會出現上述數據的走高,研究認為,NGF在銀屑病樣細胞系中調控VEGF的表達是通過PI3K/mTOR信號通路實現的[24]。此外,關于PI3K/Akt/mTOR信號通路在銀屑病的發病機制中出現越來越多的研究,許多針對細胞間信號的小分子進行預處理表現出顯著的有效性。眾多數據表明PI3K/Akt/mTOR信號通路可能是銀屑病的一個潛在治療靶點[25]。
3 核內基因轉錄水平途徑
3.1 NF-KappaB(Nuclear transcription factor kappa B)核轉錄因子通路 核轉錄因子是一個可以精細調節多種炎癥和復雜生物過程的蛋白轉錄因子,也是多種免疫和炎癥通路的關鍵調節因素,在細胞的增殖、分化和凋亡中都起重要作用,而此重要作用主要是通過調節編碼促炎調節因子、擴大和維持慢性炎癥反應以及抗凋亡等多種類的基因實現的,其始動于一些促炎刺激物,如TNF、IL-1等的激發。銀屑病也是一種慢性炎癥性皮膚病,并以高水平活化的磷酸化的NF-kappaB為主要標志,基因組專家也經研究證實銀屑病和NF-kappaB通路的調控息息相關,并與其角質形成細胞和免疫細胞行為的改變聯系起來,隨后也出現了針對此通路的銀屑病靶向治療方法[26]。
水通道蛋白(Aquaporin3, AQP3)是一種水/甘油通道蛋白,被發現可以轉運H2O2,有研究發現敲除AQP3的銀屑病樣小鼠可使IL-23誘導的銀屑病樣皮損減輕,同時伴隨NF-kappaB通路活化以及細胞間H2O2積聚的異常,而H2O2起調節NF-kappaB活化的作用,這些數據表明,銀屑病中TNF-α誘導的NF-kappaB通路依賴于AQP3的表達[27]。
胱冬肽酶募集結構域家族成員CARD14基因的突變被認為與銀屑病的發病相關。CARD14是一種調節NF-kappaB活化的折疊蛋白,而與銀屑病相關的CARD14的突變導致NF-kappaB信號的增強。有研究運用免疫熒光技術證明,CARD14高表達于CD31+的內皮細胞,同時在CARD14+CD31+的內皮細胞中也發現了磷酸化的NF-kappaB,所以認為CARD14在內皮細胞中通過NF-kappaB信號通路的表達對銀屑病中增加細胞因子的表達和免疫細胞的招募起重要作用[28]。
富半胱氨酸61(Cysteine-rich 61,Cyr61/CCN1)是一種細胞外基質蛋白,也是一種高度表達在銀屑病皮損中的促炎因子,有研究表明,阻斷CCN1的功能可以引起銀屑病樣小鼠模型表皮增生和炎癥減輕,同時CNN1可導致正常人角質形成細胞和細胞系的活化,包括細胞增殖和免疫相關分子的表達,并且CCN1的刺激還活化了下游的磷酸肌醇-3激酶/Akt/NF-kappaB信號通路[29]。
β-轉導重復相容蛋白(Beta-transducin repeat-containing protein,betaTrCP)是一種識別泛素連接酶組成成分的基質,可以控制重要信號通路調節器的穩定性,如銀屑病的關鍵炎癥信號通路-NF-kappaB信號通路。有研究顯示,咪喹莫特誘導的銀屑病樣小鼠模型中betaTrCP水平升高,kappaB抑制物降低,NF-kappaB活化增強,而且在TNF-α誘導的銀屑病樣細胞模型和正常人角質形成細胞中敲除betaTrCP可以顯著抑制NF-kappaB信號通路的過度活化和細胞間粘附分子1(ICAM-1)的表達,可以認為,betaTrCP可能參與NF-kappaB信號通路介導的銀屑病相關炎癥反應,同時也是一個潛在的治療靶點[30]。
3.2 Wnt信號通路 分泌型卷曲相關蛋白4(secreted frizzled-related protein-4,SFRP-4)是Wnt信號通路的負性調控因子,在銀屑病動物模型及患者皮損中均表達降低,SFRP4直接抑制過量角質形成細胞的增殖,給予Wnt信號通路的抑制劑或體內注射SFRP4可改善銀屑病的皮膚表現,包括炎癥細胞的浸潤等組織病理改變,可以認為SFRP的下調可能是銀屑病的發病機制之一[31]。
3.3 TLR7(Toll-like receptor7)介導的信號通路 腺病毒N端24氨基酸綠色熒光蛋白(adenovirus Nterminal 24 amino acids green fluorescent protein, ADN24GFP)有效抑制內毒素誘導的相關細胞因子的表達,p55磷脂酰肌醇3激酶(p55 regulatory subunit, p55PIK)的高表達與內毒素協同作用促進炎癥因子的釋放,且在體外銀屑病樣細胞中發現,ADN24GFP和p55PIKGFP影響內毒素誘導炎癥因子釋放的作用是通過TLRs/MyD88信號通路實現的[32]。
此外,TLR1,2在銀屑病患者皮損中高表達,TLR4在點滴型銀屑病中表達高于斑塊型和正常對照人群,TLR5,9在銀屑病角質形成細胞中通過TGF-α而上調,另外Begon等發現銀屑病角質形成細胞中TLR2,3,4信號通路誘導的TNF-α和IL-8的表達是通過NF-kB核轉位實現的。基于以上研究事實,TLR基因在銀屑病的發病機制中可能扮演重要角色[33]。
總之,銀屑病作為一種以遺傳、免疫和環境為基礎多因素參與的復雜疾病,其信號通路錯綜復雜,環環相扣(圖1)。本文希望通過對幾大主要通路的簡要梳理,對銀屑病的發病機制有個更為宏觀的認識,為之后更深入的機制探索理清思路。
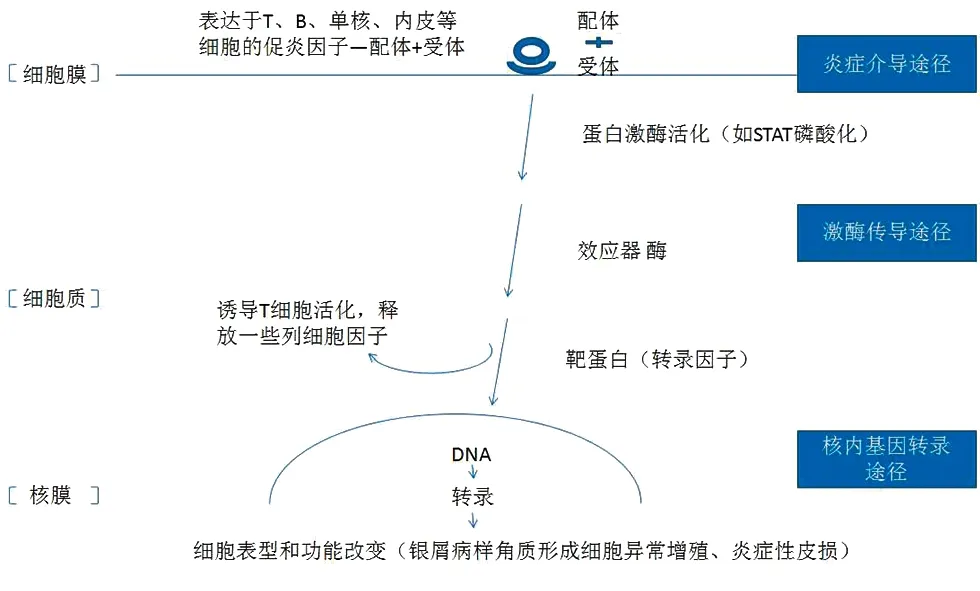
圖1 銀屑病信號通路宏觀梳理概括
[1] Di Cesare A, Di Meglio P, Nestle FO. The IL-23/Th17 axis in the immunopathogenesis of psoriasis[J]. J Invest Dermatol,2009,129(6):1339-1350.
[2] Perera GK, Di Meglio P, Nestle FO. Psoriasis[J]. Annu Rev Pathol,2012,7:385-422.
[3] Kastelein RA, Hunter CA, Cua DJ. Discovery and biology of IL-23 and IL-27: related but functionally distinct regulators of inflammation[J]. Annu Rev Immunol,2007,25:221-242.
[4] Rizzo HL, Kagami S, Phillips KG, et al. IL-23-mediated psoriasis-like epidermal hyperplasia is dependent on IL-17A[J]. J Immunol,2011,186(3):1495-1502.
[5] Jeong SH, Kim HJ, Jang Y, et al. Egr-1 is a key regulator of IL-17A-induced psoriasin upregulation in psoriasis[J]. Exp Dermatol,2014,23(12):890-895.
[6] Johansen C. IκBζ: A key protein in the pathogenesis of psoriasis[J]. Cytokine,2016,78:20-21.
[7] Jackson M, Howie SE, Weller R, et al. Psoriatic keratinocytes show reduced IRF-1 and STAT-1alpha activation in response to gamma-IFN[J]. FASEB J,1999,13(3):495-502.
[8] Gaur U, Aggarwal BB. Regulation of proliferation, survival and apoptosis by members of the TNF superfamily[J]. Biochem Pharmacol,2003,66(8):1403-1408.
[9] Locksley RM, Killeen N, Lenardo MJ. The TNF and TNF receptor superfamilies: integrating mammalian biology[J]. Cell,2001,104(4):487-501.
[10] Zhang Y, Meng XM, Huang XR, et al. Transforming growth factor-β1 mediates psoriasis-like lesions via a Smad3-dependent mechanism in mice[J]. Clin Exp Pharmacol Physiol,2014,41(11):921-932.
[11] Feng AP, He YM, Liu XX, et al. Expression of USP15, TβR-I and Smad7 in psoriasis[J]. J Huazhong Univ Sci Technolog Med Sci,2014,34(3):415-419.
[12] Palanivel JA, Macbeth AE, Chetty NC, et al. An insight into JAK-STAT signalling in dermatology[J]. Clin Exp Dermatol,2014,39(4):513-518.
[13] Chang BY, Zhao F, He X, et al. JAK3 inhibition significantly attenuates psoriasiform skin inflammation in CD18 mutant PL/J mice[J]. J Immunol,2009,183(3):2183-2192.
[14] Boy MG, Wang C, Wilkinson BE, et al. Double-blind, placebo-controlled, dose-escalation study to evaluate the pharmacologic effect of CP-690,550 in patients with psoriasis[J]. J Invest Dermatol,2009,129(9):2299-2302.
[15] Papp KA, Menter A, Strober B, et al. Efficacy and safety of tofacitinib, an oral Janus kinase inhibitor, in the treatment of psoriasis: a Phase 2b randomized placebo-controlled dose-ranging study[J]. Br J Dermatol,2012,167(3):668-677.
[16] Ports WC, Khan S, Lan S, et al. A randomized phase 2a efficacy and safety trial of the topical Janus kinase inhibitor tofacitinib in the treatment of chronic plaque psoriasis[J]. Br J Dermatol,2013,169(1):137-145.
[17] Yang X, Zheng SG. Interleukin-22: a likely target for treatment of autoimmune diseases[J]. Autoimmun Rev,2014,13(6):615-620.
[18] Sabat R, Wolk K. Research in practice: IL-22 and IL-20: significance for epithelial homeostasis and psoriasis pathogenesis[J]. J Dtsch Dermatol Ges,2011,9(7):518-523.
[19] Zheng XF, Sun YD, Liu XY. Correlation of expression of STAT3, VEGF and differentiation of Th17 cells in psoriasis vulgaris of guinea pig[J]. Asian Pac J Trop Med,2014,7(4):313-316.
[20] Yamaguchi Y, Watanabe Y, Watanabe T, et al. Decreased Expression of Caveolin-1 Contributes to the Pathogenesis of Psoriasiform Dermatitis in Mice[J]. J Invest Dermatol,2015,135(11):2764-2774.
[21] Tan Y, Wang Y, Li L, et al. Chemokine-like factor 1-derived C-terminal peptides induce the proliferation of dermal microvascular endothelial cells in psoriasis[J]. PLoS One,2015,10(4):e0125073.
[22] Mavropoulos A, Rigopoulou EI, Liaskos C, et al. The role of p38 MAPK in the aetiopathogenesis of psoriasis and psoriatic arthritis[J]. Clin Dev Immunol,2013,2013:569751.
[23] Li Y, Man X, You L, et al. Downregulation of PTEN expression in psoriatic lesions[J]. Int J Dermatol,2014,53(7):855-860.
[24] Zhang J, Ma WY. Nerve growth factor regulates the expression of vascular endothelial growth factor in human HaCaT keratinocytes via PI3K/mTOR pathway[J]. Genet Mol Res,2014,13(4):9324-9335.
[25] Huang T, Lin X, Meng X, et al. Phosphoinositide-3 kinase/protein kinase-B/mammalian target of rapamycin pathway in psoriasis pathogenesis. A potential therapeutic target?[J]. Acta Derm Venereol,2014,94(4):371-379.
[26] Goldminz AM, Au SC, Kim N, et al. NF-κB: an essential transcription factor in psoriasis[J]. J Dermatol Sci,2013,69(2):89-94.
[27] Hara-Chikuma M, Satooka H, Watanabe S, et al. Aquaporin-3-mediated hydrogen peroxide transport is required for NF-κB signalling in keratinocytes and development of psoriasis[J]. Nat Commun,2015,6:7454.
[28] Harden JL, Lewis SM, Pierson KC, et al. CARD14 expression in dermal endothelial cells in psoriasis[J]. PLoS One,2014,9(11):e111255.
[29] Sun Y, Zhang J, Zhou Z, et al. CCN1, a Pro-Inflammatory Factor, Aggravates Psoriasis Skin Lesions by Promoting Keratinocyte Activation[J]. J Invest Dermatol,2015,135(11):2666-2675.
[30] Li R, Wang J, Wang X, et al. Increased βTrCP are associated with imiquimod-induced psoriasis-like skin inflammation in mice via NF-κB signaling pathway[J]. Gene,2016,592(1):164-171.
[31] Bai J, Liu Z, Xu Z, et al. Epigenetic downregulation of SFRP4 contributes to epidermal hyperplasia in psoriasis[J]. J Immunol,2015,194(9):4185-4198.
[32] Lv F, Yu Y, Wang G, et al. Mechanisms by which the N-terminal 24 amino acids of the p55 regulatory subunit of phosphatidylinositol 3-kinase affect endotoxin-induced cytokine release in human keratinocytes[J]. Mol Med Rep,2015,11(5):3753-3759.

