β地中海貧血基因檢測結合HLA配型的胚胎植入前遺傳學診斷成功1例
丁濤,陽彥,趙琰,伍瓊芳,吳興武,胡毅娜
(江西省婦幼保健院,南昌 330006)
地中海貧血是一種全球范圍內的疾病,可以分為 α地貧、β地貧、δ地貧、γ地貧、δβ地貧和εγδβ地貧等。α和β地貧是人群中最常見的地貧類型[2,3],全球地貧基因攜帶者頻率高達2.62%,包括中國南方在內的東南亞地區、印度次大陸、地中海地區、中東、北非和太平洋地區都是該病的高發地區[4,5]。 β 地中海貧血是人 β 珠蛋白(HBB)基因突變的單基因遺傳病,由于位于11號染色體上的β珠蛋白基因突變,導致正常β珠蛋白肽鏈缺失或合成量不足,a肽鏈相對過剩并沉積在紅細胞膜上,使紅細胞破壞出現溶血性貧血[6,7]。
1 臨床資料
患者,女,23歲,2014年足月順產一子(半歲時診斷為重度β地中海貧血,基因型:βIVS-2-654/βIVS-2-654),2015年孕5+月羊穿提示胎兒為β地中海貧血引產。夫妻雙方均為β地中海貧血基因攜帶者(βIVS-2-654/βN)。于 2016年 7月來我院輔助生殖中心擬行以β地中海貧血基因檢測結合HLA配型為目的的胚胎植入前遺傳學診斷(preimplantation geneticdiagnosis,PGD)(簡稱 PGD-HLA) 助孕治療。經過遺傳咨詢,在治療開始前患者夫婦被告知治療方案及流程、誤診的風險、不能獲得HLA配型相符的胚胎的可能,并簽署知情同意書。
收集夫婦雙方及先證者的外周血,建立家系的單體型。以基因HBB(NM_000518.4 chr11:5246696-5248301反向轉錄)區域及側翼10bp序列作為目標區域,并在基因上下游選擇若干SNP位點作為遺傳標記,半導體法高通量測序,檢測SNP位點基因型,選擇其中相應位點構建單體型,進行連鎖分析。SNP位點分布見表1。
以HLA-A基因上游,HLA-A與HLA-B之間,HLA-B與 HLA-DRA之間,HLA-DRA與HLA-DQB1之間,以及HLA-DQB1上游作為目標區域,選擇197個高密度緊密連鎖的SNP作為遺傳標記,利用ION AMPLISEQTM DESIGNER網站設計引物,經DNA純化、建庫、PGM測序后,選擇若干有效位點進行單體型分析。所有位點分成5部分進行建立單體型:HLA-A和上游區域位點;HLA-B和下游區域位點;HLA-DRA和上游區域位點;HLA-DQB1和下游區域位點;HLA-DQB1上游區域位點。通過單體型分析,該家系通過單體型PGD預實驗。患者于2017年3月采用經典黃體期長方案,充分降調節后給予卵泡刺激素150IU進行控制性超促排卵,促排期間根據卵泡發育情況調整Gn用量,共Gn9d,Gn總量1575IU,共獲卵27枚,其中MⅡ期卵子19枚。通過胞漿內單精子顯微注射(ICSI)法授精,受精后卵子置于瑞典vitrolife卵裂期培養液中,在濕化37℃美國cook三氣培養箱(5%CO2,5%O2和90%N2)中孵育至第3d。選擇第3d 2PN卵裂胚胎行透明帶激光輔助孵化打孔,繼續培養至第5d和第6d,共形成10枚可利用囊胚,分別為5BB×7,5BC×3,均行活檢。活檢后囊胚利用玻璃化冷凍技術[1]進行胚胎冷凍保存,待檢測結果出來后擇期胚胎復蘇移植。活檢后囊胚滋養層細胞通過Sureplex法全基因組擴增,利用擴增后產物對β地中海貧血的致病基因HBB基因及HLA基因的STR位點進行檢測分析。在活檢的10枚囊胚中,El、E2、E3、E5、E7、E9、E10 為攜帶致病基因的雜合型,E8為完全正常胚胎。E4、E6為重型β地貧基因型。同時E1、E3 HLA配型相符。檢測結果見表2。患者于2017年7月行凍胚復蘇移植周期治療,移植胚胎El后獲得臨床持續妊娠,妊娠18+3周時抽羊水進行β地貧產前基因診斷為βIVS-2-654/βN,HLA基因分型與先證者配對成功,與PGD-HLA結果一致,核型分析未見明顯異常,13,18,21,X/Y染色體未見非整倍體數目異常。目前已順利分娩并成功行造血干細胞移植 (hemopoietic stem celltransplantation,HSCT)治療。
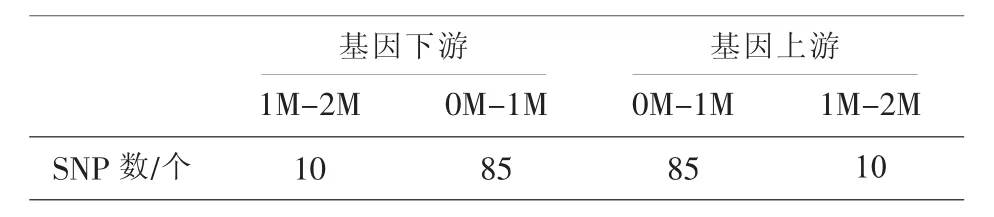
表1 SNP位點分布

表2 囊胚檢測結果
2 討論
目前重型β地中海貧血,臨床上治療手段有限,患者只能通過長期輸血及去鐵治療來維持生命,而且反復多次輸血會增加血源性疾病傳播的危險,對患者和家庭造成沉重精神壓力和經濟負擔。迄今為止唯一的根治方法是HSCT治療,但由于配型合適的供者難尋,并且移植費用昂貴,大部分患者難以得到救治。有血緣關系且配型相符的供者比非親緣或配型不符的供者能明顯提高受者HSCT后的生存率,但大部分有HSCT需求的患者無法獲得親緣且配型相符的造血干細胞。PGD是以體外受精—胚胎移植技術(IVF-ET)為基礎,通過對植入前的胚胎進行遺傳病的分子診斷,選擇沒有疾病表型的胚胎移植[8]。它能有效避免被動妊娠遺傳病患兒流產或引產給夫婦帶來的痛苦。本病例應用PGD-HLA技術獲得了有血緣關系且配型相符的供者。目前胎兒各項生長發育指標均正常,成為江西省PGD-HLA技術的首例獲益者,填補了江西省PGD技術相關領域的空白。PGD-HLA技術可有效為有β地中海貧血先證者的家庭提供優生的選擇,在獲得健康新生兒的同時,也為先證者提供了HSCT治療的機會。
[1]伍瓊芳,丁濤,胡毅娜,等.1658例玻璃化凍融周期的臨床結局分析[J].江西醫藥,2014,49(7):570-573.
[2]Galanello R,Origa R.Beta-thalassemia [J].Orphanet J Rare Diseases,2010,5(1):11.
[3]Harteveld CL,Higgs DR.Alpha-thalassaemia[J].Orphanet J Rare Diseases,2010,5(1):13.
[4]Modell B,Darlison M.Epidemiología mundial de las hemoglobinopatías e indicadores de los servicios correspondientes[J].Bulletin of the World Health Organization,2008,86:480-487.
[5]WeatherallDJ,WilliamsTN,Allen SJ,etal.The population genetics and dynamics of the thalassemias[J].Hematology/oncology Clinics of North America,2010,24(6):1021.
[6]李玲麗,張風波,李崎,等.基因修復β-地中海貧血患者誘導多能干細胞可否成為治療的希望?[J].中國組織工程研究,2017,21(9):1463-1469.
[7]Ribeil JA,Arlet JB,Dussiot M,et al.Ineffective erythropoiesis in β-thalassemia[J].Scientific World Journal,2013,2013:394295.
[8]劉新顏,王靜,曾艷紅,等.β地中海貧血基因檢測結合HLA配型的胚胎植入前遺傳學診斷技術的臨床應用[J].中華婦產科雜志,2016,51(7):491-497.

