富含OPO的植物乳脂粉與腸道微生物體外發酵特性研究
劉蔚宇,葉子青,李琳琳,侯愛香,李宗軍
(湖南農業大學食品科學技術學院 長沙410128)
0 引言
1,3-二油酸-2-棕櫚酸甘油三酯,簡稱OPO,是豬油和母乳脂的主要三甘酯成分之一,其棕櫚酸主要分布于Sn-2位。OPO作為營養補充劑,能在人體消化時不易形成鈣皂,更易于脂肪酸和鈣的消化吸收,目前多添加在嬰幼兒配方奶粉中,是嬰幼兒配方奶粉母乳化過程中的關鍵添加成分,對嬰幼兒健康成長有至關重要的作用[1-3]。但國內外嬰幼兒配方奶粉中添加的多是結構脂質OPO,這種結構脂質OPO產品,通常以兩種形式添加到嬰幼兒配方奶粉中,一是制成富含OPO的植物乳脂油,濕法加入奶粉中,二是制成粉劑營養補充劑,即富含OPO的植物乳脂粉,干法加入奶粉中,目前,國內多采用干法加入的方式。
人體腸道內約寄生著450種腸道微生物,它們大多具有促進腸道蠕動,幫助人體新陳代謝,預防感染和自體免疫疾病的功能,另有一些特殊菌群甚至還能夠控制人體對癌癥治療藥物的反應[4]。由此可見,腸道菌群是我們人體必不可少的一部分,有些研究者將其稱之為我們身體的一個“器官”[5],在人體糞便中,這些腸道微生物的數量能高達1011~1012cfu/g[6]。人體腸道菌群的數量與種類隨著年齡的增長而改變,有研究表明,成人體內的腸道菌群相較于嬰幼兒時期的體內腸道菌群更具多樣性和穩定性[7]。腸道微生物已成為人們研究膳食因子營養機制的重要載體,其與膳食因子的互作效應也成了研究熱點。但大部分傳統研究膳食與腸道微生物關系的方式是動物試驗,容易引發道德和倫理爭議,且試驗周期長,操作復雜,不利于科學試驗的高效開展。而研究者同時發現,腸道微生物體外厭氧發酵和腸道內發酵在細菌數量、組成、多樣性和代謝產物等方面都相似,因此本研究采用靜態間歇式體外厭氧發酵模式,研究富含OPO的植物乳脂粉與腸道菌群的體外發酵特性。
多年監測表明:我國青年、少年身體素質呈持續下降趨勢[8]。青年大學生是國家的人才主力,但很大一部分大學生由于遠離家庭的監管,飲食和作息不規律,同時學習競爭激烈,就業和深造壓力大,身體素質大不如前,已經引起社會的廣泛關注。目前,營養補充劑結構脂質OPO應用范圍相對較小,為進一步拓寬OPO的應用范圍,提高大學生的身體素質,本研究以健康普通大學生的新鮮糞便為菌源,從膳食因子對腸道微生態影響的角度入手,研究不同時期(0,4,8,12,24 h)原料對腸道菌群的影響,并計算益生元指數和B/E值,測定發酵環境的pH值,為結構脂質OPO產品的進一步推廣提供基礎數據,為大學生營養食品的開發提供前期研究。
1 材料與方法
1.1 材料
1.1.1樣品
植物乳脂粉,含有50%植物精煉油(含有40%OPO的棕櫚油);4.21%蛋白質;41.63%乳糖;3.72%水;0.44%穩定劑;乳化劑;礦物質;維生素和其他物質成分。
1.1.2 培養基
(1)含氮基礎培養基:1L純凈水含有蛋白胨2 g,酵母粉 2 g,N aC l 0.l g,K2HPO40.04 g,M gSO4·7H2O 0.01 g,CaC l2·7H2O 0.01g,N aHCO32 g,氯化血紅素0.05 g,L-半胱氨酸0.5 g,膽汁酸鹽0.5 g,吐溫-80 2 m L,VK 10μL,0.025 g/100m L刃天青4m L。
(2)選擇性培養基:營養瓊脂用于計數總需氧菌[9];W ilkins and Chalgren瓊脂用于計數總厭氧菌[10];Beerens瓊脂用于計數雙歧桿菌[11];R ogosa培養基用于計數乳酸桿菌[12];EC培養基用于計數腸球菌[13];Sulfite-polym yxin-m ilk瓊脂用于計數梭狀芽孢桿菌[14];紫紅膽鹽葡萄糖瓊脂用于計數腸桿菌科菌;擬桿菌礦物鹽瓊脂(自制)用于計數擬桿菌[15]。擬桿菌礦物鹽瓊脂按配方自制:葡萄糖15.0 g,磷酸二氫鉀4.0 g/L,磷酸氫二鈉2.0 g/L,硫酸銨0.5 g/L,氯化鈉9.0g/L,氯化鎂0.15 g/L,氯化鈣0.01 g/L,氯化錳0.05 g/L,氯化鈷0.05 g/L,半胱氨酸0.8 g/L,碳酸氫鈉1.5 g/L,氯高鐵血紅素0.01 g/L,VB120.005 g/L,七水合硫酸鐵0.001 g/L,萘啶酮酸0.01 g/L,萬古霉素0.0025 g/L,瓊脂20.0 g/L。(除特殊規定外,本標準所用試劑均為分析純,水為蒸餾水或相應純凈水。)
1.2 主要試劑和儀器
稀釋液(0.9%生理鹽水);糞便取樣器,壓舌板,一次性手套,鑷子,牛皮紙,自封袋,EP管離心管,試劑瓶(采樣工具提前滅菌,部分塑料取樣用具再用DEPC水浸泡24 h以上);電熱恒溫水浴鍋HH-8(上海浦東物理光學儀器廠),分析天平TP-213(北京賽多利斯儀器系統有限公司),高壓蒸氣滅菌鍋SP500(日本YAMATO),超凈工作臺SW-CJ-2D(蘇州凈化設備有限公司),YQX-I厭氧培養箱(上海躍進醫療器械廠),恒溫生化培養箱SPX-250BS-II,pH計Testo205(Testo AG)。
1.3 試驗方法
1.3.1 樣品采集及準備
以3個健康大學生(女,年齡20~22歲)的糞便作為發酵菌種,要求實驗對象1個月內未服用抗生素,且無腸胃病史。采集每位試驗者的新鮮糞便50g于糞便取樣管中,存入-80℃冰箱備用。將3名志愿者的糞樣混合,然后將50 g混合糞樣稀釋到500 m L冷卻后的稀釋液(0.9%生理鹽水)中,加幾粒無菌玻璃珠渦旋15 s使糞便充分分散。稀釋的糞液用4層無菌紗布過濾,并將過濾得到的糞便懸浮液密封于一無菌器皿中。
1.3.2 腸道菌群富集培養
將上述含氮基礎培養基各配置450m L分裝于兩個試劑瓶中(標記A組,B組),滅菌備用。在A組中加入67.5 g的植物乳脂粉作為實驗組(根據國家食品安全標準GB1488-2012年食品營養補充使用標準,嬰幼兒配方奶粉OPO的添加量為24~96 g/kg,根據奶粉沖泡的一般稀釋:4.5 g奶粉/30m L水,制備發酵液A。本研究發酵液A以50 g/kg的添加量乘以配方奶粉稀釋比,使OPO初始濃度為質量濃度0.75%,B組為含氮基礎培養基,作為空白對照。各吸取50 m L糞便懸浮液加入發酵液A和B中,即接種量為10%,37℃厭氧發酵。
1.3.3 發酵液的分段收集及檢測
在發酵0,4,8,12,24 h時,將A組與B組分別吸取5個1m L液體分裝在含有9m L發酵液的EP管中密封,混勻后放入-80℃冰箱保存,備用。采用10倍梯度稀釋法稀釋發酵液(稀釋液為0.9%生理鹽水),選取各梯度稀釋液100μL均勻涂布8個腸道微生物指標的不同的選擇培養基上,從取樣至涂布結束在2 h內完成。涂布后總需氧菌、乳酸桿菌、腸球菌、腸桿菌科在37℃需氧培養24~48 h后分別計數,總厭氧菌、雙歧桿菌、擬桿菌和梭狀芽孢桿菌在37℃厭氧培養48~96 h分別計數。培養計數后菌落數在30~300的稀釋度即為該腸道菌種指標進行計數所需的最適稀釋度。選取各指標的最適梯度稀釋液100μL均勻涂布于不同的選擇培養基上,對菌落數在30~300的平板進行計數,并統計數據。
1.3.4 益生元指數的計算
益生元指數的計算公式如下:
PI=(Bif/Total)-(Bac/Total)+(Lac/Total)-(C los/Total)
上式中,Bif是指取樣時發酵液中雙歧桿菌的數量和接種時發酵液中雙歧桿菌的數量的比值,Bac是指取樣時發酵液中擬桿菌的數量和接種時發酵液中擬桿菌的數量的比值,Lac是指取樣時發酵液中乳酸桿菌的數量和接種時發酵液中乳酸桿菌的數量的比值,C los是指取樣時發酵液中梭狀芽孢桿菌的數量和接種時發酵液中梭狀芽孢桿菌的數量的比值,Total則是指取樣時發酵液中總腸道菌的數量和接種時發酵液中總腸道菌的數量的比值。該公式是以雙歧桿菌和(或)乳酸桿菌數量的增長有正面作用,而擬桿菌和(或)梭狀芽孢桿菌數量的增長有負面作用為基礎的。
1.3.5B/E值的計算
將雙歧桿菌的數量除以腸桿菌的數量即得到B/E值,B/E>1表示腸道菌群中雙歧桿菌的水平高于腸桿菌科的水平,B/E<1表示腸道菌群中雙歧桿菌的水平低于腸桿菌科的水平。
1.3.6 PH值測定
本研究采用pH計Testo205(Testo AG)對樣品發酵液進行pH值的測量。將pH計校準后放入厭氧培養箱,在箱內把探頭插入裝有樣品發酵液的10m L EP管中,顯示測得的溫度和PH值,讀數每秒更新2次,AUTO HO LD閃爍直到點亮,讀數固定不動后記錄讀數即為待測樣液pH值,按ON/HO LD鍵重新開始計數,記錄三組數據。
1.4 數據分析
所有數據統計分析采用SPSS14.0和O rigin6.0完成,顯著性差異(P<0.05)通過Turkey test程序進行。
2 結果與分析
2.1 發酵過程中微生物的變化及分析
本實驗通過微生物的定量分析可知,添加有OPO的人體糞便發酵液與空白對照組相比,其總需氧菌數、總厭氧菌數、雙歧桿菌、乳酸桿菌、腸球菌、擬桿菌、梭狀芽孢桿菌數和腸桿菌在發酵過程中存在顯著差異(P<0.05)。
2.1.1 總需氧菌和總厭氧菌的生長變化
由圖1不難看出,A組中總需氧菌的數量在發酵第0 h時幾乎與B組數量一致,分別是7.77 logCFU/m L和7.80 logCFU/m L,在發酵0~8 h A組與B組菌數一起增加,發酵第8 h時獲得各自生長數量最大值,分別為9.12 logCFU/m L和8.60 logCFU/m L,發酵第8 h后A組、B組菌數又一起下降,到發酵第24 h時菌落生長數分別為8.88 logCFU/m L和8.00 logCFU/m L,在整個發酵過程中,A組中總需氧菌的數量一直顯著高于(p<0.05)B組。由圖2可看出,A組與B組在發酵第0 h的總厭氧菌生長數量分別為7.81 logCFU/m L和7.62 logCFU/m L,B組中總厭氧菌的數量在0~8h緩慢增加,在發酵到12 h時急速下降,A組總厭氧菌的生長數量在0 h~4 h顯著增加(p<0.05),雖其菌數在發酵第8 h減少為8.56 logCFU/m L,但在整個發酵過程中A組的菌群數一直顯著高于(p<0.05)B組。因此,與空白對照組比較,OPO結構脂對總需氧菌和總厭氧菌都有增值作用,可明顯促進總需氧菌和總厭氧菌的生長繁殖速度。
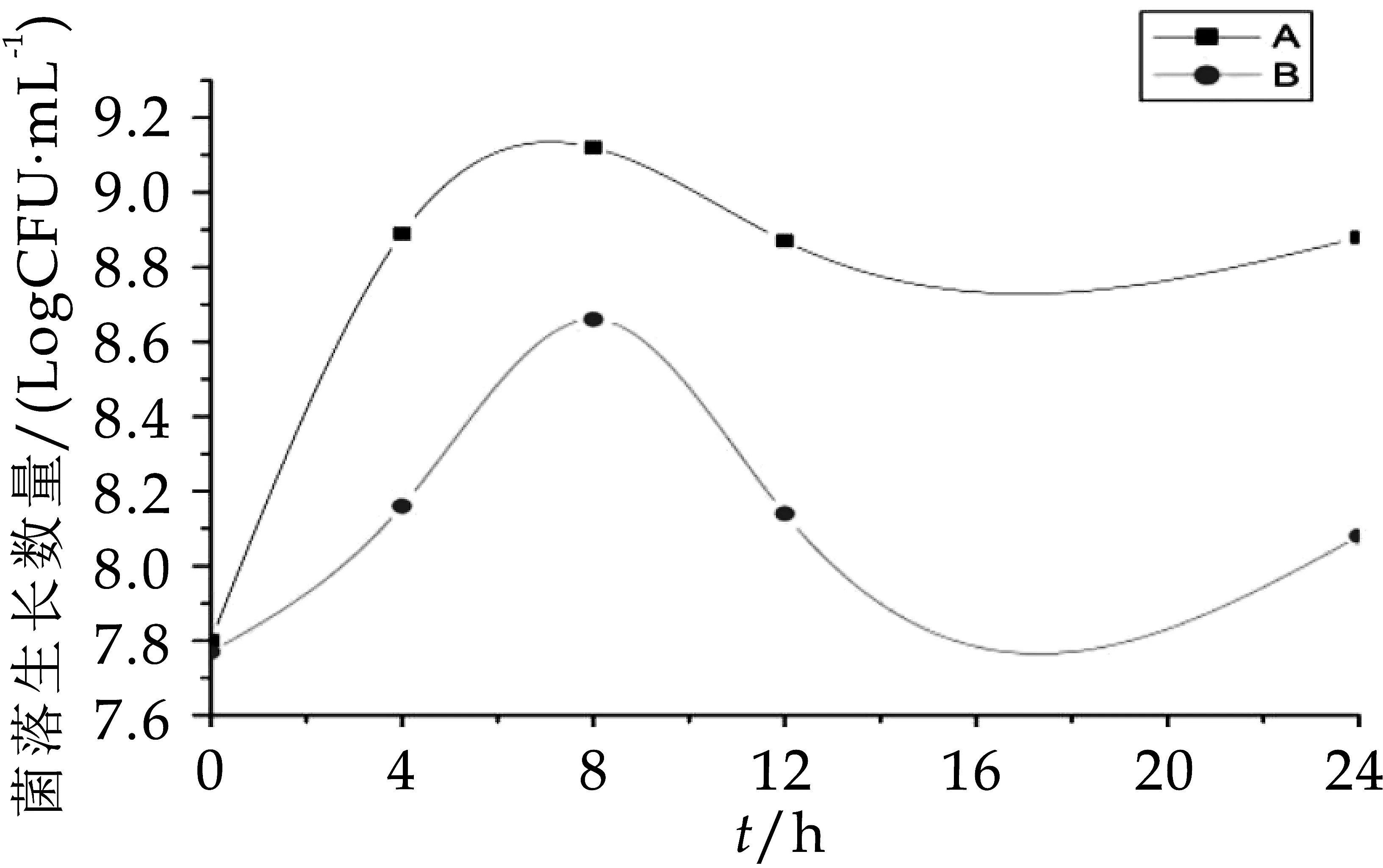
圖1 發酵中總需氧菌的生長變化
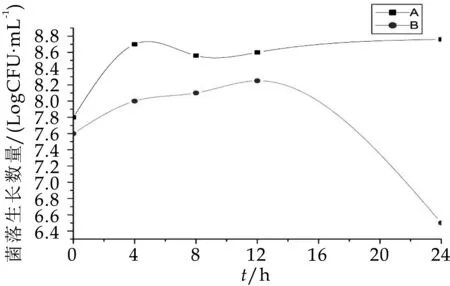
圖2 發酵中總厭氧菌的生長變化
2.1.2 雙歧桿菌、乳酸桿菌、腸球菌和擬桿菌的生長變化
從圖3-圖6可以看出,A組發酵中雙歧桿菌、乳酸桿菌、腸球菌和擬桿菌的生長數量均顯著高于(p<0.05)B組發酵中的生長數量。A組和B組中的雙歧桿菌在發酵第oh的數量差不多,分別為6.86 logCFU/m L和6.84 logCFU/m L,0~8 h A組、B組雙歧桿菌數一起增加,到發酵第8h時達到整個發酵過程的菌數最大值,分別為8.61 logCFU/m L和7.80 logCFU/m L,第8 h后雙歧桿菌數又一起減少。A組和B組中乳酸桿菌的數量變化趨勢十分相似(增加→減少→增加→減少)。A組中腸球菌數量0~8 h顯著增加,12 h平緩下降后回升,B組中腸球菌數量不僅數量低于A組,且增長趨勢起起伏伏,極不穩定,在發酵第8 h菌數驟減,隨后又回升,在16~24 h顯著減少。A組和B組的擬桿菌數量變化趨勢在0~12h也十分相似,但在12 h后
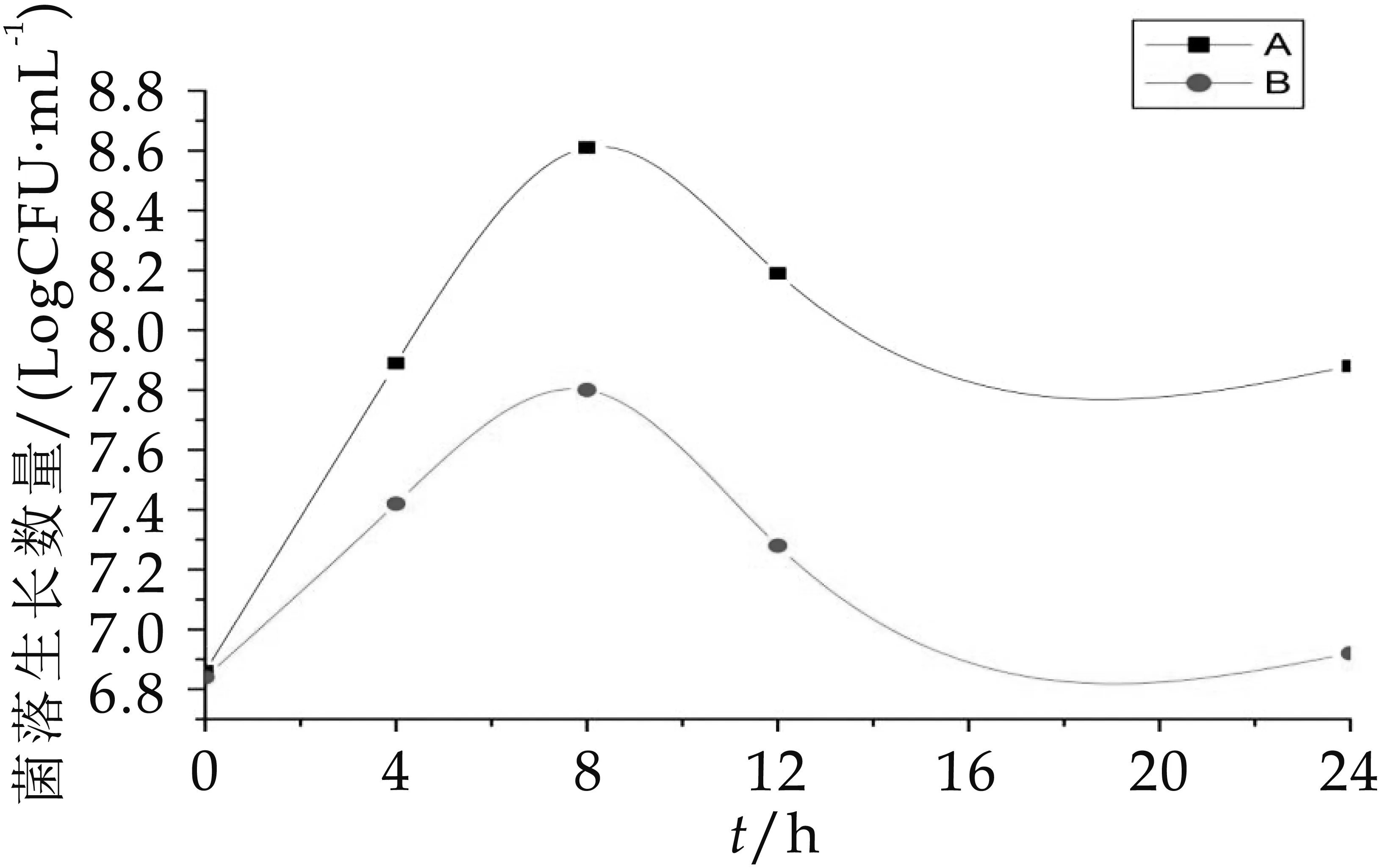
圖3 發酵中雙歧桿菌的生長變化
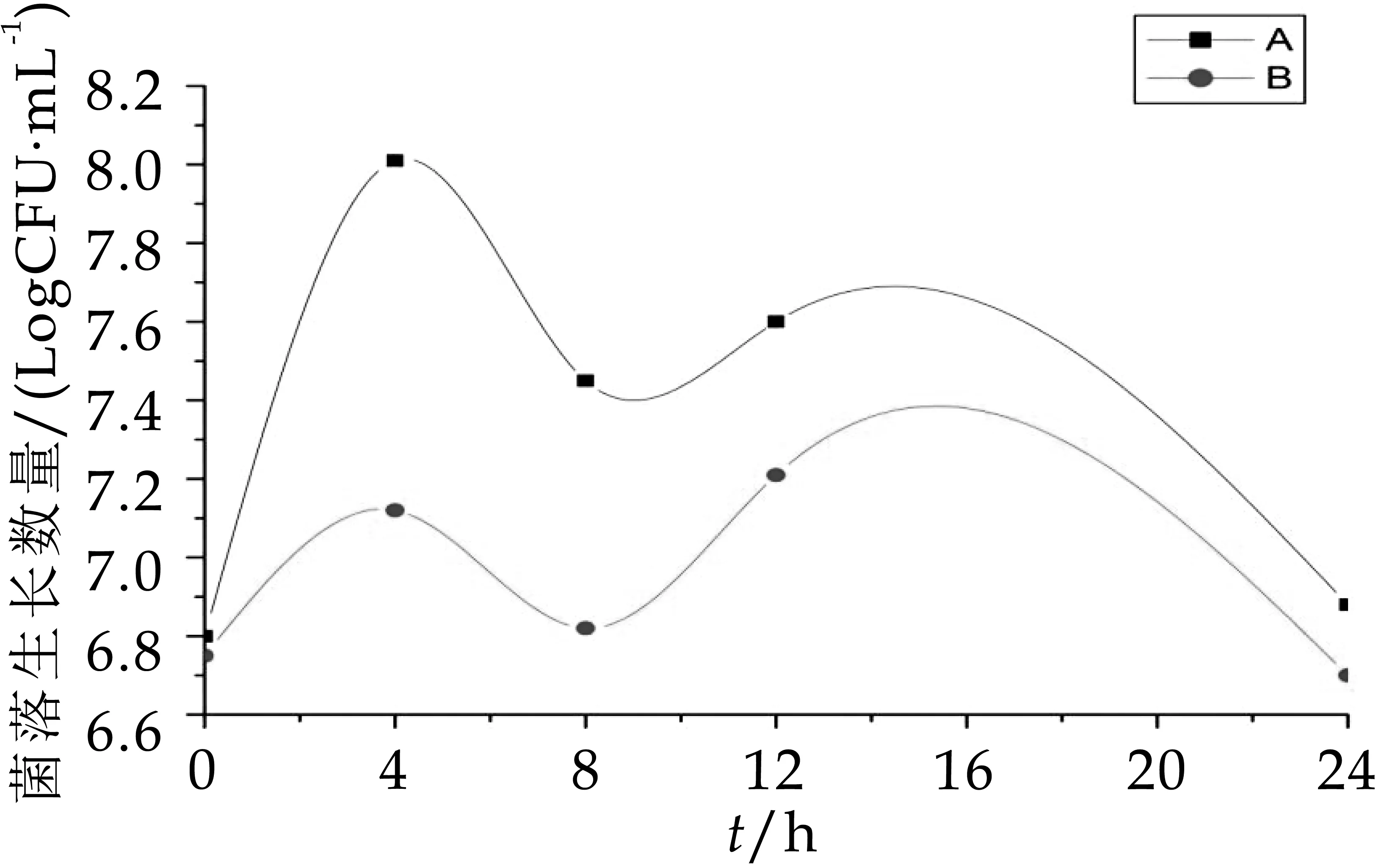
圖4 發酵中乳酸桿菌的生長變化
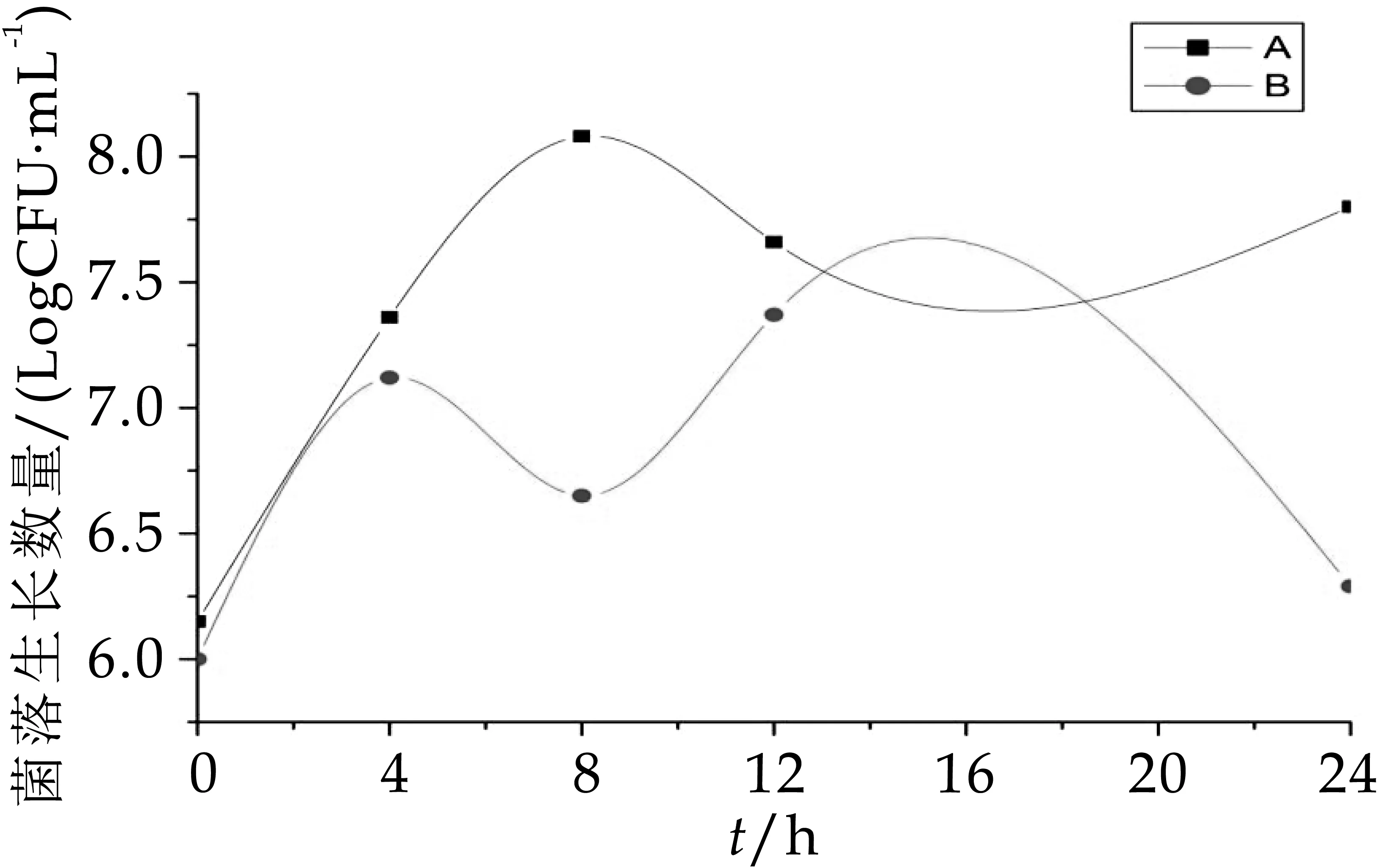
圖5 發酵中腸球菌的生長變化
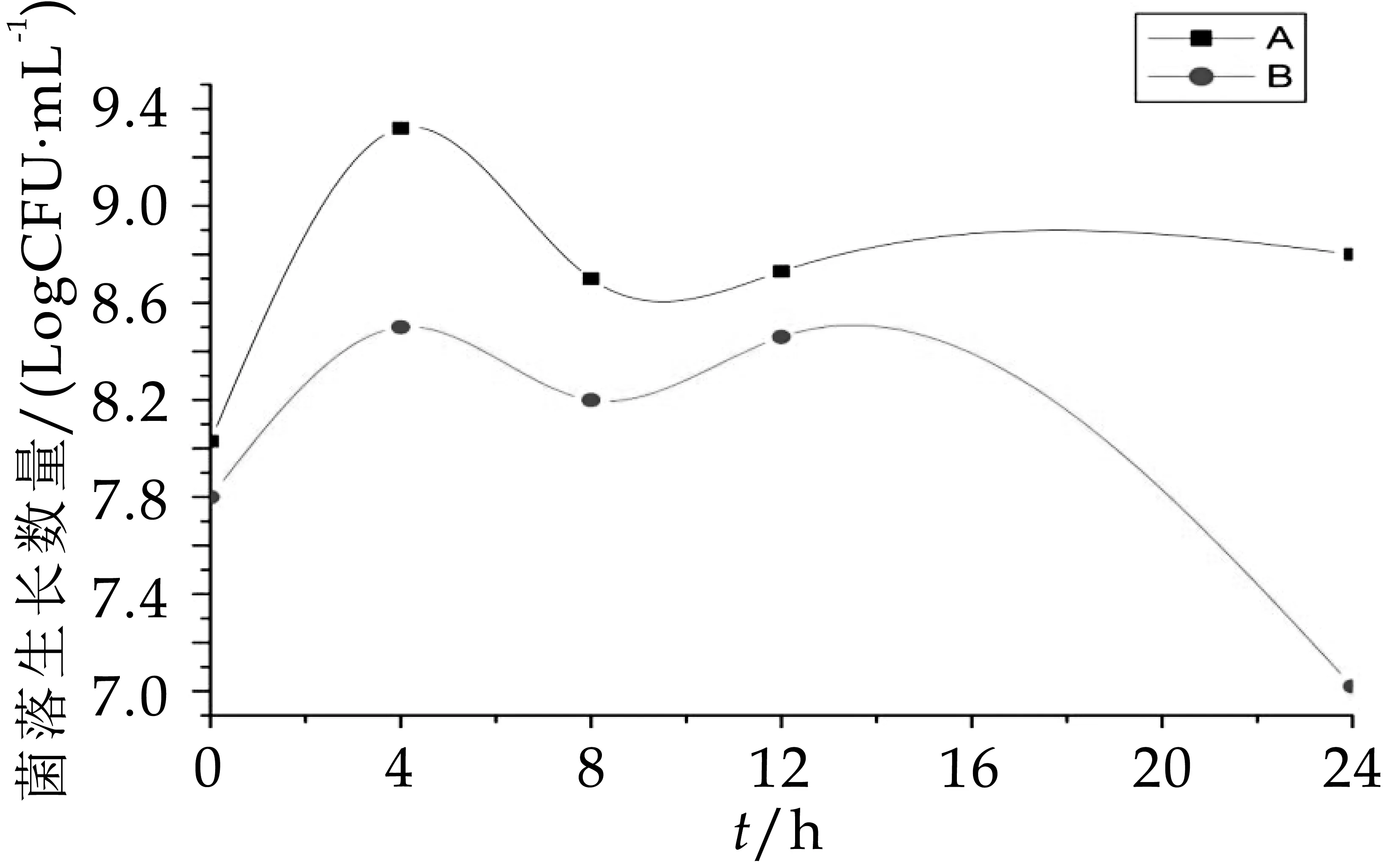
圖6 發酵中擬桿菌的生長變化
A組的菌落生長量逐漸趨于平穩,而B組的菌落數卻驟降。因此不難看出,OPO結構脂的加入能增加雙歧桿菌、乳酸桿菌、腸球菌和擬桿菌的生長數量,且效果顯著。
2.1.3 梭狀芽孢桿菌和腸桿菌的生長變化
由圖7可以看出,B組中梭狀芽孢桿菌的數量顯著高于(P<0.05)A組,發酵第4 h后A組和B組的菌落生長數分別為7.92 logcfu/m L和8.63 logcfu/m L,4 h后B組的菌落數維持在8.50 logcfu/m L,而A組中梭狀芽孢桿菌8 h之后生長數量驟降,到發酵第24 h為7.25 logcfu/m L。由圖8可知,A組B組中腸桿菌在發酵0、4、8 h這三個時間段幾乎沒有生長,其原因可能是人體內腸桿菌的數量本就十分稀少,在發酵第8 h后才有腸桿菌的生長,且B組中的生長數量顯著高于A組。因此,從圖7~圖8可以得知,OPO結構脂能有效抑制梭狀芽孢桿菌和腸桿菌的生長數量。
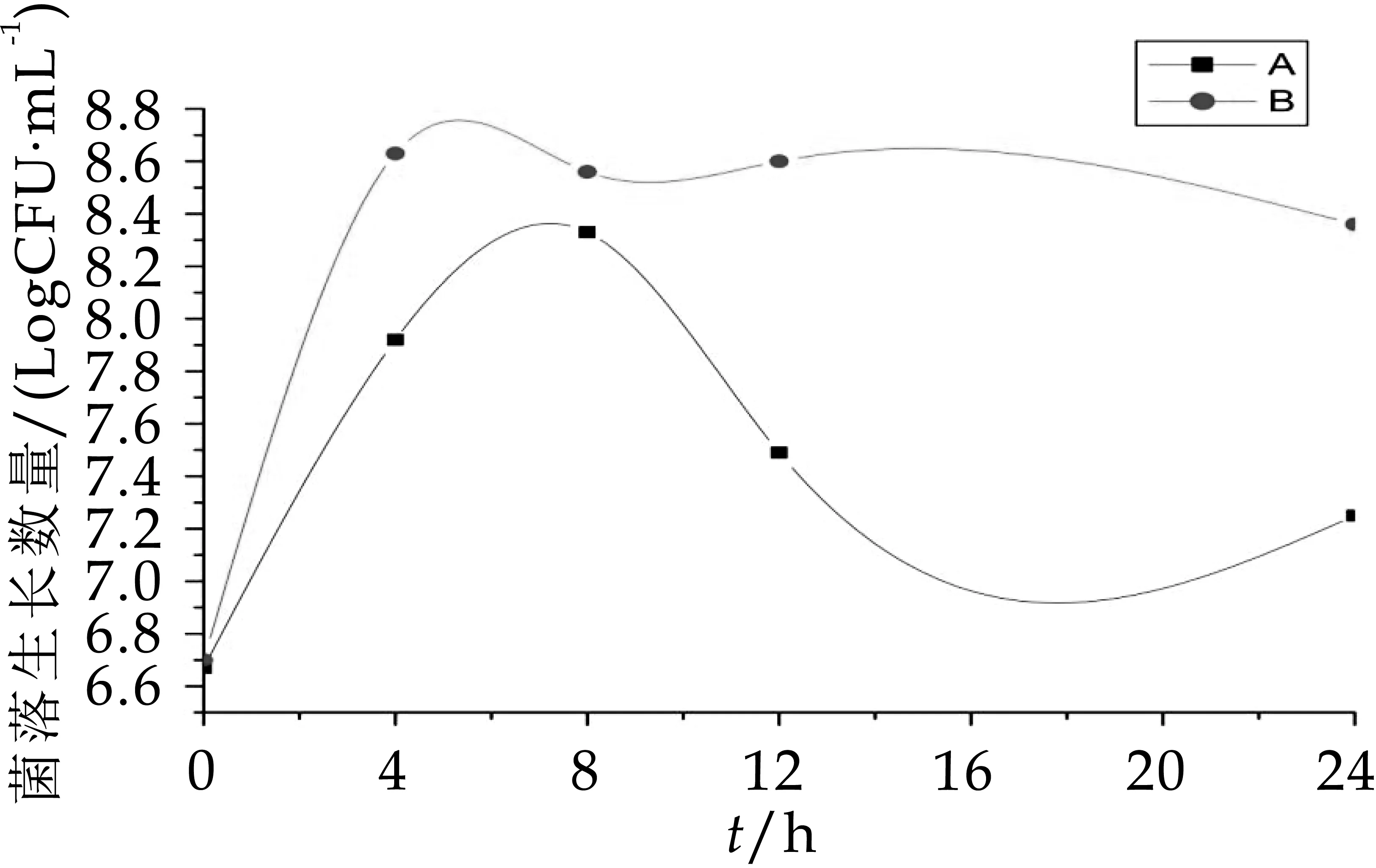
圖7 發酵中梭狀芽孢桿菌的生長變化
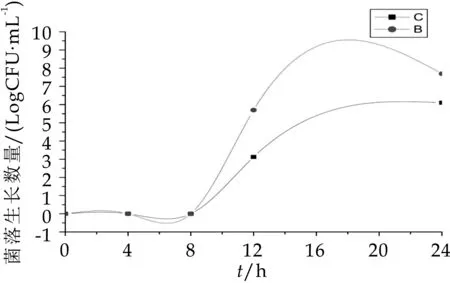
圖8 發酵中腸桿菌的生長變化
2.2 發酵中益生元指數計算結果
將腸道菌群的計數值代入PI計算公式后,得出添加了OPO結構脂的A組與未添加OPO結構脂的B組在發酵4、8、12和24 h后的PI值見表1。
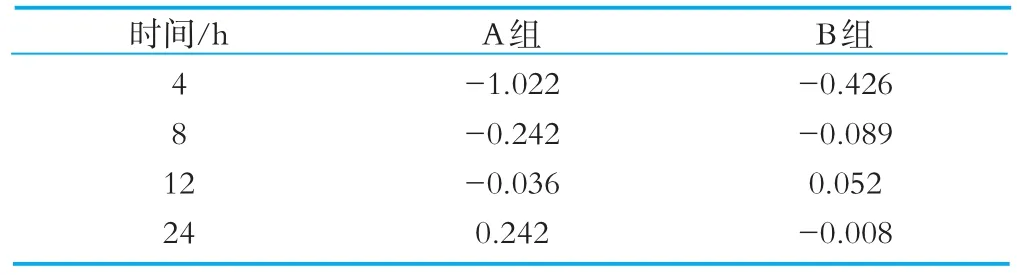
表1 發酵過程中4、8、12、24的益生元指數
由表1的PI計算結果可以看到,A組的PI值在培養到4 h時是負值-0.1022,隨著培養時間的增加,從4~24 h逐漸增大,由負值逐漸上升為正值,到培養至24 h時PI值變為正數,為0.242。B組的PI值在培養到4 h時為負值,之后PI值增大,在12 h時PI值轉變為正數,為0.052,但培養至24 h時PI值卻又變為負數。這些數值的變化說明OPO結構脂具有益生作用,并且其益生作用穩定。
2.3 發酵中B/E值的計算結果
將腸道菌群的計數值帶入計算結果如表2所示:
由圖8可以得知在0、4、8 h這三個時間段并未檢出腸桿菌,而雙歧桿菌的生長數量卻很大,因此A組和B組在這三個時間段的B/E值都遠大于1。由表2的數據可以很明顯的看出本次體外發酵實驗中加了OPO結構脂的A組在12、24 h這兩個時間段的B/E值均大于1,且數值遠大于B組。結果表明OPO結構脂能有效抑制腸桿菌等正常菌轉變為有害因子、形成有害菌的可能性,并加速雙歧桿菌等有益菌的生長繁殖,維持人體腸道平衡,保護人體健康。

表2 發酵液在0、4、8、12、24h的B/E值
2.4 體外發酵過程中pH值的變化
OPO體外發酵樣品pH值測定結果如表3所示。

表3 樣品體外發酵pH值
由表3可知,A組和B組的pH值都隨著發酵時間的增長而降低,由中性向酸性靠近。A組和B組在0h時的pH值幾乎一致,相差不大,但到24 h時A組的pH值降為4.55,而B組的pH值為7.05,可以很明顯得出,在pH值降低的過程中,A組的降低速度比B組快,能夠更快地向酸性環境靠近,并且A組pH值下降差異顯著(p<0.05),下降到8 h以后趨于平緩,維持在4.5左右,B組下降速度緩慢,差異不明顯。因此,OPO結構脂能促進腸道菌群發酵,使其產生酸性物質,從而使人體腸道內環境向酸性靠近。
3 討論
人體內的腸道菌群種類繁多,數量龐大,其生長環境中存在著各種影響其生長發育的因素,例如內在因素:人體的基因組[16]、新陳代謝[17]、性別[18]、種族[18]、免疫系統[19]等;外在因素:地域[20]、飲食習慣[21]等。腸道菌群中有些是厭氧菌,如擬桿菌、梭狀芽孢桿菌和雙歧桿菌等,有些是兼性厭氧菌如乳酸桿菌、腸球菌和腸桿菌等。
腸道菌群對維持人體內環境,加速新陳代謝具有十分重要的主導地位,不同的腸道菌群對生長壞境的要求也不盡相同。例如雙歧桿菌,作為一種人體內普遍存在的、與人體健康密切相關的腸道有益菌,它不僅可以產生一種有機酸來抑制非有益菌的生長,還能夠維持人體內腸道菌群的平衡,促進菌群新成代謝,幫助腸道蠕動。但隨著人類年齡的增長,腸道內環境的改變,雙歧桿菌的數量隨之減少,已有研究者證明,一個成年人腸道內的雙歧桿菌數量遠遠少于其嬰幼兒時期的腸道內雙歧桿菌數量,僅僅只占其體內細菌總數的3%左右[22]。乳酸桿菌也是一種人體內普遍存在的厭氧菌,M onique Haarman等[23]在其2006年的研究報告中指出,乳酸桿菌是一種幫助人體抑制疫病的有益菌,它能有效抑制腹瀉和過敏性疾病等的發生。為探尋OPO結構脂對人體內不同腸道微生物生長發育的影響程度,本研究通過預實驗獲得八種腸道微生物最適生長稀釋度后,對其進行增殖培養和數據分析。對照實驗表明,整個發酵過程中總需氧菌、總厭氧菌、雙歧桿菌、乳酸桿菌、腸球菌、擬桿菌這6個指標,在加了OPO結構脂后發酵液稀釋倍數都高于空白對照組。由此可知,OPO結構脂可以增加大學生體內腸道菌群的生長數量,具有維持腸道菌群平衡、增強人體免疫力、預防疾病的功能。
Palfram an等人[24]在2003年首次提出益生元指數的概念,考慮到要維持不同腸道菌群間的平衡和取樣接種時帶來的誤差等影響因素,他們認為可以通過計算益生元指數來衡量益生元的作用,且整個過程可以在體外進行。B/E值是指腸道內雙歧桿菌和腸桿菌數量的比值,由雙歧桿菌的數量和相對應的腸桿菌科的數值相比得到。最早是由荷蘭學者Van DerW aaij等人[25]提出。雙歧桿菌是腸道菌群有益菌的典型代表,而腸桿菌則被認為是腸道中正常菌群向不利于機體健康的方向轉變的重要因子,也可以作為潛在有害菌的代表,兩者的比值可以從正反對比評價腸道菌群結構的狀況。本研究發現,OPO結構脂對大學生腸道菌群具有穩定的益生作用。與此同時,OPO結構脂還能夠有效抑制腸桿菌等正常菌轉變為有害因子,降低有害菌形成的可能性,并且加速雙歧桿菌等有益菌的生長繁殖,維護大學生機體健康。
有研究表明,擬桿菌是人體腸道內占絕對優勢的一種厭氧菌,無論是其在人體腸道內的種類還是數量都非常龐大。曾紅根等[26]在2011年以動物為實驗對象,模擬出了擬桿菌微生態系統,通過該系統對動物進行飼養,研究結果表明,在擬桿菌微生態系統中生長發育的動物腸道內PH值比在自然環境中生長發育的動物更低,呈現出一種酸性狀態,且在這種擬桿菌微生態系統中生長的動物能產生更多免疫抗體,更具有抵抗疾病的免疫力。乳酸桿菌可以作用于人體內的二氧化碳,使之發酵形成乳酸,從而降低腸道內的pH值,形成一個酸性環境,不僅可以幫助人體消化吸收,還能夠阻止腸道內某些有害菌的生長繁殖,降低其生存力,以免對人體新陳代謝造成阻礙,進而改善人體腸道內環境,促進腸道蠕動,降低疾病的發生率[27],并減少人體腸道中潛在致癌物的形成數量[28-29]。通過計算PI值與B/E值,本研究更能確定OPO結構脂能增加
腸道內酸性物質的產生,并具有促進腸道有益菌群生長、增強腸道的消化吸收等功能,保護人體健康。
4 結論
上述結果表明,以OPO結構脂作為樣品,通過體外發酵,可以得知OPO對大學生體內腸道菌群有以下作用:有效抑制正常菌轉變為有害因子,降低有害菌形成的可能性,加速有益菌的生長速度,幫助腸道蠕動,促進機體新陳代謝。OPO結構脂還能協助益生菌產生酸性物質,如乙酸等,降低腸道pH,從而抑制腐敗菌的增殖,增強大學生對外界干擾因素的抵抗力,保護大學生機體健康。本研究著重于比較OPO體外發酵過程中微生物的變化情況,并在此基礎上分析OPO結構脂與腸道菌群的相關性和環境對其體外發酵的影響,為以后OPO結構脂的研究提供新思路。
[1]李衛林.豬油的應用前景[J].糧油食品科技,2007,15(1):52-53.
[2]符劍剛,鐘宏.豬油的開發利用[J].糧油食品科技,2003,11(4):28-29.
[3]章朝暉,龍罡,黃靜.豬油資源的深加工[J].中國油脂,2001,26(4):40-41.
[4]武慶斌,鄭躍杰,黃永坤.兒童腸道菌群——基礎與臨床[M].科學出版社,2012.06:17-18.
[5]O'HARA A M,SHANAHAN F.The gut flora as a forgotten organ[J].EMBO reports,2006,7(7):688-693.
[6]KEDIA G,VAZQUEZ JA,CHARALAMPOPOULOSD,et al.In vitro fermentation of oat bran obtained bydebranning w ith a m ixed culture of human fecal bacteria[J].Curr M icrobiol,2009,58(4):338-342.
[7]BLAUT M,CLAVEL T.M etabolic diversity of the intestinalm icrobiota:implications for health and disease[J].The Journal of nutrition,2007,137(3):751S-755S.
[8]馮曉玲.我國青少年身體素質下降的成因分析與對策研究[J].2016:11-12
[9]ALLISON C,MCFARLAN C,MACFARLANE.Studies on m ixed populations of human intestinal bacteria grown in single-stage and multistage continuous culture systems.[J].Applied and environmental m icrobiology,1989,55(3):672-678.
[10]W ILKINST D,CHALGREN S.Medium for use in antibiotic susceptibility testing of anaerobic bacteria[J].Antim icrobial agents and chemotherapy,1976,10(6):926-928.
[11]BEERENSH.An elective and selective isolationmedium for bifidobacterium spp.[J].Letters in Applied M icrobiology,1990,11(3):155-157.
[12]ROGOSAM,M ITCHELL JA,W ISEMAN R F.A selectivemedium for the isolation and enumeration of oral and fecal lactobacilli[J].Journalof Bacteriology,1951,62(1):132-133.
[13]TAYLOR EW,BURMAN N P.The application ofmembrane filtration techniques to the bacteriologicalexam ination ofwater[J].Journalof Applied M icrobiology,1964,27(2):294-303.
[14]DEVOSN,MEVISSEN-VERHAGE E,VAN AMERONGEN W H,et al.A new selectivemedium for the culture of Clostridia from human faeces[J].Eur JClin M icrobiol,1982,1(5):267-271.
[15]MACFARLANE G T,HAY S,GIBSON G R.Influence ofmucin on glycosidase,protease and arylam idase activitiesof human gut bacteria grown in a 3-stage continuousculture system[J].Journalof Applied M icrobiology,1989,66(5):407-417.
[16]ZOETENDAL EG,AKKERMANSA D,AKKERMANSW M,et al.The host genotype affects thebacterial community in the human gastrointestinal tract[J].M icrobialEcolHealthDis,2001’13:129-134.[17]BARTOSCH S,FITE A,MACFARLANEG T,et al.Characterization of bacterial communitiesin feces from healthy elderly volunteers and hospital ized elderly patients by usingreal-time PCR and effects of antibiotic treatment on the fecalm icrobiota[J].ApplEnviron M icrobiol,2004,70(6):3575-3581.
[18]MUELLER S,SAUN IER K,HAN ISCH C,et al.Differences in fecalmicrobiota in differentEuropean study populations in relation to age,gender,and country:a cross-sectionalstudy[J].Appl Environ M icrobiol,2006,72(2):1027-1033.
[19]PETERSON D A.IgA response to symbiotic bacteria as amediator ofguthomeostasis[J].CellHostM icrobe,2007,2(5):328-339.
[20]MUELLER S,SAUN IER K,HAN ISCH C,et al.Differences in fecalmicrobiota in differentEuropean study populations in relation to age,gender,and country:a cross-sectionalstudy[J].Appl Environ M icrobiol,2006,72(2):1027-1033.
[21]LEY R E,HAMADY M,LOZUPONEC,etal.Evolution ofmammals and their gut m icrobes[J].Science,2008,320(5883):1647-1651.
[22]SGHIR A,GRAMET G,SUAU A,et al.Quantification of bacterial groupsw ithin humanfecal flora by oligonucleotide probe hybr idizatIon[J].Appl Environ M icrobiol,2000,66(5):2263-2266.
[23]MONIQUE H,JAN K.Quantitative Real-Time PCR Analysis of Fecal Lactobacillus Speciesin Infants Receiving a Prebiot ic Infant Formula[J].ApplEnviron M icrobiol,2006,72(4):2359-2365.
[24]PALFRAMAN R,GIBSON G R,RASTALL R A.Development of a quantitative tool for the comparison of the prebiotic effect of dietary oligosaccharides[J].Lett ApplM icrobiol,2003,37(4):281-284.
[25]VAN DER WAAIJD,BERGHUIS-DE V J,LEKKERKERK L.Colonization resistance of the digestive tract in conventionaland antibiotic-treatedmice[J].JHyg(Lond),1971,69(3):405-411.
[26]曽紅根,付金衡,鄧紅,等.擬桿茵微生態制劑對仔豬免疫能力的影響[J].中國微生態學雜志,2011,23(11):989-990.
[27]JELENA S,SEPP E,KOLK H,et al.Diversity and metabolic impact of intestinalLactobaci1lus species in healthy adults and the elderly[J].Br JNutr,2011,105:1235-1244.
[28]M ITSUOKA T.Bifidobacteria and their role in human health[J].Journal of Industrial M icrobiology&Biotechnology,1990,6(4):263-267.
[29]FERMANDES C F,SHAHAN I K M,AMER M A.Therapeutic role of dietary lactobacilli and lactobacillic fermented dairy products[J].FEMSM icrobiology Letters,1987,46(3):343-356.

