豬瘟抗體鑭系熒光免疫層析法的建立
王澤洲 ,王琴 ,趙啟祖 ,吳俊清 ,章健 ,吳冠英
(1.四川省動物疫病預防控制中心,四川 成都 610041;2.成都微瑞生物科技有限公司,四川 郫都 611731;3.中國獸醫藥品監察所,北京 100081)
豬瘟(CSF)是威脅我國養豬業的最重要的疫病之一,被列為一類動物傳染病。長期以來,獸醫工作者先后研究建立了中和試驗、間接血凝試驗(IHA)、酶聯免疫吸附試驗(ELISA)、膠體金技術等豬瘟檢測方法,在CSF的診斷、流行病學調查和監測等方面發揮著重要作用[1-6],但都存在著某些方面的不足。為此,本研究應用鑭系元素作熒光標記物建立了一種既具有金標層析技術簡單、方便、快捷,又具有ELISA準確、特異、敏感的豬瘟抗體鑭系熒光免疫層析快檢方法(LFICA)。
1 材料和方法
1.1 材料 CSFV E2蛋白、鑭系熒光納米微球和WellrayRWR-1608熒光儀(由成都微瑞生物科技有限公司研制),兔抗雞IgY抗體、雞IgY抗體,吸水紙、樣品墊、硝酸纖維素膜,1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽(EDC)和N-羥基琥珀亞胺,其他試劑均為國產分析純。豬繁殖與呼吸綜合征病毒(PRRSV)、豬圓環病毒 2型(PCV-2)、豬偽狂犬病病毒(PRV)、豬細小病毒(PPV)、豬乙型腦炎病毒(JEV)、豬流行性腹瀉病毒(PEDV)、豬傳染性胃腸炎病毒(TGEV)和牛病毒性腹瀉病毒(BVDV)陽性血清由筆者單位保存。IDEXX試劑盒檢測的陽性和陰性血清分別由中牧股份成都藥械廠、華派生物藥業有限責任公司惠贈;臨床血清樣品由四川省動物疫病預防控制中心提供。
1.2 制備 包被膜、抗原標記微球、夾心法建立等均參照試劑盒說明書或按照相關規范操作。
1.3 熒光免疫層析試紙條的組裝 在濕度小于30%,溫度20~25℃的環境下,把吸水紙、標記物墊和樣品墊按順序粘貼在聚氯乙烯底板上形成微反應體系,然后將其切割成0.5 cm寬,即成試紙條,將試紙條裝入卡殼中制成檢測卡,裝入鋁箔袋封存備用。
1.4 特異性試驗 以建立的判斷標準(標準曲線)與PRRSV、PCV-2、PRV、PPV、JEV、PEDV、TGEV、BVDV陽性血清進行豬瘟抗體鑭系熒光免疫層析檢測,同時設豬瘟陽性、陰性對照,以確定該試驗方法是否發生交叉反應。
1.5 敏感性試驗 將CSFV標準陽性血清作1∶40、1∶80、1∶160、1∶320、1∶640、1∶1 280、1∶2 560、1∶5 120、1∶10 240倍稀釋,每個稀釋度平行做4個重復,用建立的豬瘟LFICA檢測,將其換算成S/P值,判斷其抗體檢出效價。
1.6 重復性試驗
1.6.1 批內重復性試驗 在相同實驗條件下,選取12份CSFV抗體水平不同的血清,每份血清樣本平行做8個重復,用組裝的CSFV-LFICA試劑盒檢測,然后對檢測結果進行統計學分析。
1.6.2 批間重復性試驗 在相同實驗條件下,選取12份CSFV抗體水平不同的血清,分別用4批CS FV-LFICA試劑盒檢測,然后對檢測結果進行統計學分析。
1.7 比較性試驗
1.7.1 與IHA比較 血清樣本同時進行IHA檢測和CSFV-LFICA試劑盒檢測,以IHA檢測結果為標準,計算CSFV-LFICA相對于IHA的符合率、敏感性和特異性。
1.7.2 與國內外ELISA試劑盒比較 血清樣本同時用IDEXX-ELISA試劑盒、法國LSI公司試劑盒、韓國JBT公司試劑盒、中監所ELISA試劑盒檢測,分別以這些試劑盒的檢測結果為標準,計算CSFV-LFICA相對于各個ELISA試劑盒的符合率、敏感性和特異性。
1.8 試劑盒的組裝及保存期試驗 CSFV-LFICA試劑盒由熒光檢測儀、檢測卡、連接線組成。試劑盒置4℃保存,于保存后 60、120、180、240、300、360、390d按照CSFV-LFICA的各個優化條件,對CSFV陽性和陰性參考血清進行檢測,并對結果進行統計學分析。
1.9 應用 用研制的CSFV-LFICA試劑盒檢測來自四川各地市的送檢樣本2366份,了解CSFV血清抗體陽性情況。
2 結果
2.1 測定條件的選擇
2.1.1 標記量選擇 把抗體/微球質量比不同的標記好的熒光微球稀釋相同倍數,組裝成檢測卡,在檢測卡加樣孔分別加入80μL的參考標準液后,室溫下層析15min,考察并驗證不同標記量對標記結果的影響。隨標記抗原濃度的增加,各濃度點的結合率呈現先增后降的趨勢,在抗原/微球質量比為1∶25時出現最大值。因此,選擇標記比例為1∶25的免疫微球進行后續試驗。
2.1.2 加樣量選擇 在其他條件一致的情況下,考察并驗證樣本不同稀釋倍數對檢測結果的影響。在檢測卡加樣孔里分別加入稀釋 10、20、30、40、50、60、70倍的參考標準液,室溫下反應15 min,結果表明隨稀釋倍數的增加,各濃度點的結合率均減小。當樣本稀釋倍數為40倍時,繼續降低稀釋倍數,結合率增加不明顯,免疫反應基本飽和。因此,后續試驗選擇樣本稀釋倍數40倍為加樣量。
2.1.3 檢測時間選擇 在檢測卡加樣孔中加入80μL的參考標準液,室溫下免疫層析,分別在5、10、15、20、25、30min時檢測,考察不同檢測時間對結果的影響。結果表明隨著檢測時間延長,各濃度點的結合率基本呈現增加的趨勢,試紙靜置15min檢測即能達到較高的結合率,而隨著檢測時間的增加,各濃度點的結合率不再發生大的變化,趨于平穩,說明在15min時,試紙條上的雙抗原夾心吸附基本達到飽和。因此,本著快速簡便的原則,選擇檢測時間為加樣后15min。
2.2 檢測結果的判讀 加樣后,由于層析作用液體向前移動,先后與包被在T線和C線上的抗原形成復合物,這時,試紙條經熒光檢測設備掃描顯示2條熒光帶。C線熒光掃描值基本一致,T線值隨加樣中抗體濃度的增加而升高。相應的檢測結果以濃度為橫坐標,熒光值信號為縱坐標,經對數函數數據處理程序擬合得到標準曲線。當樣本為陰性時,CSFV抗體濃度很低,T線熒光值很低或完全檢測不到;當樣本為陽性時,CSFV抗體濃度越高,T線熒光值也越高。無論是陽性還是陰性結果,C線總能顯示熒光,如果C線沒有熒光顯現,無論T線有無,檢測結果均無效。
2.3 CSFV-LFICA的方法學評估
2.3.1 特異性試驗 用CSFV E2蛋白和全病毒建立的CSFV-LFICA試劑盒檢測7種常見豬病及BVDV陽性血清,其熒光比值均低于0.40,呈陰性反應。表明該方法與7種常見豬病及BVDV陽性血清不發生交叉反應,顯示出很好的特異性。
2.3.2 敏感性試驗 檢測CSFV標準陽性對照血清,當血清稀釋至10240倍時,熒光檢測仍為陽性。用同一份陽性血清同時做ELISA和CSFV-LFICA比較,后者比前者高1~2個滴度,證明該方法敏感性很好。
2.3.3 重復性試驗 批內重復性試驗的變異系數小于10%,批間重復性試驗的變異系數均小于15%,表明CSFV-LFICA具有良好的重復性。
2.3.4 與IHA作比較 在IHA檢測結果為陽性的128份血清樣本中,用CSFV-LFICA檢測出111份陽性,17份陰性;在IHA檢測結果為陰性的46份血清樣本中,用CSFV-LFICA檢測出38份陰性,8份陽性。CSFV-LFICA與IHA的符合率為85.6%,敏感性為86.7%,特異性為82.6%。
2.3.5 與國內外ELISA試劑盒作比較 同一份血清用CSFV-LFICA與其他四種試劑盒同時檢測,結果見表1。
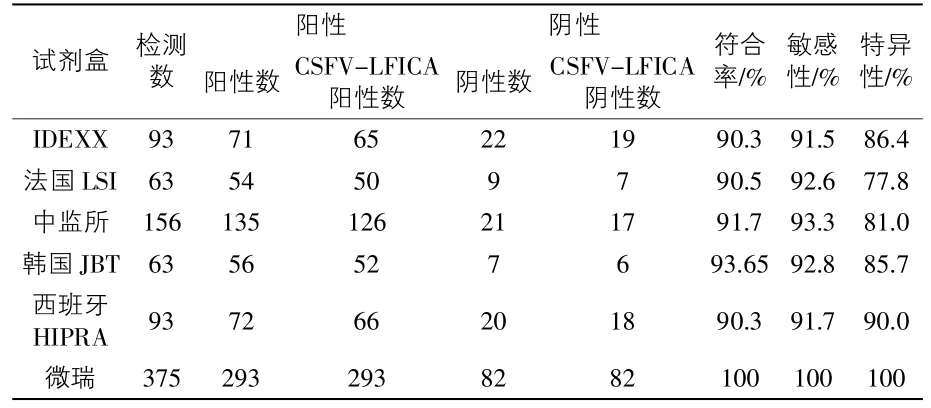
表1 CSFV-LFICA與其他試劑盒的檢測比較
2.3.6 試劑盒保存期試驗 統計學分析表明,CSFVLFICA試劑盒在保存390d后檢測陽性血清、陰性血清、P/N值,其變異系數均小于10%,說明該診斷試劑在保存12個月以上后仍然穩定有效,進一步的穩定性試驗還在進行中。
2.4 現場應用試驗 應用CSFV-LFICA試劑盒檢測來自四川各地市的2366份送檢樣本,結果檢出血清抗體陽性2053份,陽性率為86.77%。
3 討論
3.1 鑭系熒光免疫層析法(LFICA)是在時間分辨熒光免疫分析(TRFIA)基礎上建立起來的一種超微量快速免疫檢測技術,它集合了酶標記技術、放射標記技術和同位素標記技術的優點,具有靈敏度高、特異性強、穩定性好、無污染,且測定范圍寬,試劑盒壽命長,操作簡單和無放射性等優點,越來越受到各領域科研工作者的關注。在醫學界已有文獻報道,在獸醫學領域才起步,需要研究的內容和范圍還很多[7]。
3.2 CSFV全病毒或E2蛋白的純度與含量是診斷試劑研制的基礎,直接關系到所建立方法的特異性和敏感性。客觀上說,市售產品純度和質量參差不齊,批次之間或有差異,因此,在使用前進行檢定是非常必要的。
3.3 本研究采用鑭系元素銪(Eu)作為熒光物質,與傳統熒光物質相比,銪具有獨特的熒光光譜特性:Stokes位移大、激發光譜寬、發射光譜窄、熒光壽命很長[8]。由此建立的熒光方法特異性更強、敏感性更高,檢測結果更加準確可靠。熒光納米微球的大小和均勻度也是影響快檢試紙條的重要因素,本試驗用的微球粒徑為70~200nm。微球表面經過羧基(或氨基)活化處理,易與蛋白或抗體共價偶聯,牢固結合,使標記物的穩定性提高,微球表面積比增大,大大提高了蛋白質的包被量。每個微球可包裹成千上萬個熒光分子,使標記效率和靈敏度大大提高。
3.4 從CSFV-LFICA方法學評估可以知道,該方法的特異性、敏感性和重復性都較好。與國內中監所和國外IDEXX公司、西班牙的ELISA試劑盒檢測結果相比,符合率和敏感性都在90%以上,表明該方法完全可以用于CSF免疫抗體檢測。
4 小結
ELISA是目前應用最廣、發展最快的免疫檢測技術,是檢測豬瘟抗體的主要方法,具有敏感性和特異性強、操作簡單、檢測相對快速、檢查微量、無輻射、高通量等優點,但需要比較完備的實驗設備,操作人員也得有一定的專業技術水平和經驗,且檢測流程至少需要2~4h,故對基層獸醫站和一般的養殖場不適用。豬瘟正向間接血凝試驗(IHA)是農業部推薦的豬瘟抗體檢測方法,該法操作簡單,不需要特殊的儀器設備,但敏感性低,待檢血清需經滅活處理,增加了檢測時間和難度,且血清質量嚴重影響檢測結果,而肉眼判定結果又增加了主觀性和不準確性。膠體金免疫層析法(GICA)是近年來發展起來的一種快速檢測方法,操作簡單,使用方便,不需要特殊儀器,肉眼直接觀察和判定結果,全程只需要幾分鐘,但敏感性、重復性不高,產品質量參差不齊,漏檢率和誤診率較高。
本研究建立的CSFV-LFICA,既具有膠體金免疫層析法(GICA)簡單、方便、快捷等優點,又具有ELISA法敏感、特異、微量等優點,檢測時間從2~4h縮短到十多分鐘,且檢測設備小巧便于攜帶。筆者認為,該方法適于在基層獸醫部門、養殖場推廣應用。
[1] 李樹春,何建新,李德珍,等.豬瘟間接血凝試驗的研究[J].中國獸醫科技,1993,23(7):3-6.
[2] 張改平,郭軍慶,李青梅,等.動物疫病免疫試紙快速檢測技術概述[J].河南農業科學,2009(9):174-176.
[3] 余興龍,涂長春,李作生,等.以重組mE2蛋白為抗原建立檢測豬瘟病毒抗體間接ELISA方法的研究[J].中國預防獸醫學報,1999,21(3):220-222.
[4] 徐璐,范學政,梁智選,等.豬瘟病毒間接ELISA抗體檢測試劑盒的臨床應用研究[J].中國獸醫雜志,2014,50(8):36-41.
[5] 李嬌,王金良,祖立闖,等.豬瘟病毒重組E2蛋白PPA-ELISA抗體檢測試劑盒的研制及應用[J].中國獸醫學報,2009,31(10):1390-1394.
[6] 楊明,陳伯祥,孫曉林,等.豬瘟膠體金診斷試紙條的研制[J].甘肅農業大學學報,2010,45(2):34-37.
[7] 王澤洲,吳俊清,張永寧,等.時間分辨熒光免疫分析技術的研究進展[J].四川畜牧獸醫,2015,42(7):34-37.
[8] 郭明明,周衍,周建波,等.熒光微球時間分辨免疫層析技術定量檢測甲胎蛋白的研究[J].免疫學雜志,2015,31(10):897-901.

