D-阿洛酮糖對(duì)Wistar大鼠脂質(zhì)代謝作用的研究
黃維來(lái), 江 波, 張 濤
(食品科學(xué)與技術(shù)國(guó)家重點(diǎn)實(shí)驗(yàn)室,江南大學(xué),江蘇 無(wú)錫 214122)
肥胖是一個(gè)世界性的問(wèn)題,它會(huì)增加冠心病、糖尿病和癌癥的風(fēng)險(xiǎn)[1-4]。飲食和肥胖之間的聯(lián)系非常緊密,有報(bào)道稱約50%的高果糖漿以及果糖會(huì)轉(zhuǎn)換成脂肪[5-6],同時(shí)也有報(bào)告顯示果糖還會(huì)引起高血脂,胰島素抵抗力下降和Ⅱ型糖尿病[7]。D-阿洛酮糖(D-ribo-2-hexulose),是 D-果糖在 C-3位置差相異構(gòu)形成的一種稀有糖(圖1),它天然存在于蔬菜和水果中,但其含量很低,甜度是蔗糖甜度的70%[8]。D-阿洛酮糖食用后不易被人體代謝,幾乎不產(chǎn)生能量,而且具有良好的食品加工特性,它作為一種新型的功能性甜味劑配料,在食品開(kāi)發(fā)中可以替代傳統(tǒng)甜味劑,成為功能性食品添加劑研究領(lǐng)域的一項(xiàng)熱門(mén)內(nèi)容[9-10]。同時(shí)D-阿洛酮糖商業(yè)化生產(chǎn)的實(shí)現(xiàn),使得對(duì)于D-阿洛酮糖進(jìn)行的體內(nèi)研究變得可行[11],目前作者所在實(shí)驗(yàn)室已經(jīng)能夠利用食品級(jí)微生物枯草桿菌實(shí)現(xiàn)D-阿洛酮糖3-差向異構(gòu)酶的表達(dá),為酶法生產(chǎn)D-阿洛酮糖奠定了基礎(chǔ)[12]。作者用D-阿洛酮糖取代傳統(tǒng)膳食的糖類,研究D-阿洛酮糖對(duì)大鼠肥胖以及脂質(zhì)代謝的影響。

圖1 D-果糖和D-阿洛酮糖的分子式Fig.1 Molecular structures of D-Fructose and D-Psicose
1 材料與方法
1.1 材料與儀器
D-阿洛酮糖:實(shí)驗(yàn)室自制備;動(dòng)物總RNA快速提取試劑盒,基因引物設(shè)計(jì)和合成:上海捷瑞生物工程有限公司產(chǎn)品;RT-PCR試劑盒,SYBR熒光染料:TaKaRa生物有限公司產(chǎn)品;其他試劑均為分析純?cè)噭?/p>
Nikon Ti倒置顯微鏡:日本Nikon公司產(chǎn)品;BIO-RAD680酶標(biāo)儀:美國(guó)Bio-Rad公司產(chǎn)品;微量分光光度計(jì)Spectrophotometer:北京凱奧科技發(fā)展有限公司產(chǎn)品;CFX96熒光定量PCR儀:美國(guó)BIORAD公司產(chǎn)品;Centrifuge 5427R冷凍離心機(jī):德國(guó)Eppendorf公司產(chǎn)品;V-1200型可見(jiàn)分光光度計(jì):上海翱藝儀器有限公司產(chǎn)品;Forma 900系列超低溫冰箱:美國(guó)Thermo公司產(chǎn)品;Modell RM2235組織切片機(jī):德國(guó)Leica公司產(chǎn)品。
1.2 實(shí)驗(yàn)方法
1.2.1 實(shí)驗(yàn)動(dòng)物 清潔級(jí)Wistar大鼠 (3周齡,雄性),購(gòu)于上海斯萊克實(shí)驗(yàn)動(dòng)物有限責(zé)任公司,許可證號(hào):SCXK(滬)2007-0005,飼養(yǎng)于清潔級(jí)實(shí)驗(yàn)動(dòng)物中心(江南大學(xué)),溫度(23±2 ℃),濕度 60%,自由飲水和采食。實(shí)驗(yàn)動(dòng)物的護(hù)理和干預(yù)處理都依照《實(shí)驗(yàn)動(dòng)物管理?xiàng)l例》相關(guān)規(guī)定進(jìn)行。
1.2.2 實(shí)驗(yàn)設(shè)計(jì)和樣品準(zhǔn)備 25只雄性Wistar大鼠用基礎(chǔ)飼料喂養(yǎng)一周后,隨機(jī)分為5組(n=5),分別為基礎(chǔ)對(duì)照組(AIN-76A)、葡萄糖組(AIN-Glu)、果糖組(AIN+Fru)、阿洛酮糖組(AIN+Psi)以及纖維素組(AIN+Cel)。適應(yīng)一周后開(kāi)始按飼料配方喂養(yǎng)。基礎(chǔ)對(duì)照組飼料配方參照美國(guó)營(yíng)養(yǎng)學(xué)會(huì)推薦的AIN-76A實(shí)驗(yàn)動(dòng)物飼料配方配制而成[13],其他組在此基礎(chǔ)上將其中的淀粉換成等量的葡萄糖、果糖、D-阿洛酮糖以及纖維素。
1.2.3 大鼠血液的采集與組織保存 飼喂?jié)M4周后,大鼠禁食12 h后,稱重后,刺破心臟處死。從心臟中取血液進(jìn)行相應(yīng)生理生化指標(biāo)檢測(cè)。大鼠處死后,迅速打開(kāi)腹腔,取出肝臟等主要器官,用生理鹽水清洗后稱重。另外取一部分肝小葉,用體積分?jǐn)?shù)4%的中性甲醛溶液固定,再剪下一部分肝小葉置于RNA保存液中保存,剩余的用液氮速凍后快速轉(zhuǎn)移到-80℃冰箱中保存以備下次使用。
1.2.4 血清和組織生化指標(biāo)的測(cè)定 得到的全血通過(guò)室溫靜置 3 h,3 000 r/min,4℃離心10 min分離制備血清,血清中的總膽固醇 (TC)、三酰甘油(TG)、低密度脂蛋白(LDL-C),游離脂肪酸采用血液生化指標(biāo)的試劑盒進(jìn)行酶法測(cè)定,批號(hào)為20090228。
1.2.5 肝組織病理學(xué)切片 將適量的新鮮肝組織放入體積分?jǐn)?shù)4%中性甲醛溶液固定,經(jīng)脫水→浸蠟→包埋→切片→脫蠟→蘇木素染色→沖洗→伊紅復(fù)染→梯度脫水→封片等步驟,制作組織切片。于光學(xué)顯微鏡下觀察肝細(xì)胞結(jié)構(gòu)及病理改變。
1.2.6 分析基因表達(dá)的實(shí)時(shí)定量PCR 提取大鼠肝臟中的總RNA,逆轉(zhuǎn)錄合成cDNA。以GADPH作為內(nèi)參基因,檢測(cè)各個(gè)模板的Ct值,進(jìn)行相對(duì)定量。大鼠肝組織中總RNA提取使用RNA提取試劑盒,以A260nm/A280nm光吸收比值鑒定RNA純度。總RNA(1 μg)通過(guò)逆轉(zhuǎn)錄試劑盒逆轉(zhuǎn)錄合成cDNA。實(shí)時(shí)PCR使用CFX96熒光定量PCR儀,PCR反應(yīng)混合物制備使用的是由12.5 μL的熒光染料SYBR,1 μL 的前引物,1 μL 的后引物,2 μL 的 DNA 模板和8.5 μL的滅菌蒸餾水組成的25 μL的體系。目標(biāo)基因的表達(dá)水平均是相對(duì)于對(duì)照組基因的改變倍數(shù),表1為所用到的引物序列。
1.3 數(shù)據(jù)統(tǒng)計(jì)處理方法
采用SPSS19.0軟件進(jìn)行統(tǒng)計(jì)分析,各組數(shù)據(jù)以均數(shù)±標(biāo)準(zhǔn)差(mean±SD)的形式表示。采用ANOVE方法對(duì)試驗(yàn)數(shù)據(jù)進(jìn)行多重比較和差異顯著性檢驗(yàn),組間比較采用Turkey檢驗(yàn),以p<0.05認(rèn)為存在顯著差異性。

表1 實(shí)時(shí)定量RT-PCR使用的引物序列Table 1 Sequences of primers used in quantitative realtime reverse transcription PCR
2 結(jié)果與討論
2.1 D-阿洛酮糖對(duì)Wistar大鼠生長(zhǎng)指標(biāo)的影響
分組時(shí)各組實(shí)驗(yàn)大鼠體質(zhì)量無(wú)統(tǒng)計(jì)學(xué)差異,實(shí)驗(yàn)期間各組大鼠體質(zhì)量平穩(wěn)增長(zhǎng),生長(zhǎng)發(fā)育良好,同時(shí)AIN+Psi組的體質(zhì)量變化最為緩慢,見(jiàn)圖2。8周齡時(shí),AIN+Psi組體質(zhì)量明顯低于其它3組 (P<0.05),且AIN+Psi組的體質(zhì)量增長(zhǎng)量明顯小于其他組(P<0.05)。AIN+Cel組的大鼠體質(zhì)量增加量?jī)H次于AIN-76A組,可能存在的原因是纖維素增強(qiáng)了大鼠腸道對(duì)于食物的消化吸收,使得大鼠每日的飼料攝入量增加,能量攝入也隨之增加,從而導(dǎo)致大鼠體質(zhì)量上升。機(jī)體內(nèi)的白色脂肪可以將機(jī)體內(nèi)過(guò)剩的能量以脂肪的形式儲(chǔ)存起來(lái),這部分脂肪主要包括睪周脂,腹周脂以及腸周脂[15]。AIN+Psi組大鼠的睪周脂及腹周脂顯著下降(p<0.05),而其他組都沒(méi)有顯著性變化。說(shuō)明D-阿洛酮糖具有降低機(jī)體脂肪和減重的作用。

圖2 實(shí)驗(yàn)期間各組大鼠體質(zhì)量變化Fig.2 Body weight during the experiment
2.2 D-阿洛酮糖對(duì)大鼠血脂水平的影響
在實(shí)驗(yàn)剛開(kāi)始的時(shí)候,各組大鼠的TC、TG指標(biāo)無(wú)顯著差異,喂養(yǎng)4周后,可以看出AIN+Psi組大鼠的TG顯著低于其他組 (p<0.05)。其中AIN+Glu,AIN+Fru以及AIN+Cel組的TG指標(biāo)無(wú)顯著差異性,但都低于AIN+76A組。TC整體沒(méi)有顯示出明顯的差異。
游離脂肪酸(FFA)是中性脂肪分解成的物質(zhì),當(dāng)肌肉活動(dòng)所需能源肝糖耗盡時(shí),脂肪組織分解中性脂肪酸成為FFA來(lái)充當(dāng)能源使用,血清中的FFA的濃度與脂肪代謝、糖代謝、內(nèi)分泌有關(guān)。研究發(fā)現(xiàn),F(xiàn)FA與其他血脂指標(biāo)相比較,能更早、更靈敏的反映機(jī)體血脂代謝紊亂的情況,另外它也受很多因素影響,肥胖、攝食過(guò)多,β受體異常及交感神經(jīng)興奮等都可使FFA濃度升高[16-17]。由表2可知AIN+Glu、AIN+Fru以及AIN+Psi的 FFA濃度顯著低于其他兩組(P<0.05),其中AIN+Psi組是其中最小的。
低密度脂蛋白(LDL-C)是一種運(yùn)載膽固醇進(jìn)入外周組織細(xì)胞的脂蛋白顆粒,可被氧化成氧化低密度脂蛋白,當(dāng)?shù)兔芏戎鞍祝绕涫茄趸兔芏戎鞍祝∣X-LDL)過(guò)量時(shí),它攜帶的膽固醇便積存在動(dòng)脈壁上,累計(jì)到一定的量容易引起動(dòng)脈硬化。低密度脂蛋白被認(rèn)為是致動(dòng)脈粥樣硬化的主要因素以及進(jìn)行調(diào)脂治療的第一指標(biāo)[18]。由表2所示,與AIN-76A相比,其他4組LDL-C水平均顯著下降(p<0.05), 其中 AIN+Psi組和 AIN+Cel組沒(méi)有顯著性差異,但是呈現(xiàn)一個(gè)最小的LDL-C值,可以看出,D-阿洛酮糖和纖維素具有一定的抗動(dòng)脈粥樣硬化的作用。
2.3 D-阿洛酮糖對(duì)大鼠肝臟組織形態(tài)的影響
解剖后發(fā)現(xiàn)AIN+Glu組和AIN+Fru組大鼠肝臟腫大,且伴有不同程度的色澤變淺,顏色由正常的暗紅褐色轉(zhuǎn)變?yōu)樯铧S褐色,質(zhì)地較為粗糙,有顆粒感,同時(shí)其他組大鼠肝臟色澤深紅,有一定光澤,細(xì)膩無(wú)顆粒感。Wistar大鼠肝臟組織病理學(xué)變化如圖 3所示。由圖可見(jiàn)AIN+Psi和AIN+Cel組大鼠的肝小葉結(jié)構(gòu)清晰,肝板排列整齊,肝細(xì)胞未見(jiàn)明顯異常變化。而AIN+Glu和AIN+Fru組大鼠肝臟細(xì)胞腫大,細(xì)胞間界線含糊,內(nèi)部含有數(shù)量不等的脂肪空泡,有炎性細(xì)胞浸潤(rùn)。同時(shí)AIN-76A組較以上兩組有所改善,但脂肪積累仍高于AIN+Psi和AIN+Cel組,說(shuō)明D-阿洛酮糖可以減少大鼠肝臟脂肪積累。
2.4 肥胖相關(guān)性的基因表達(dá)的變化
如圖4所示,AIN+Psi組大鼠PPAR-α基因的表達(dá)顯著上升 (P<0.05),F(xiàn)AS基因的表達(dá)顯著下降(P<0.05), 與 AIN-76A 組相比,AIN+Glu,AIN+Fru以及AIN+Cel組PPAR-α基因的表達(dá)無(wú)顯著變化,但FAS基因的表達(dá)均顯著上升(P<0.05)。
過(guò)氧化物酶體增殖物激活受體(peroxisome proliferator activated receptors,PPARs),主要功能是參與肝臟脂肪代謝和脂肪細(xì)胞的分化,其中PPAR-α是PPARs的一種亞型,其高表達(dá)于肝臟中[19]。PPAR-α的作用機(jī)理是它通過(guò)與配體結(jié)合從而被激活,激活后的PPAR-α與9-順式視黃醛受體α(RXRα)形成異二聚體,從而與靶基因啟動(dòng)子上的過(guò)氧化物增殖物反應(yīng)原件(PPRE)結(jié)合,最后使該基因活化,調(diào)節(jié)轉(zhuǎn)錄表達(dá)[20]。其中含有PPRE結(jié)構(gòu)的基因是一些參與脂質(zhì)代謝的酶,包括脂酰基輔酶A氧化酶,過(guò)氧化物體雙功能酶,肝臟脂肪酸結(jié)合蛋白,微粒體cYP4A,細(xì)胞色素P450,脂肪酸-羥化酶,超氧歧化酶,磷脂轉(zhuǎn)移蛋白,解偶聯(lián)蛋白家族成員等[21]。PPAR-α通過(guò)上述途徑參與到脂質(zhì)代謝的過(guò)程中。與其他組相比,AIN+Psi組的大鼠的PPAR-α表達(dá)顯著上升(p<0.05),可以推測(cè)D-阿洛酮糖可以減少脂肪肝的風(fēng)險(xiǎn),同時(shí)可以起到降血脂的作用。
脂肪酸合成酶(FAS)是脂肪酸合成的限速酶,在體內(nèi)催化單酰輔酶A和丙二酰輔酶A結(jié)合成長(zhǎng)鏈脂肪酸,F(xiàn)AS的活性將直接影響體內(nèi)脂肪酸的合成,從而對(duì)機(jī)體的脂質(zhì)代謝起到重要作用[22]。當(dāng)FAS酶活力升高時(shí),可是使得動(dòng)物體內(nèi)多余的脂肪酸通過(guò)酯化作用形成脂肪,增加脂肪在動(dòng)物體內(nèi)的沉積。有報(bào)告稱在高脂飲食誘導(dǎo)的肥胖大鼠模型中,血清中TG水平升高的同時(shí),F(xiàn)AS的表達(dá)水平也隨之升高[23]。同時(shí)隨著動(dòng)物組織中FAS的表達(dá)增加,TG在體內(nèi)沉積的速度加快,從而導(dǎo)致肥胖[24]。從圖4可知,添加了D-阿洛酮糖的大鼠組的FAS值最小(p<0.05),可以推測(cè)D-阿洛酮糖通過(guò)減少FAS基因的表達(dá),從而控制脂肪酸合成脂肪,起到一個(gè)控制體重的作用。

表2 不同糖對(duì)大鼠TG、TC、FFA以及LDL-C的影響Table 2 Effects of dietary carbohydrates on TG、TC、FFA and LDL-C
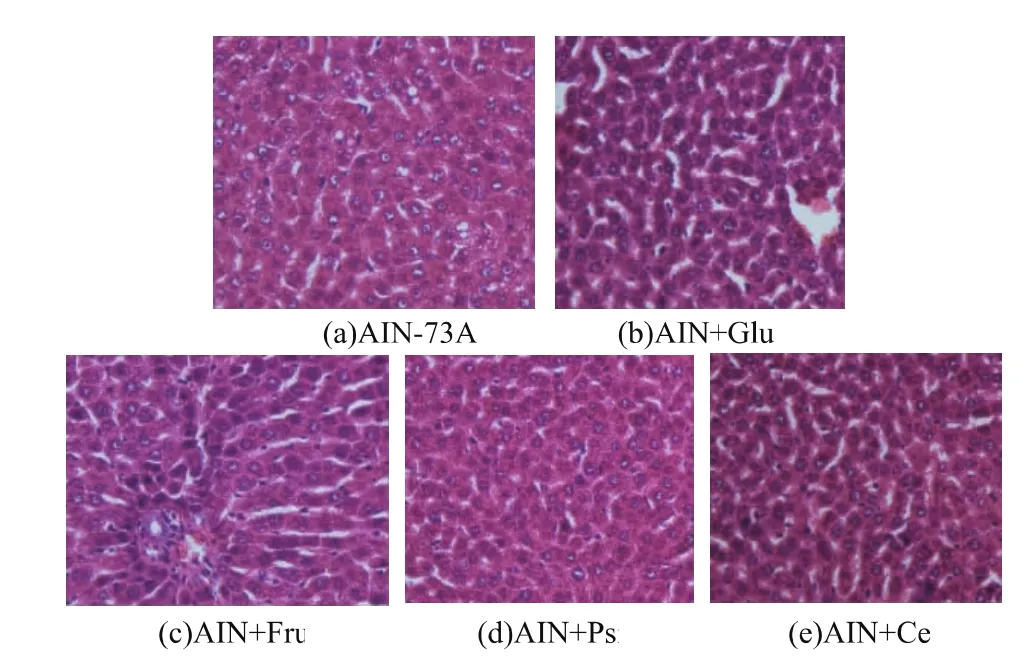
圖3 D-阿洛酮糖對(duì)大鼠肝組織的影響(HE染色,400倍放大)Fig.3 Effect of D-psicose on rat(By HE stain×400)


圖4 大鼠肝臟PPAR-α,F(xiàn)AS基因mRNA的表達(dá)Fig.4 mRNA expression of PPAR-α,F(xiàn)AS in the liver of Wistar Rat
3 結(jié)語(yǔ)
通過(guò)研究改變?cè)猩攀持械奶妓衔锏姆N類,發(fā)現(xiàn)D-阿洛酮糖具有降低血脂,控制體質(zhì)量的作用。給予大鼠D-阿洛酮糖飲食后,與其他組大鼠相比,D-阿洛酮糖組體質(zhì)量下降,血清中的TG、FFA、LDL-C 含量下降(p<0.05),但是 TC 變化不明顯。實(shí)時(shí)定量PCR分析顯示與其他組相比,D-阿洛酮糖通過(guò)上調(diào)肝臟中的PPAR-α基因的mRNA表達(dá)水平(p<0.05),同時(shí)下調(diào)FAS基因的mRNA表達(dá)水平(p<0.05),抑制肝臟中膽固醇的表達(dá)以及脂肪的合成從而起到降低血脂控制體質(zhì)量的作用。
[1]VILLAREAL D T,APOVIAN C M,KUSHNER R F,et al.Obesity in older adults:technical review and position statement of the American Society for Nutrition and NAASO,The Obesity Society[J].Am J Clin Nutr,2005,82(5):923-934.
[2]HASLAM D W,JAMES W P.Obesity[J].Lancet,2005,366(9492):1197-1209.
[3]MALIKV S,SCHULZE M B,HU F B.Intake of sugar-sweetened beverages and weight gain:a systematic review[J].Am J Clin Nutr,2006,84(2):274-288.
[4]SCHULZE M B,MANSON J E,LUDWIG D S,et al.Sugar-sweetened beverages,weight gain,and incidence of type 2 diabetes in young and middleaged women[J].JAMA J Am Med Assoc,2004,292(8):927-934.
[5]AEBERLI I,MURER S B,HOCHULI M,et al.Moderate amounts of fructose consumption impair insulin sensitivity in healthy young men[J].Diabetes Care,2013,36(1):150-156.
[6]RUTLEDGE A C,ADELI K.Fructose and the metabolic syndrome:pathophysiology and molecular mechanisms[J].Nutr Rev,2007,65(6):S13-S23.
[7]ELLIOTT S S,KEIM N L,STERN J S,et al.Fructose,weight gain,and the insulin resistance syndrome[J].Am J Clin Nutr,2002,76(5):911-922.
[8]CHUNG M,OH D,LEE K W.Hypoglycemic health benefits of D-psicose[J].Journal of Agricultural and Food Chemistry,2012,60(4),863-869.
[9]ROTHROCK J W,HAMMES P A,MCALCCR W J.Isolation of diosgenin by acid hydrolysis of saponin[J].Ind Eng Chem,1957,49(2):186-188.
[10]LI Xiao,GAO Xiangtao,REN Yuzheng.Study on intensification effects of surfactant on the extraction of dioscin from dioscorea zingiberensis C.H.wright[J].Fine Chemicals,2009,26(2):122-125.(in Chinese)
[11]MU W,ZHANG W,F(xiàn)ENG Y,et al.Recent advances on applications and biotechnological production of D-psicose[J].Appl Microbiol Biotechnol,2012,94(6):1461-1467.
[12]JIA Min,MU Wanmeng,ZHANG Tao,et al.Expression of D-Psicose 3-Epimerase in Bacillus subtilis[J].Journal of Food Science and Biotechnology,2014,11:1129-1135.(in Chinese)
[13]MATSUO T,IZUMORI K.Effects of dietary D-psicose on diurnal variation in plasma glucose and insulin concentrations of rats[J].Biosci Biotechnol Biochem,2006a,70(9):2081-2085.
[14]REEVES P G.Components of the AIN-93 Diets as Improvements in the AIN-76A Diet[J].Journal of Nutrition,1997,127(5S):838S-841S.
[15]SHIH C,LIN C,LIN Y,et al.Validation of the antidiabetic and hypolipidemic effects of hawthorn by assessment of gluconeogenesis and lipogenesis related genes and AMP-Activated protein kinase phosphorylation [J].Evidence-based Complementary and Alternative Medicine,2013:1-12.
[16]HENNES M I,DUA A,KISSEHAH A.Effects of free acids and glucose on splanchnic insulin dynarnics[J].Diaberes,1997,46(1):57-62.
[17]BODEN G,CHEN X,RUIZ J,et al.Mechanisms of fatty acids induced inhibition of glucose updake[J].Clin Invest,1994,93(6):2438-2446.
[18]ZHANG Nana,F(xiàn)ENG Yanxian.The value of the non-HDL-C in coronary heart disease risk assessment[J].Journal of Southeast University(Medical Science Edition),2015,34(3):462-465.(in Chinese)
[19]KRISTINA S,BART S,JOHAN A.The peroxisome proliferator activated receptors (PPARs) and their effects on lipid metabolism and adipocyte differentiation[J].Biochimica et Biophysica Acta,1996,1302(2):93-109.
[20]BERNADETTE P N,JEAN F.Bart Staels.Role of the peroxisome proliferator-activated receptors (PPAR)in atherosclerosis[J].Biochemical Pharmacology,2000,60(8):1245.
[21]MANDRUP S,LANE M D.Regulating adipogenesis[J].J Biol Chem,1997,272(9):5367-5370.
[22]LIU Gui,YIN Liang,WANG Xiaohui,et al.Differential expression of FAS and ACAT-2 in livers of high fat diet induced obesity and obesity resistant rat[J].Journal of Shanghai University of Sport,2014,6:P105-109.(in Chinese)
[23]LIU Li,MA Shuang,LI Yanxi.Study on SOCS-3 and FAS expression of adipose tissues in rats fed with high-fat diet[J].Chinese Journal of Public Health,2009,25(4):428-429.(in Chinese)
[24]ZHAN Minxia,WU Guanzhong.Fatty acid synthase and disease[J].Asia-Pacific Traditional Medicine,2012,8(9):210-211.(in Chinese)

