同/異型乳酸菌對青貯玉米開窖后品質及微生物的影響
王旭哲,張凡凡,馬春暉,苗 芳,唐開婷,李菲菲
(石河子大學動物科技學院,石河子 832003)
0 引 言
隨著畜牧業的發展,玉米青貯飼料的重要性日益突顯[1-2]。玉米青貯主要依靠乳酸菌厭氧發酵產生乳酸降低pH值,并通過降低葉片呼吸和酶活性,抑制霉菌、梭狀芽孢桿菌、酵母菌和其他不利微生物生長,從而使玉米青貯得以保存[3-4],因此乳酸菌被認為是青貯飼料發酵過程中最重要的因素之一[5]。其發酵產生高濃度的乳酸,但在開窖后,不良微生物的大量消耗致使青貯飼料有氧穩定性降低,即青貯過程中微生物群落的變化將影響最終青貯飼料的品質和有氧穩定性[6-8]。主要由于酵母菌等微生物在好氧條件中利用這些化合物作為底物產生CO2、水和熱量,進而導致pH值上升,致使不耐低pH值的絲狀真菌和芽孢菌等有害菌生長增殖[9]。
為提高玉米青貯有氧穩定性,很多學者提出使用乳酸菌添加劑[10-11],認為乳酸菌添加劑能有效地改善發酵青貯飼料的質量,主要通過改變pH值,抑制有害的附生微生物生長來提高有氧穩定性[12-14]。Kharazian等[4]從伊朗玉米青貯飼料中分離得到的乳酸菌具有較高的抗真菌活性,可用作青貯飼料添加劑提高青貯玉米的質量和有氧穩定性。青貯飼料引入添加微生物菌劑這一概念是為了控制發酵,加入快速發酵的同型乳酸菌提高青貯飼料品質[15]。根據Yuan等[5]研究可知,青貯飼料添加同型乳酸菌植物乳桿菌(Lactobacillus plantarumas)導致乳酸質量分數較對照有所提高。Liu等[16]的研究中同樣發現相對于未經處理的青貯飼料,接種植物乳桿菌能提高青貯飼料發酵品質。此外,乳酸桿菌屬(Lactobacillus)或片球菌屬(Pediococcus)的其他菌也經常被使用[17]。但同型乳酸菌對于提高有氧穩定性作用不顯著,近年來為提高有氧穩定性并降低青貯發酵損失,異型發酵乳酸菌物種如布氏乳桿菌(Lactobacillus buchneri)作為青貯添加劑添加到青貯飼料中[15,18]。布氏乳桿菌可產生抗菌的乙酸和細菌素等副產物,減少有氧惡化并改善青貯品質[19]。微生物菌劑必須具備足夠數量以有效控制發酵,目前普遍認為1×105cfu/g的乳酸菌添加量可以壓制青貯附生乳酸菌成為優勢種群[20-21]。因此,應用適當的乳酸菌接種量可以確保青貯飼料質量,防止青貯飼料變質,提高經濟效益[22]。此外,已經提出同型發酵乳酸菌與布氏乳桿菌復合進行添加,因為這 2類微生物的結合有可能提高發酵速度并提高有氧穩定性[23-24]。然而,2種同型發酵乳酸菌共同添加或2種同型發酵乳酸菌與布氏乳桿菌復合添加提高玉米青貯有氧穩定性及發酵特性的能力是未知的。
基于此,本研究設置添加不同發酵類型的乳酸菌處理,探究同時添加 2種同型發酵乳酸菌、單一添加布氏乳桿菌以及 2種同型發酵乳酸菌與布氏乳桿菌復合添加對開窖后玉米青貯發酵品質、微生物數量及有氧穩定性的影響。旨在明確添加不同發酵類型的乳酸菌處理在玉米青貯開窖后,能否改善發酵品質、降低有害微生物數量、提高有氧穩定性,為生產實踐提供參考。
1 材料與方法
1.1 材料和樣地
試驗選用新飼玉10號作為青貯原料。試驗選定在石河子大學的牧草試驗站(N 44°20′,E 88°30′,H 420 m)開展。其生長期:4月10日~8月20日(2015年),共計112 d,青貯玉米的刈割期定于乳熟末期/蠟熟初期進行(玉米乳線超過2/3時),收割全株玉米,將青貯玉米切碎至1~2 cm。真空袋規格為50 cm×40 cm×0.24 mm。全株玉米青貯原料營養成分和微生物數量見表1。
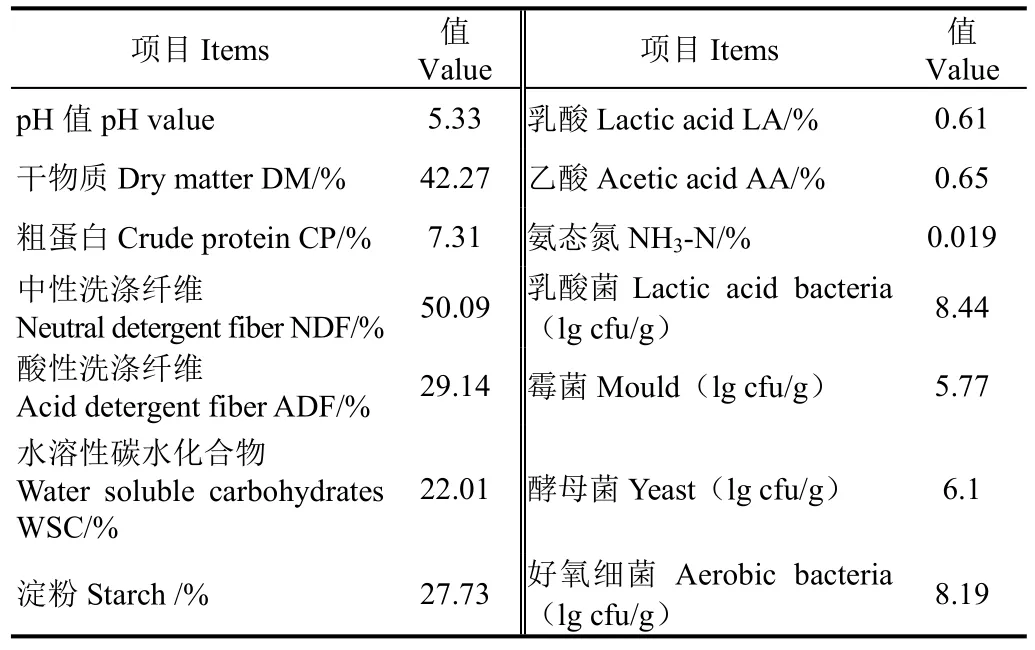
表1 玉米青貯原料營養組成和微生物數量Table 1 Nutrients composition and microbial populations of corn silage of ensiling material
1.2 試驗設計
試驗將添加乳酸菌設計為4個處理,CK處理(不加任何菌劑);T處理(同型發酵乳酸菌):Lactobacillus plantarum和Pediococcus acidilactici復合添加,添加量為1∶1,1×105cfu/g;Y 處理(異型發酵乳酸菌):Lactobacillus buchneri,添加量為1×105cfu/g;TY處理(同型+異型發酵乳酸菌):Lactobacillus plantarum、Pediococcus acidilactici和Lactobacillus buchneri復合添加,添加量為1∶1∶1,1×105cfu/g。并將各菌種在MRS(de man rogosa sharpe)液體培養基中培養,平板計數后確定其數量,按比例配置菌液。用滅菌噴壺均勻的噴灑至待貯青貯玉米表面(CK處理噴灑等量的去離子水)。噴灑完畢后立刻進行青貯。采用真空袋法調制,每個處理4袋,每袋2.0 kg,室溫(25±3)℃下發酵60 d后(開窖0 h)開窖。檢測開窖后第0、48、96、144、192,240 h青貯pH值、可溶性碳水化合物(water soluble carbohydrate,WSC)、乳酸(lactic acid,LA)、乙酸(acetic acid,AA)、氨態氮(NH3-N)、乳酸菌、霉菌、酵母菌以及好氧細菌數量的變化,對 CO2產量進行分析。開窖全程動態監測各處理青貯溫度變化。應用隸屬函數法對青貯發酵品質及微生物數量進行綜合評判。
1.3 測定方法
DM 采用 105 ℃烘干法測定[25];pH 值利用酸度計(PHS-3C,上海雷磁)測定;CP測定采用凱氏定氮法[10];NDF和ADF采用范氏法(Van Soest)[25];WSC測定采用蒽酮比色法測定[26];有機酸(乳酸、乙酸、丙酸、丁酸)用液相色譜法測定[18],氨態氮采用苯酚-次氯酸鈉比色法測定[27];微生物數量采用平板計數法計數,乳酸菌、霉菌、酵母菌以及好氧細菌分別用MRS培養基、高鹽察氏培養基、麥芽糖浸粉瓊脂培養基和營養瓊脂培養基進行培養。有氧穩定性測定在發酵60 d后打開全部實驗室青貯發窖袋,袋口用雙層紗布包裹,防止果蠅等其他雜質污染和水分散失,空氣可自由進入發酵袋中,置于室溫條件下保存。將多點式溫度記錄儀(i500-E3TW,玉環智拓儀器科技有限公司)的多個探頭分別放置于發酵袋的幾何中心,同時在環境中放置3個探頭,用于測定環境溫度,溫度記錄儀測量時間間隔設置為5 min,每個處理放置 3個溫度探頭。如果樣品溫度高于環境溫度2 ℃,說明青貯開始腐敗變質,此時記錄時間即為有氧穩定時間。CO2的測定采用CO2產氣裝置進行測定。CO2產氣裝置:按Ashbell等[28]的描述,自制評定有氧穩定性的CO2產氣裝置。每套裝置包括2個500 mL 礦泉水塑料瓶,分上(放置25 g樣品)下(KOH溶液)2部分。取20 mL 20% KOH溶液,放入上述產氣裝置內,置于30 ℃的恒溫培養箱中進行CO2產氣量測定。
1.4 數據處理
在Excel中作數據的基本處理,用SPSS 20.0對各處理的pH值、WSC、NH3-N、乳酸、乙酸、丙酸、丁酸含量、CO2、乳酸菌、霉菌、酵母菌以及好氧細菌數量以及氧穩定時間進行方差分析,通過Duncan法對各處理間的差異進行比較,并對上述指標進行具有互作效應的雙因素方差分析。采用Origin 9.0進行繪圖,對開窖時間和各微生物數量進行擬合分析。應用 Fzuuy數學中隸屬函數法進行青貯發酵品質以及微生物數量的綜合評判。其中,與發酵品質呈正相關的指標(WSC、乳酸、乙酸、乳酸菌、有氧穩定性)采用公式(1)計算,與發酵品質呈負相關的指標(pH值、NH3-N、NH3-N/TN、霉菌、酵母菌、好氧細菌和CO2含量)采用公式(2)計算。
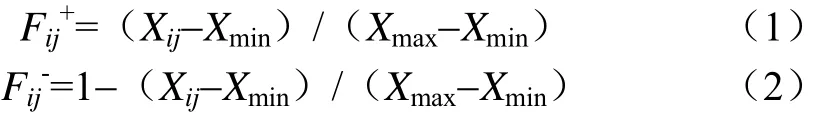
式中Fij為第i個處理第j個指標的隸屬度;Xij為第i個處理第 j個指標測定值;Xmax、Xmin為所有供試對象中第 j項指標的最大值、最小值。
2 結果與分析
2.1 添加不同乳酸菌有氧穩定性變化及CO2產氣分析
玉米青貯中添加乳酸菌處理的有氧穩定性如圖 1所示,各處理有氧暴露后穩定的時間分別為CK:131.71 h,T:131.54 h,Y:195.58 h,TY:196.21 h。其中Y和TY處理有氧穩定時間顯著高于其余處理 63.87~64.67 h(P<0.05),且二者差異不顯著(P>0.05)。同時CK和T處理間差異不顯著(P>0.05)。
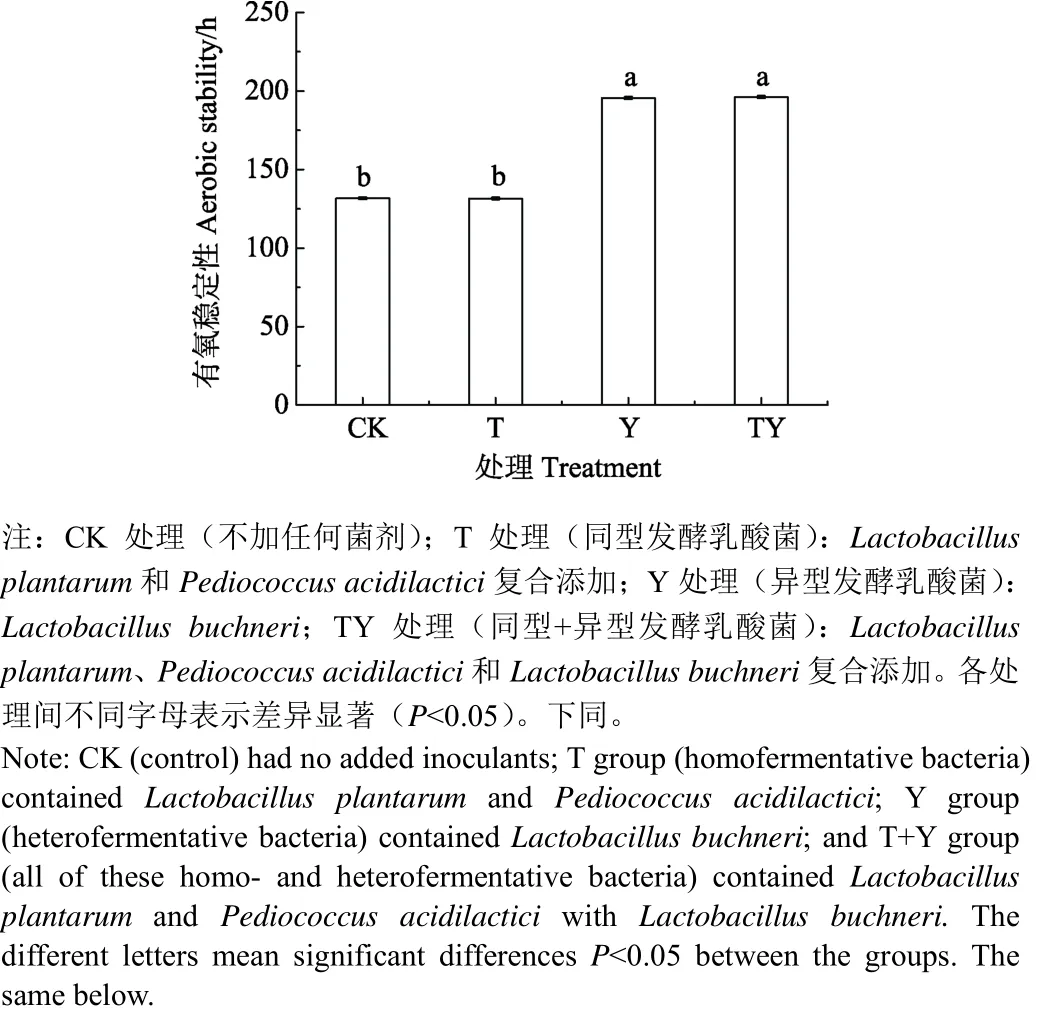
圖1 不同處理玉米青貯的有氧穩定性Fig. 1 Aerobic stability of different treatments corn silage
開窖后,對各處理青貯樣品進行CO2產氣分析(圖2),發現各處理的CO2產量和開窖時間滿足Allometric1非線性關系(P<0.01),其關系式為(3)。
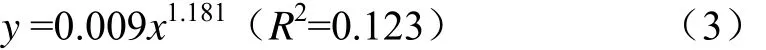
試驗結果表明,隨著開窖時間的延長,各處理的CO2產氣量逐步增加。對比各處理的產氣量發現,在開窖全程 CK處理的 CO2產量始終顯著高于 T處理(1.8%~87.2%)、Y處理(33.7%~88.6%)和TY處理(9.9%~88.3%)(P<0.05)。除開窖240 h時添加乳酸菌的處理間差異不顯著(P>0.05)外,其余開窖過程中Y和 TY處理的CO2產量始終顯著低于T處理(P<0.05),且Y處理顯著低于TY處理。即玉米青貯中乳酸菌的添加有助于降低在開窖過程中玉米青貯中的 CO2濃度,同時異型發酵乳酸菌(布氏乳桿菌)的添加更易于減少CO2的產生。
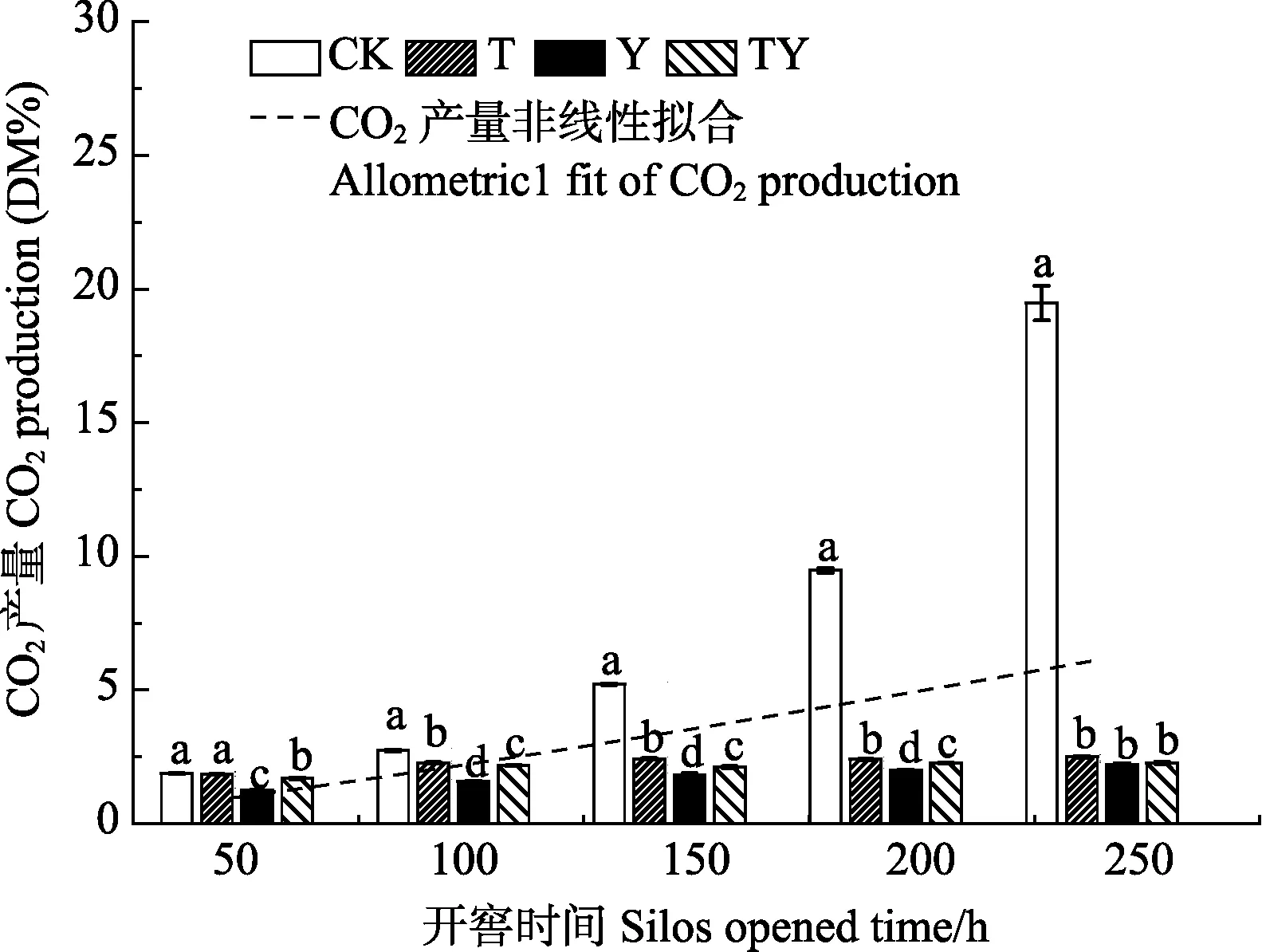
圖2 開窖后添加不同乳酸菌玉米青貯CO2產量變化Fig. 2 Change of CO2 production of corn silage adding different lactic acid bacteria after silos opened
2.2 添加不同乳酸菌處理開窖后發酵品質動態變化
玉米青貯開窖后,各處理pH值逐漸增加(表2),且在開窖240 h時較開窖0 h時上升了9.1%~15.1%。開窖后CK處理pH值始終顯著高于其余處理3.5%~13.2%(P<0.05),且在開窖240 h后CK處理的pH值超過劣質青貯的規定值4.80。而其余pH值均屬于青貯品質一般的pH值范圍,T處理pH值始終顯著低于CK處理(6.0%~15.2%)、Y處理(2.4%~5.6%)和 TY處理(0.5%~3.9%)(P<0.05)。Y 處理的 pH 值僅在開窖96,144和192 h顯著高于TY處理(P<0.05),在開窖結束時二者差異不顯著(P>0.05)。由上可知,添加乳酸菌處理在開窖后pH值均較未添加處理低,即玉米青貯中乳酸菌的添加有助于抑制開窖后青貯飼料pH值的升高。
各玉米青貯處理 WSC質量分數在開窖后的變化見表2,開窖240 h時各處理WSC質量分數均較開窖0 h時減少了31.4%~45.4%,即玉米青貯開窖后各處理WSC質量分數逐漸在減少,尤其CK 處理在開窖0 h時WSC質量分數顯著高于其余處理11.1%~11.8%(P<0.05),但開窖0 h之后其WSC質量分數迅速降低,直至開窖144 h時顯著低于其余處理(P<0.05)。由表2可知,玉米青貯開窖0 h之后,Y處理WSC質量分數始終顯著高于CK處理(10.3%~23.9%)、T處理(3.5%~16.2%)和TY處理(9.7%~24.5%)(P<0.05),即單一添加異型發酵乳酸菌(布氏乳桿菌)可在開窖后減緩玉米青貯中WSC質量分數的減少。
開窖后,各玉米青貯處理乳酸的質量分數隨開窖時間的延長而減少,開窖240 h時各玉米青貯乳酸質量分數處理較開窖0 h時降低了52.2%~69.5%。開窖后T處理乳酸質量分數始終顯著高于CK處理(2.4%~46.5%)和Y處理(8.3%~31.5%)(P<0.05),同時除開窖96 h外顯著高于 TY處理 3.8%~25.3%(P<0.05)。除開窖48和96 h外,其余開窖時間CK處理的乳酸質量分數始終顯著低于其余處理(P<0.05)。而 Y處理在開窖過程中乳酸質量分數始終顯著低于 TY處理 5.0%~9.6%(P<0.05)。由上可知,玉米青貯中乳酸菌的添加可以降低開窖后乳酸的減少量,尤其是添加同型發酵乳酸菌效果較為明顯。
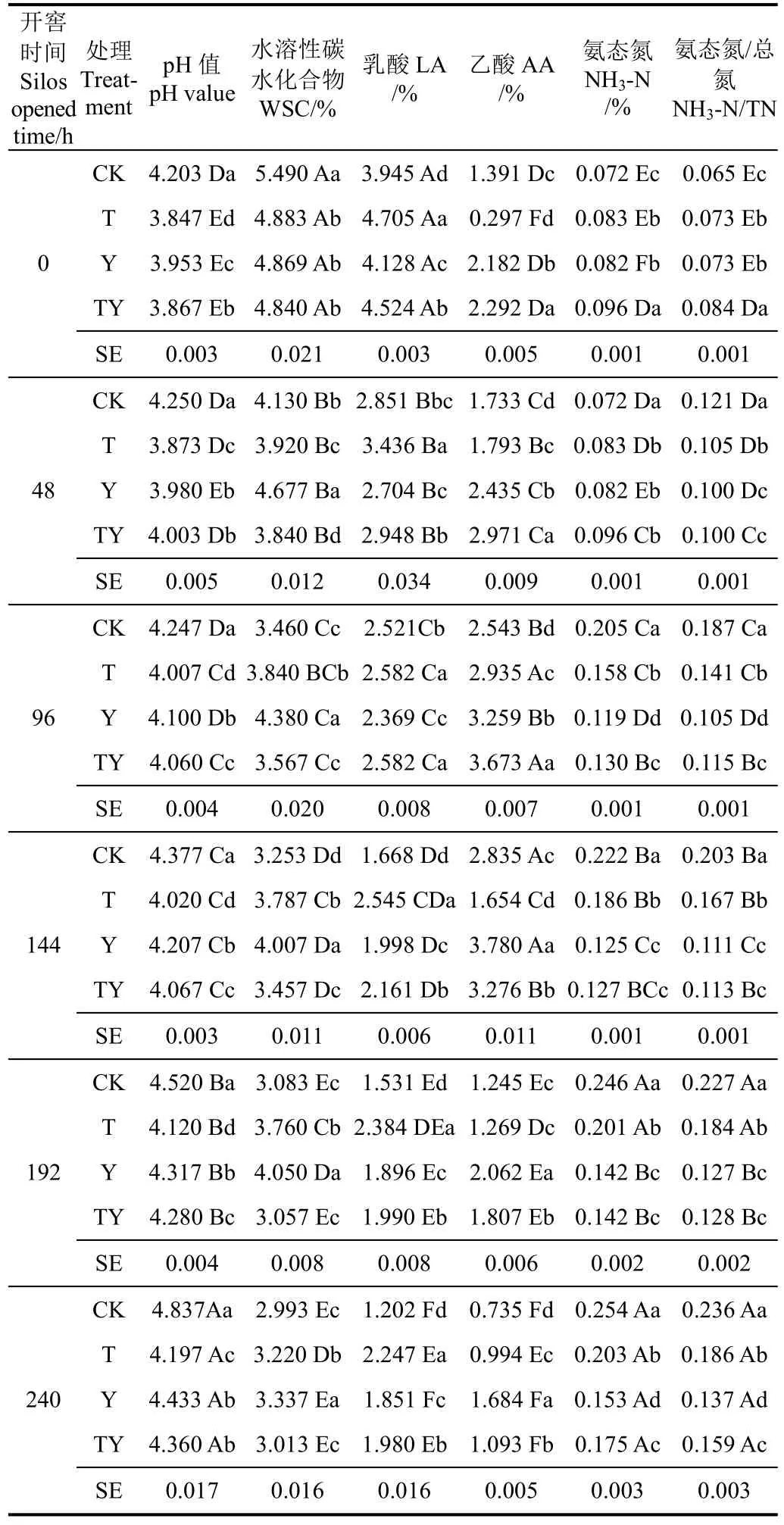
表2 開窖后添加不同乳酸菌玉米青貯發酵品質變化Table 2 Change of fermentation characteristics of corn silage adding different lactic acid bacteria after silos opened
由表 2可知,玉米青貯開窖后,各處理的乙酸質量分數均出現一定程度的上升趨勢(T和TY0~96 h,CK和Y0~144 h),之后逐漸下降,除T處理外,其余處理在240 h的乙酸質量分數均較開窖0 h減少22.9%~52.3%。其中開窖后Y和TY處理乙酸質量分數始終顯著高于CK和T處理(P<0.05)。而在開窖0~96 h,TY處理乙酸質量分數始終顯著高于 Y處理(P<0.05),此后直至開窖結束時始終顯著低于 Y處理(P<0.05)。由此可知,玉米青貯中添加含有異型發酵乳酸菌(布氏乳桿菌)的處理均對開窖后抑制乙酸的損失具有積極作用。丙酸和丁酸質量分數較低,低于檢出線。
玉米青貯開窖后,各處理NH3-N質量分數迅速增加,開窖后240 h較開窖0 h時增加了82.8%~251.5 %(表2)。其中CK處理的NH3-N質量分數增加量最大,達251.5%,且開窖0 h之后的有氧暴露過程中始終顯著高于T處理(11.1%~23.1%)、Y處理(14.9%~43.7%)和TY處理(15.0%~42.7%)(P<0.05)。Y和TY處理 NH3-N質量分數除開窖0和48 h外,其余時間均顯著低于T處理(P<0.05),但僅在開窖0,96和240 h,Y處理NH3-N質量分數顯著高于TY處理(P<0.05)。同時NH3-N/TN的變化與NH3-N質量分數變化極為相似。因此,玉米青貯添加乳酸菌后在開窖過程中可減少NH3-N的產生,且異型發酵乳酸菌(布氏乳桿菌)的添加更易于減少NH3-N的產生。
2.3 添加不同乳酸菌處理開窖后微生物數量動態變化
各玉米青貯處理中開窖后 240 h乳酸菌數量顯著高于開窖0 h時的10.7%~16.1%(P<0.05,圖3a),其中添加乳酸菌處理的玉米青貯中 240 h乳酸菌數量極顯著高于開窖0 h時(P<0.01)。將各處理的乳酸菌數量與開窖時間進行擬合發現滿足ExpDec1非線性關系(P<0.01),其關系式為式(4)。
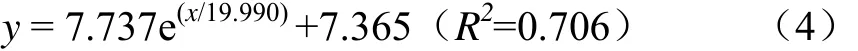
試驗結果表明,隨著開窖時間的延長,各處理的乳酸菌數量逐步增加。同時,T和TY處理乳酸菌數量除開窖0和48 h外其余時間均顯著高于CK處理(P<0.05),即玉米青貯中乳酸菌的添加有助于增加開窖過程中玉米青貯中乳酸菌數量。
開窖后,對各處理青貯樣品進行霉菌數量分析(圖3b),將各處理的霉菌數量和開窖時間進行擬合發現滿足一元線性關系(P<0.01),其關系式見式(5)。

隨著開窖時間的延長,各處理的霉菌數量逐步增加。同時發現各處理開窖后240 h霉菌數量著高于開窖0 h時2.7%~21.7%(P<0.05),其中添加乳酸菌處理的玉米青貯中240 h霉菌數量極顯著高于開窖0 h時(P<0.01)。Logistic開窖后Y處理的霉菌數量始終顯著低于CK處理(4.6%~31.3%)、T處理(24.7%~34.4%)和 TY處理(31.0%~45.2%)(P<0.05)。而 T和 TY處理的霉菌數量在開窖后始終顯著高于其余處理(P<0.05),即單一添加異型發酵乳酸菌(布氏乳桿菌)可在開窖后抑制玉米青貯中霉菌的增長,但添加同型發酵乳酸菌的效果不明顯,且復合添加 2種發酵類型的乳酸菌反而使開窖后霉菌數量增加。
玉米青貯開窖后,各處理酵母菌數量變化如圖3c所示,開窖后240 h酵母菌數量均極顯著高于開窖0 h時117.7%~206.3%(P<0.01),并從各處理的酵母菌數量與開窖時間擬合分析中發現二者呈顯著的 Logistic非線性關系(P<0.01),且關系式為式(6)。
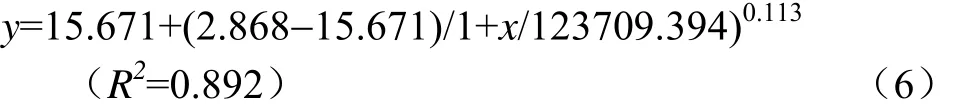
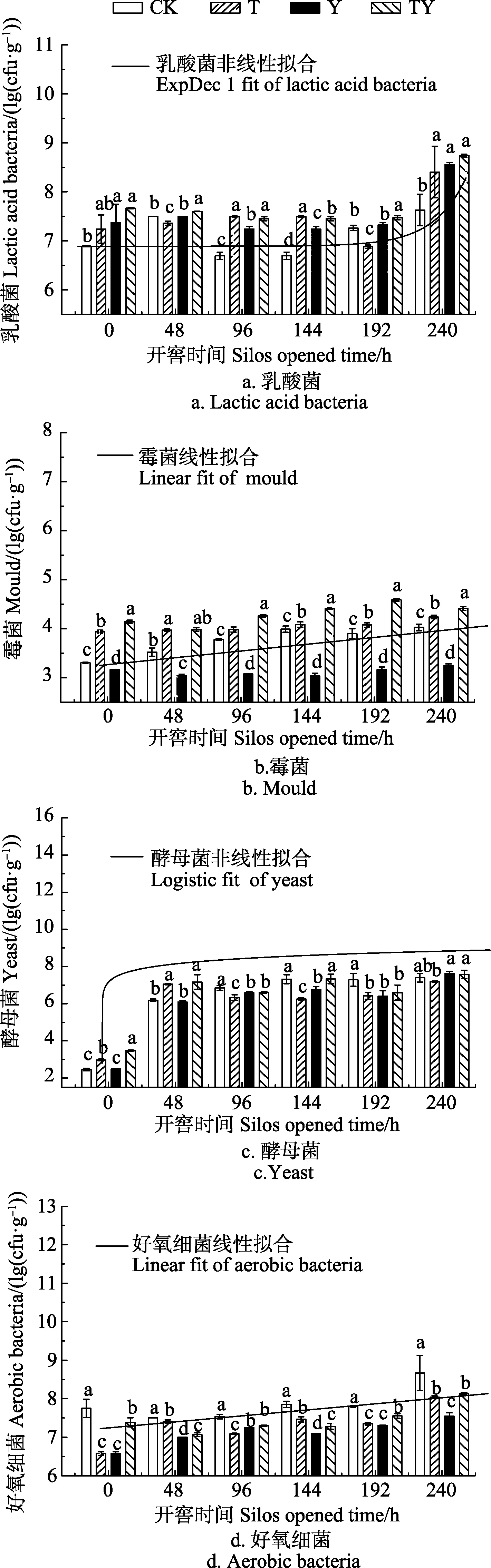
圖3 開窖后添加不同乳酸菌玉米青貯微生物數量變化Fig. 3 Change of microbial populations of corn silage at adding different lactic acid bacteria after silos opened
隨著開窖時間的延長,各處理的酵母菌數量逐步增加。除48和192 h外,其余開窖時間T處理酵母菌數量始終顯著低于TY處理1.7%~17.4%(P<0.05)。而CK處理的酵母菌數量在 96~192 h顯著高于 T和 Y處理(P<0.05)。即添加2種同型發酵乳酸菌或單一添加異型發酵乳酸菌(布氏乳桿菌)可在開窖后大部分時間內抑制玉米青貯中酵母菌的增長,但復合添加 2種發酵類型的乳酸菌反而效果不佳。
各處理玉米青貯開窖 240 h好氧細菌數量均極顯著高于開窖0 h時10.0%~22.2%(P<0.01,圖3d),將各處理的好氧細菌數量和開窖時間進行擬合發現二者滿足一元線性關系,其關系式為式(7)。
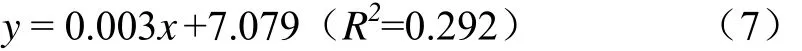
隨著開窖時間的延長,各處理的好氧細菌數量逐步增加。CK處理好氧細菌數量始終顯著高于 T處理(1.2%~15.1%)、Y處理(3.8%~15.1%)和 TY處理(3.1%~6.2%)(P<0.05)。同時,Y 處理好氧細菌數量除開窖96 h外均顯著低于TY處理(P<0.05),并在開窖第48、144和240 h顯著低于T處理(P<0.05)。由此可知,玉米青貯中添加乳酸菌有助于降低開窖過程的好氧細菌數量,同時異型發酵乳酸菌(布氏乳桿菌)的單一添加更易于減少好氧細菌的產生。
2.4 開窖時間及添加不同乳酸菌處理對開窖后玉米青貯品質的交互作用
開窖時間及試驗設置的添加不同乳酸菌處理均對玉米青貯發酵品質和微生物數量產生極顯著影響(P<0.01,表3),通過雙因素方差分析可知開窖時間與處理的交互作用對上述所有指標均產生極顯著影響(P<0.01)。
2.5 添加不同乳酸菌處理開窖后玉米青貯發酵品質及微生物數量的綜合評價
采用模糊數學隸屬函數值法,以pH值、WSC、乳酸、乙酸、NH3-N、NH3-N/TN、CO2產氣量、有氧穩定性、乳酸菌、霉菌、酵母菌和好氧細菌數量12個指標,對添加不同乳酸菌處理的玉米青貯發酵品質及微生物數量進行綜合評價(表4)。綜合評價分值越高則青貯品質越好,反之越差。開窖240 h后,對添加不同乳酸菌處理的玉米青貯發酵特性以及微生物數量的綜合排序為:
Y處理>TY處理>T處理>CK處理。
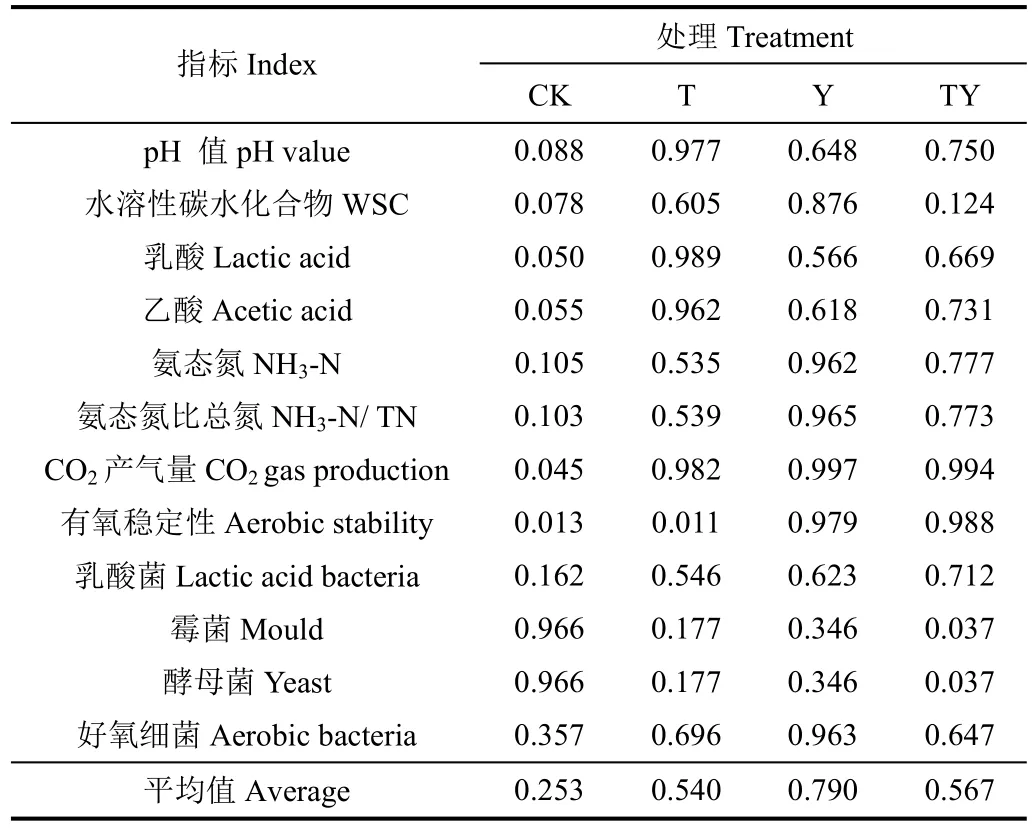
表4 開窖后添加不同乳酸菌玉米青貯發酵品質及微生物數量隸屬函數分析Table 4 Analysis of membership function of fermentation characteristics and microbial quantity of corn silage adding different lactic acid bacteria after silos opened
3 討 論
3.1 添加不同乳酸菌對玉米青貯有氧穩定性及 CO2產量的影響
青貯飼料在青貯容器開封后的穩定程度稱之為青貯飼料的有氧穩定性。在生產實踐中,有氧穩定性代表青貯飼料對溫度升高的抵抗力,而對青貯溫度的監測是開窖后最常見的物料穩定性的指標[9]。本研究中各處理的CO2產量隨著開窖時間逐漸增加,因為青貯開窖后,厭氧環境立即轉變為有氧環境,其中好氧微生物的活動性增強,其利用青貯發酵底物產生水、CO2和熱量[29],直接導致青貯溫度上升。但添加乳酸菌有助于降低開窖過程中玉米青貯中的 CO2濃度。因為青貯主要依靠乳酸菌進行厭氧發酵產生乳酸,降低 pH從而抑制不良微生物生長,減少營養損失,進一步減少 CO2的產生[21]。同時本研究發現玉米青貯中添加乳酸菌可適當提高有氧穩定性,這與Jungbluth等[30]的研究結果一致,Jungbluth通過生物添加劑成功地抑制了青貯飼料的好樣腐敗,同時減少 CO2產量并提高有氧穩定性。本研究中異型發酵乳酸菌(布氏乳桿菌)的添加更易于提高有氧穩定性,減少CO2的產生,因為異型發酵的布氏乳桿菌可產生更多的乙酸,抑制好氧變質,延長有氧穩定時間,而在有氧暴露期間,同型發酵乳酸菌所產生的乳酸可作為酵母菌生長的底物,僅產生少量能抑制酵母菌和霉菌生長的短鏈脂肪酸(乙酸、丙酸、丁酸)[29]。這一結果也從前人研究中得到了大量驗證[15,31-32],因此,單一接種同型發酵乳酸菌的玉米青貯有氧穩定性較差。另一方面,從本研究結果中可知同型發酵乳酸菌和異型發酵乳酸菌的復合添加的處理有氧穩定時間最長,顯著高于對照組和單一接種同型發酵乳酸菌的玉米青貯處理(P<0.05),但與單一接種異型發酵乳酸菌的玉米青貯有氧穩定性無顯著差異(P>0.05),這與Filya[33]報道較為相似。Filya用布氏乳桿菌和植物乳桿菌聯合接種高粱與玉米,與單獨使用布氏乳桿菌相比,得到折中的實驗結果,而聯合接種的青貯飼料比未接種的具有更好的有氧穩定性。
3.2 添加不同乳酸菌對開窖后玉米青貯發酵品質的影響
青貯飼料暴露在空氣中,pH值的增加是青貯飼料變質的一個重要指標[9]。因為在青貯開窖后便進入有氧發酵階段,此時大量以有機酸(乳酸、可溶性糖和乙醇)為主要營養基質維持生存的微生物大量生長。而乳酸在降低和維持低pH值青貯飼料中起著極為重要的作用[34]。當大量以酵母菌為主的好氧微生物接觸到空氣時,消耗乳酸引起pH值的增加。因此,本研究中無論是否添加乳酸菌的處理pH均隨開窖時間的延長逐漸增加。但是添加乳酸菌處理在開窖后pH值均較未添加處理低。這與前人研究結果一致[30-31],由于同型發酵乳酸菌在發酵過程中產生較多乳酸,開窖后雖然有所損失,仍然較其余處理質量分數高,可以維持較低pH環境[35]。同時,異型發酵乳酸菌在開窖后可分解乳酸產生乙酸,在一定程度上維持了玉米青貯中低pH水平[36]。
本研究發現,各處理的WSC質量分數均逐漸減少。因為在開窖初期細胞呼吸作用,以及隨開窖時間的增加青貯溫度的升高促進酶的水解,可能引起部分WSC的分解,造成不消化成分質量分數的相對增加,其中,WSC發酵轉化為 CO2[37]。但是單一添加異型發酵布氏乳桿菌可在開窖后減緩玉米青貯中WSC質量分數的減少。因為,異型發酵布氏乳桿菌產生乙酸抑制好氧微生物增殖,降低WSC的消耗。而異型發酵乳酸菌除利用WSC產生乙酸外,還可以利用乳酸產生乙酸和少量的1,2-丙二醇[38],即損失的WSC質量分數較少,乳酸質量分數低,但高于對照組。本研究中添加同型發酵乳酸菌的玉米青貯處理開窖后乳酸質量分數較高。因為在開窖初期氧氣質量分數較少,少量的氧氣刺激同型發酵乳酸菌利用青貯飼料中的WSC產生乳酸以維持低pH環境防止有氧腐敗,與Wang等[27]的研究結果相似。Romero的研究同樣表明添加布氏乳桿菌的青貯飼料在增加乙酸生產的同時,其乳酸濃度較未添加任何乳酸菌的對照組高[36]。Kleinschmit等[39]將全株玉米青貯接種布氏乳桿菌和片球菌,在51~361 d中比未接種組得到更高濃度的乙酸和1,2-丙二醇。從本研究中也發現同型發酵乳酸菌和異型發酵乳酸菌的復合添加的處理具有較高的乳酸和乙酸質量分數。其原因是該處理的WSC被大量消耗,主要被同型發酵乳酸菌用以產生乳酸,而其中一部分被異型發酵乳酸菌用以產生乙酸,同時異型發酵乳酸菌還利用乳酸產生乙酸。
NH3-N濃度主要反映蛋白質的降解程度,是評價青貯飼料品質的一個重要指標。玉米青貯開窖后,pH值逐漸上升,當pH值>4.2時不良微生物的活動,氨基酸被分解成氨、硫化氫和胺類,降解率增大,使得NH3-N質量分數增加[40]。本研究發現玉米青貯添加乳酸菌后在開窖過程中可減少NH3-N的產生。Junior等[9]研究發現添加乳酸菌處理相比對照處理,能有效地降低青貯飼料中蛋白質的降解。Wang等[27]的研究中也得到了相應的證實,該研究通過設置玉米和苜蓿混合青貯中添加植物乳桿菌,在開窖后發現青貯飼料的發酵特性提高且保持低pH值,具有較高乳酸質量分數,同時降低氨態氮濃度。而本研究結果顯示異型發酵乳酸菌(布氏乳桿菌)的添加更易于減少NH3-N的產生,歸咎于異型發酵乳酸菌所產生的乙酸抑制好氧微生物的活動,減緩對氨基酸的分解[11]。由于異型發酵的乳酸菌的作用,在復合添加乳酸菌的處理中NH3-N質量分數較低。
3.3 添加不同乳酸菌對開窖后玉米青貯微生物數量的影響
青貯飼料發酵過程中乳酸菌數量占主導地位,使好氧微生物的活動受到限制[15]。本研究發現玉米青貯中乳酸菌的添加有助于增加開窖過程中玉米青貯中乳酸菌數量。因為開窖后同型和異型發酵乳酸菌利用WSC等營養物質,維持生長繁殖,由于添加的乳酸菌數量在青貯中占主導地位,因此即使開窖后有氧環境不適于乳酸菌繼續生長,但其數量仍然緩慢增加。Tran等[38]研究發現青貯飼料中固有的布氏乳桿菌暴露于空氣后,其活性不足以維持青貯飼料的安全穩定。而布氏乳桿菌添加劑的使用可進一步促進乙酸產生,從而抑制好氧微生物的生長,降低霉菌數量。本研究中單一添加異型發酵乳酸菌(布氏乳桿菌)可在開窖后抑制玉米青貯中霉菌的增長,但添加同型發酵乳酸菌的效果不明顯,且復合添加2種發酵類型的乳酸菌反而使開窖后霉菌數量增加。可能由于開窖后玉米青貯中的厭氧環境被打破,且單一添加同型發酵乳酸菌及復合添加2種發酵類型乳酸菌的玉米青貯中含有較高的乳酸,為霉菌的生長繁殖創造了有利條件,雖然含有部分乙酸但其對霉菌的抑制作用弱于霉菌數量的增長。
Jungbluth等[30]研究發現微生物開始改變它們的新陳代謝,并利用氧作為對厭氧階段的直接反應。一旦它們的新陳代謝從厭氧變成有氧,氧氣被微生物呼吸所消耗,伴隨著溫度上升。試驗過程中各處理在開窖后好氧細菌均有不同程度的增加,青貯pH環境的變化促使好氧微生物生長,造成青貯營養成分的進一步的損失[41]。本研究中添加乳酸菌的玉米青貯中好氧細菌數量較對照組少,同時異型發酵乳酸菌的單一添加更易于減少好氧細菌的產生。這些抗菌性能是通過有機酸穿過細胞膜在細胞質內解離并釋放H+的結果。其結果使細胞內的pH迅速降低,產生大量ATP抵抗pH值下降以維持細胞內穩態,最終導致細胞減少或停止生長[27]。在Kharazian等[4]對生物測定的結果中反映出,異型發酵乳酸菌相對于同型發酵菌具備較高抑菌性能。本研究發現單一添加同型或異型發酵乳酸菌可在開窖后大部分時間內抑制玉米青貯中酵母菌的增長,但復合添加 2種發酵類型的乳酸菌反而效果不佳。是由于開窖后復合添加同型或異型發酵乳酸菌的玉米青貯中,其pH值高于添加同型發酵乳酸菌的玉米青貯處理,乙酸質量分數低于單一添加異型發酵乳酸菌的玉米青貯中的玉米青貯處理。
Baek等[42]報道,明串珠菌和魏斯氏乳酸菌所產生的乳酸和乙酸的是主要抗菌物質。已有的研究表明乳酸在抑菌中起重要作用,但不是唯一的一種。在 Kharazian等[4]的研究中,一些乳酸菌菌株沒有高質量分數的乳酸生產但顯示出較高的抑菌率,因此乳酸菌可能會產生一些其他的抗真菌物質。異型發酵乳酸菌能抑制好氧變質,其產生的乙酸被看作是主要的抑制物質[18]。但Akihisa等[43]研究發現添加異型發酵乳酸菌 TM2的黑麥草青貯飼料發酵品質好,乙酸和丙酸質量分數也較少但有氧穩定性比乙酸質量分數較多的乙酸添加青貯飼料好,說明乳酸菌TM2能產生乙酸以外的抗酵母菌和霉菌的物質。最近的研究已經證實,一些乳酸菌生產其他抗真菌化合物,如環二肽、蛋白質類化合物、有機酸、脂肪酸和抑菌素[44-45]。因此,添加這類不僅能提高青貯發酵品質,而且能改善青貯飼料有氧穩定性的乳酸菌值得研究與利用。
4 結 論
綜上所述,玉米青貯中添加不同乳酸菌對開窖后青貯飼料發酵品質、微生物數量、有氧穩定性影響顯著。綜合評價表明,單一添加異型發酵乳酸菌(Lactobacillus buchneri,添加量為 1×105cfu/g)的處理評分最高(0.790)。因此,單一添加異型發酵乳酸菌的玉米青貯,開窖后在改善發酵品質、降低有害微生物數量、提高有氧穩定性方面均優于單一添加同型或復合添加乳酸菌的玉米青貯。
[1] Ferreira G, Alfonso M, Depino S, et al. Effect of planting density on nutritional quality of green-chopped corn for silage[J]. Journal of Dairy Science, 2014, 97(9): 5918-5921.
[2] Neumann M, Horts E H, Figueira D N, et al. Potential of corn silage production in different sowing times in the Paraná Midwest region[J]. 2016, 9(1): 37-44.
[3] Keller L A M, Pereyra M L G, Keller K M, et al. Fungal and mycotoxins contamination in corn silage: monitoring risk before and after fermentation[J]. Journal of Stored Products Research, 2013, 52(1): 42-47.
[4] Kharazian Z A, Jouzani G S, Aghdasi M, et al. Biocontrol potential of Lactobacillus, strains isolated from corn silages against some plant pathogenic fungi[J]. Biological Control,2017, 110(4): 33-43.
[5] Yuan X J, Guo G, Wen A Y, et al. The effect of different additives on the fermentation quality, in vitro, digestibility and aerobic stability of a total mixed ration silage[J]. Animal Feed Science & Technology, 2015, 207(6): 41-50.
[6] Ni K, Wang Y, Li D, et al. Characterization, identification and application of lactic acid bacteria isolated from forage paddy rice silage[J]. Plos One, 2015, 10(3): 1-14.
[7] Jr K L, Robinson J R, Ranjit N K, et al. Microbial populations, fermentation end-products, and aerobic stability of corn silage treated with ammonia or a propionic acid-based preservative.[J]. Journal of Dairy Science, 2000, 83(7): 1479-1486.
[8] Muck R E. Silage microbiology and its control through additives.[J]. Revista Brasileira De Zootecnia, 2010, 39(39):183-191.
[9] Junior V H B, Fortaleza A P D S, Junior F L M, et al.Aerobic stability in corn silage (Zea mays L.) ensiled with different microbial additives[J]. Acta Scientiarum Animal Sciences, 2017, 39(4): 357-362.
[10] Rabelo C H S, Rezende A V D, Nogueira D A, et al. Perdas fermentativas e estabilidade aeróbia de silagens de milho inoculadas com bactérias ácido-láticas em diferentes estádios de maturidade[J]. Revista Brasileira De Saúde E Produ??o Animal, 2012, 13(3): 656-668.
[11] Silva N C D, Dos Santos J P, ávila, Carla L. S, et al.Evaluation of the effects of two Lactobacillus buchneri strains and sodium benzoate on the characteristics of corn silage in a hot-climate environment[J]. Grassland Science,2015, 60(3): 169-177.
[12] Denek N, Can A, Avci M, et al. The effect of molasses-based pre-fermented juice on the fermentation quality of first-cut lucerne silage[J]. Grass & Forage Science, 2011, 66(2): 243-250.
[13] Chen L, Guo G, Yuan X, et al. Effects of applying molasses,lactic acid bacteria and propionic acid on fermentation quality, aerobic stability and in vitro gas production of total mixed ration silage prepared with oat–common vetch intercrop on the Tibetan Plateau[J]. Journal of the Science of Food & Agriculture, 2016, 96(5): 1678-1685.
[14] Trabi E B, Yuan X, Li J, et al. Effect of glucose and lactic acid bacteria on the fermentation quality, chemical compositions and in vitro digestibility of mulberry (Morus Alba) leaf silage[J]. Pakistan Journal of Zoology, 2017, 49(6):2271-2277.
[15] Koc F, Aksoy S O, Okur A A, et al. Effect of pre-fermentated juice, Lactobacillus plantarum and Lactobacillus buchneri on the fermentation characteristics and aerobic stability of high dry matter alfalfa bale silage[J]. Journal of Animal & Plant Sciences, 2017, 27(5): 1426-1431.
[16] Liu Q H, Shao T, Bai Y F. The effect of fibrolytic enzyme;Lactobacillus plantarum, and two food antioxidants on the fermentation quality; alpha-tocopherol and beta-carotene of high moisture napier grass silage ensiled at different temperatures[J]. Animal Feed Science & Technology, 2016,221(8): 1-11.
[17] Dunière L, Sindou J, Chaucheyras-Durand F, et al. Silage processing and strategies to prevent persistence of undesirable microorganisms[J]. Animal Feed Science &Technology, 2013, 182(1-4): 1-15.
[18] Rabelo C H S, Basso F C, Lara E C, et al. Effects of Lactobacillus buchneri as a silage inoculant and as a probiotic on feed intake, apparent digestibility and ruminal fermentation and microbiology in wethers fed low-dry-matter whole-crop maize silage[J]. Grass & Forage Science, 2018,73(1): 534-544.
[19] Rabelo C, Basso F, Mcallister T A, et al. Influence of Lactobacillus buchneri and forage: Concentrate ratio on the growth performance, fatty acid profile in longissimus muscle and meat quality of beef cattle[J]. Canadian Journal of Animal Science, 2016, 96(4): 550-562.
[20] Li X, Xu W, Yang J, et al. Effects of applying lactic acid bacteria to the fermentation on a mixture of corn steep liquor and air-dried rice straw[J]. Animal Nutrition, 2016, 2(3): 229-233.
[21] Abdul R N, Abd Halim M R, Mahawi N, et al. Determination of the use of Lactobacillus plantarum and Propionibacterium freudenreichii application on fermentation profile and chemical composition of corn silage[J]. BioMed Research International, 2017(1): 1155-1162.
[22] Huisden C M, Adesogan A T, Kim S C, et al. Effect of applying molasses or inoculants containing homofermentative or heterofermentative bacteria at two rates on the fermentation and aerobic stability of corn silage[J].Journal of Dairy Science, 2009, 92(2): 690-697.
[23] Weinberg Z G, Ashbell G, Hen Y, et al. Ensiling whole-crop wheat and corn in large containers with Lactobacillus plantarum and Lactobacillus buchneri[J]. Journal of Industrial Microbiology & Biotechnology, 2002, 28(1): 7-11.
[24] Adesogan A T, Salawu M B. Effect of applying formic acid,heterolactic bacteria or homolactic and heterolactic bacteria on the fermentation of bi-crops of peas and wheat[J]. Journal of the Science of Food & Agriculture, 2004, 84(9): 983-992.
[25] 張麗英. 飼料分析及飼料質量檢測技術(第 2版)[M]. 北京:中國農業出版社, 2002.
[26] 高俊鳳. 植物生理學實驗指導[M]. 北京:高等教育出版社,2006.Gao Junfeng. Plant Physiology Experimental Guidance [M].Beijing: Higher Education Press, 2006. (in Chinese with English abstract)
[27] Wang M, Yu Z, Wu Z, et al. Effect of Lactobacillus plantarum‘KR107070’ and a propionic acid-based preservative on the fermentation characteristics, nutritive value and aerobic stability of alfalfa-corn mixed silage ensiled with four ratios[J]. Grassland Science, 2017, 64: 51-60.
[28] Ashbell G, Weinberg Z G, Azrieli A, et al. A simple system to study the aerobic deterioration of silages[J]. El Día Médico,1991, 30(64): 391-393.
[29] Wang M, Yang C, Jia L, et al. Effect of Lactobacillus buchneri and Lactobacillus plantarum on the fermentation characteristics and aerobic stability of whipgrass silage in laboratory silos[J]. Grassland Science, 2015, 60(4): 233-239.
[30] Jungbluth K H, Trimborn M, Maack G C, et al. Effects of three different additives and two different bulk densities on maize silage characteristics, temperature profiles, CO2and O2-dynamics in small scale silos during aerobic exposure[J].Applied Sciences, 2017, 7(6): 545-556.
[31] Kristensen N B, Sloth K H, H?jberg O, et al. Effects of microbial inoculants on corn silage fermentation, microbial contents, aerobic stability, and milk production under field conditions[J]. Journal of Dairy Science, 2010, 93(8): 3764-3774.
[32] Tabacco E, Piano S, Revellochion A, et al. Effect of Lactobacillus buchneri LN4637 and Lactobacillus buchneri LN40177 on the aerobic stability, fermentation products, and microbial populations of corn silage under farm conditions.[J]. Journal of Dairy Science, 2011, 94(11): 5589-5598.
[33] Filya I. The Effect of Lactobacillus buchneri, and Lactobacillus plantarum, on the fermentation, aerobic stability, and ruminal degradability of low dry matter corn and sorghum silages[J]. Journal of Dairy Science, 2003,86(11): 3575-3581.
[34] Jungbluth K, Maack C, Büscher W, et al. A new ex-situ method to investigate aerobic stability of maize silage faces[J]. Journal of Agricultural Science and Technology.2016, 2, 49-54.
[35] Yuan X J, Wang J, Guo G, et al. Effects of ethanol, molasses and Lactobacillus plantarum on fermentation characteristics and aerobic stability of total mixed ration silages[J]. Grass &Forage Science, 2016, 71(2): 328-338.
[36] Romero J J, Zhao Y, Balseca-Paredes M A, et al. Laboratory silo type and inoculation effects on nutritional composition,fermentation, and bacterial and fungal communities of oat silage[J]. Journal of Dairy Science, 2017, 100(3): 1812-1828.
[37] ávila C L S, Pinto J C, Sugawara M S, et al. Effect of addition of a bacteria isolated from sugarcane silage on the quality of the silage[J]. Acta Scientiarum Animal Sciences,2008, 30(3): 255-261.
[38] Tran T M T, Nguyen M T, Nguyen H V, et al. Effects of wilting and lactic acid bacteria inoculation on fermentation and microbial community of elephant grass silage produced in Vietnam[J]. Grassland Science, 2017, 10: 1-5.
[39] Kleinschmit D H, Jr K L. A meta-analysis of the effects of Lactobacillus buchneri on the fermentation and aerobic stability of corn and grass and small-grain silages[J]. Journal of Dairy Science, 2006, 89(10): 4005-4013.
[40] Hashemzadeh-Cigari F, Khorvash M, Ghorbani G R, et al.Interactive effects of molasses by homofermentative and heterofermentative inoculants on fermentation quality,nitrogen fractionation, nutritive value and aerobic stability of wilted alfalfa (Medicago sativa L) silage[J]. Journal of Animal Physiology & Animal Nutrition, 2013, 98(2): 290-299.
[41] Borreani G, Piano S, Tabacco E. Aerobic stability of maize silage stored under plastic films with different oxygen permeability. Journal of the Science of Food & Agriculture,2014, 94(13): 2684-2690.
[42] Baek E, Kim H, Choi H, et al. Antifungal activity of Leuconostoc citreum, and Weissella confusa, in rice cakes[J].Journal of Microbiology, 2012, 50(5): 842-848.
[43] Akihisa Y, Hidenori K, Yasuhiro A, et al. Effects of addition of acetic acid, 1,2-propanedol and lactic acid bacteria on the aerobic stability of Italian ryegrass silage[C]// Grassland Agriculture: Balancing Production and Environmental Protection----Proceedings of the, China-Japan-Korea Grassland Conference, 2006: 93-95.
[44] Crowley S, Mahony J, Sinderen D V. Current perspectives on antifungal lactic acid bacteria as natural bio-preservatives[J].Trends in Food Science & Technology, 2013, 33(2): 93-109.
[45] Gajbhiye M H, Kapadnis B P. Antifungal-activity-producing lactic acid bacteria as biocontrol agents in plants[J].Biocontrol Science & Technology, 2016, 26(11): 1451-1470.

