茶黃素抗氧化化學機制研究
謝 虹XIE Hong 羅志聰 - 李熙燦 -
(廣州中醫藥大學中藥學院,廣東 廣州 510006)
紅茶是一種全發酵型茶類,因其香氣甜純、滋味濃厚而廣泛受到世界消費者的喜愛。茶黃素(圖1)是紅茶在發酵過程中,由簡單兒茶素類聚合而成的黃烷醇類化合物[1],是衡量紅茶品質的重要因素。現代藥理學研究表明,茶黃素有顯著的抗腫瘤[2]、抗炎[3]、抗氧化作用[4-5],是紅茶發揮保健作用的重要物質基礎。陳虎等[6]認為茶黃素能調節體內生物酶系的活性、防止低密度脂蛋白的氧化,修復生物系統的氧化損傷。最新的研究[7-8]還表明,茶黃素能通過hedgehog或Shh等信號通路限制肝的瘤變。但這些研究側重闡明其抗氧化的生物機制,沒有涉及化學機制。
本研究采用化學模式,研究茶黃素清除各種自由基的清除活性。在此基礎上,進一步討論其機制,以闡釋茶黃素體內抗氧化的化學本質。
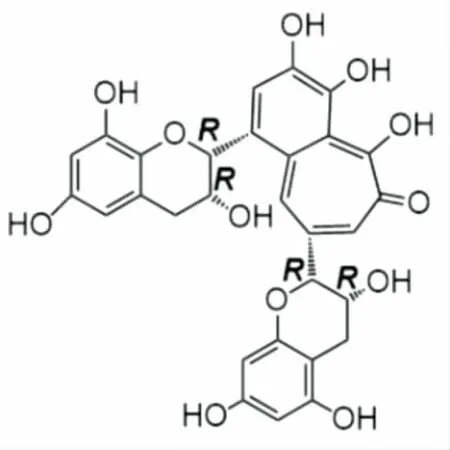
圖1 茶黃素的結構式Figure 1 Structure of theaflavin
1 材料與方法
1.1 材料與儀器
1.1.1 材料與試劑
茶黃素(CAS:4670-5-7):HPLC≥98%,四川省維克奇生物科技有限公司;
新銅試劑、DPPH(1,1-二苯基-2-三硝基苯肼)自由基、Trolox:HPLC≥98%,西格瑪奧德里奇(上海)貿易有限公司;
(NH4)2ABTS [2,2’-聯氮-二(3-乙基-苯并噻唑-6-磺酸)二銨鹽]:美國Amresco公司;
K2S2O8、CuSO4、CH3COONH4、95%乙醇:AR級,廣州化學試劑廠。
1.1.2 儀器設備
紫外-可見分光光度計:UV2100型,上海尤尼柯儀器有限公司;
電子天平:BS110S型,北京賽多利斯天平有限公司。
1.2 試驗方法
1.2.1 DPPH·清除能力的測定 依據文獻[9]并做適量修改。稱取1 mg DPPH,加入95%乙醇20 mL,超聲使之完全溶解。取溶解后的DPPH·溶液1 mL與95%乙醇500 μL混合,利用紫外分光光度計在519 nm下測吸光度(A0)值。取該DPPH·溶液1 mL分別與20,40,60,80,100 μL的茶黃素溶液(0.1 mg/mL)混合,再向其中分別加入480,460,440,420,400 μL的95%乙醇使之總體積為1.5 mL,靜置30 min 后,在519 nm下測吸光度值。平行測定3次。以Trolox(0.1 mg/mL)為陽性對照。樣品清除DPPH·的能力按式(1)計算:
(1)
式中:
R——自由基清除率,%;
A0——未加樣品液時所測吸光度值;
A——加入樣品液時所測吸光度值。
1.2.2 ABTS+·清除能力的測定 依據文獻[10]并做適量修改。取7.4 mmol/L (NH4)2ABTS溶液和2.6 mmol/L K2S2O8溶液各1 mL混合,在室溫避光下放置12 h,使之反應完全。用95%乙醇稀釋此ABTS+·工作液,利用紫外分光光度計在734 nm下測A0值,調整A0至(0.7±0.02)。取該ABTS+·工作液800 μL,加茶黃素(0.025 mg/mL)xμL(x=15,30,45,60,75),再加95%乙醇(200-x) μL,振搖10 s 以充分混合,然后在734 nm下測定吸光度值,平行檢測3次。以Trolox (0.025 mg/mL)標準品為陽性對照。樣品清除ABTS+·的能力按式(1)計算。
1.2.3 Cu2+還原能力的測定 依據文獻[11]并做適量修改。取0.01 mol/L CuSO4溶液和7.5 mmol/L新銅試劑各125 μL混勻,依次加入茶黃素(0.1 mg/mL)xμL(x=15,30,45,60,75,90)、CH3COONH4緩沖液(700-x) μL,混合,靜置30 min,于450 nm處測吸光度值,平行檢測3次。以Trolox (0.1 mg/mL)標準品為陽性對照。樣品Cu2+還原能力按式(2)計算:
(2)
式中:
S——Cu2+的相對還原率,%;
A0——未加樣品液時所測吸光度值;
Amax——一次測量內最大的吸光度值;
A——加入樣品液時所測吸光度值。
1.2.4 數據分析 每個樣品重復3次試驗,試驗結果以平均值±標準差表示,采用SPSS 13.0對數據進行t檢驗。P<0.05 表示具有統計學意義。
2 結果與討論
2.1 DPPH自由基清除活性及機制
DPPH自由基是一種以N為中心的穩定自由基,由于其分子中存在多個吸電子的—NO2和苯環的大π鍵,所以氮自由基能穩定存在[12]。DPPH自由基的乙醇溶液為深紫色,其在517 nm處有強吸收。若與樣品混合,反應液的顏色變淡,同時在517 nm下吸光度值減少,據此可以判斷樣品清除DPPH自由基的能力[13]。從圖2中可以看出,在0~6 μg/mL 的濃度范圍內,茶黃素清除DPPH·的能力逐漸增加,并且表現出良好的量效關系。其IC50=(7.7±0.1) μmol/L,小于Trolox的(見表1),說明茶黃素清除DPPH·的能力強于Trolox。此前的文獻[14]認為,氫原子轉移(hydrogen atom transfer,HAT)是DPPH·清除涉及到的一種重要機制,活潑的DPPH·接受了一個氫原子后形成了穩定的DPPH—H分子。因此,DPPH·清除模型可以用來衡量抗氧化劑的HAT能力[15]。
依據文獻[16],茶黃素分子與DPPH·發生的反應,可表示為圖3。在反應中,茶黃素上的鄰二酚羥基(O—H鍵)發生均裂,失去H·后形成茶黃素自由基(I),H·與DPPH· 結合生成穩定的DPPH—H分子。茶黃素自由基(I),進一步轉化為更穩定的鄰苯醌式產物(II)。不難看出,正是鄰苯醌式產物的穩定性,導致了茶黃素分子的強抗氧化活性。因此,茶黃素發揮其體外抗氧化作用可能與其具有的HAT能力有關。值得一提的是,茶黃素的鄰苯醌式產物多存在于環狀化合物,鏈狀化合物由于不具有環狀結構,無法轉變為醌式結構,所以大多不表現出抗氧化活性(如十六酸)[17]。
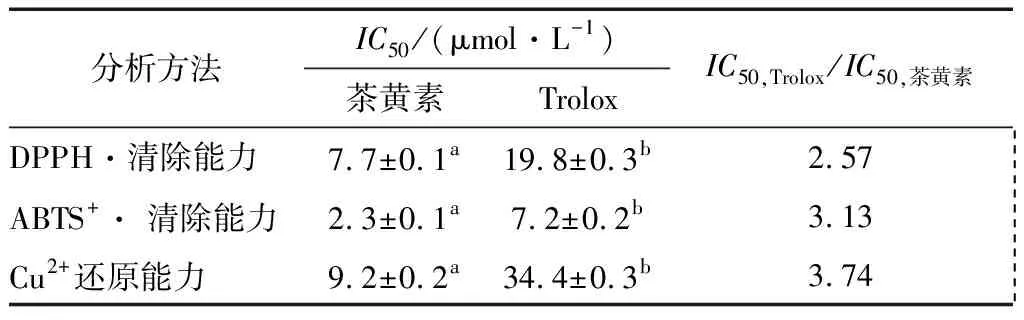
表1 茶黃素和Trolox在各種抗氧化分析法中的IC50值?Table 1 The IC50 values of theaflavin and Trolox in several antioxidant assays
?IC50值是指當自由基的清除率為50%時樣品的濃度;同行不同字母表示差異顯著(P<0.05)。

圖2 茶黃素和Trolox的DPPH自由基清除率曲線Figure 2 The dose response curves of theaflavin and Trolox in DPPH·-scavenging assay
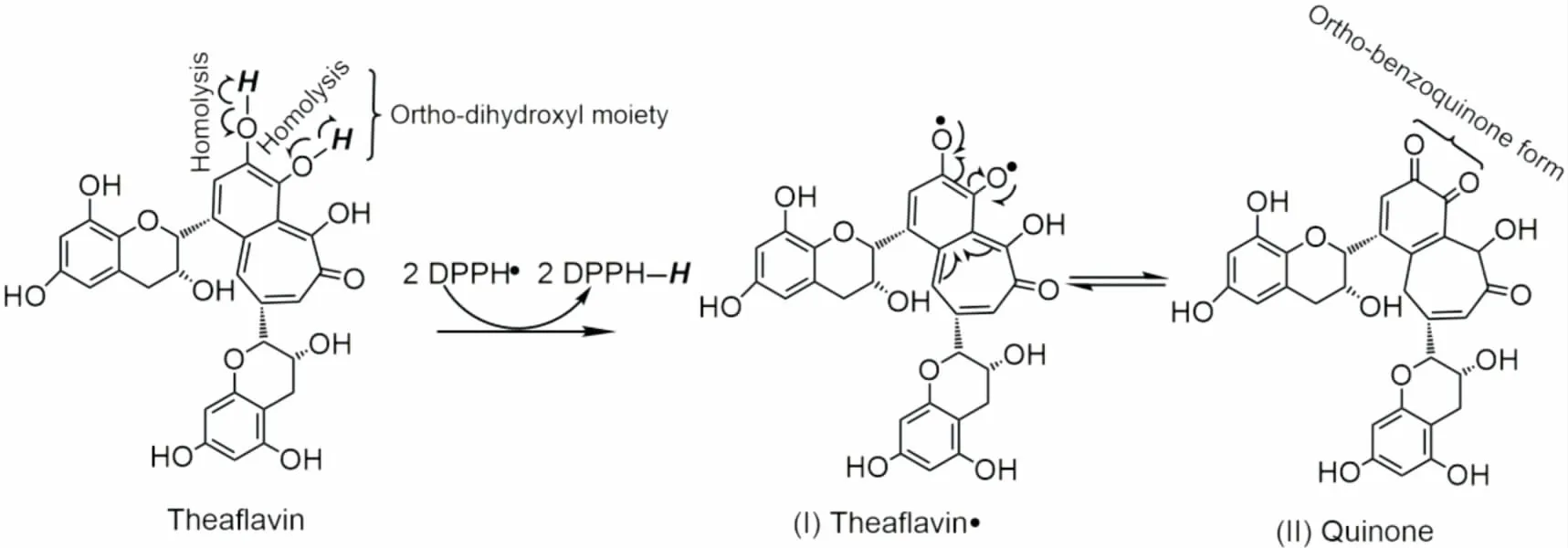
圖3 茶黃素與DPPH·可能發生的反應式Figure 3 The proposed reaction of theaflavin with DPPH·
2.2 ABTS自由基清除活性及機制
ABTS法是一種經典的檢測物質抗氧化能力的方法[18],適用于天然的或合成的抗氧化劑[19]。(NH4)2ABTS與K2S2O8反應可以生成穩定的ABTS+·自由基,此自由基呈深綠色,在734 nm處有最大吸收。如果ABTS+·被樣品清除,其734 nm的吸光度值會降低,顏色變淺。據此,可以來判斷樣品清除ABTS+·的能力[20]。從圖4中可以看出,在0~2 μg/mL的濃度范圍內,茶黃素清除ABTS+·的能力與其濃度形成良好的量效關系。其IC50值為(2.3±0.1) μmol/L,小于Trolox的(見表1),說明茶黃素清除ABTS+·的能力強于Trolox。通常認為ABTS+·被清除的機制是電子轉移(ET)的過程(ABTS+· +e→ ABTS)[21]。據此推測,茶黃素有較強的ABTS+·清除能力,其清除過程至少包括ET機制。
2.3 Cu2+還原能力及機制
抗氧化劑對金屬離子的還原能力,也可用于衡量其活性強弱[22]。從圖5中可以看出,在0~90 μg/mL的質量濃度范圍內,茶黃素對銅離子的相對還原率與濃度呈現出良好的線性關系。其IC50=(9.2±0.2) μmol/L,小于Trolox的(見表1),表明茶黃素還原Cu2+的能力強于Trolox。文獻[20]表明,Cu2+被還原成Cu+是電子轉移的過程。這進一步印證了茶黃素具有ET能力的推測。
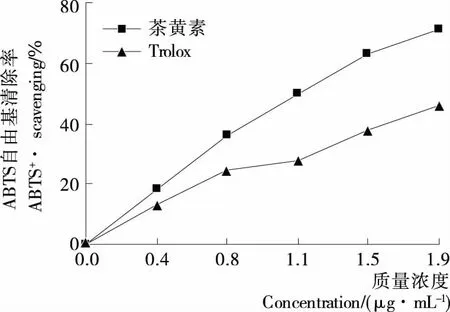
圖4 茶黃素和Trolox的ABTS+·清除率曲線
Figure 4 The dose response curves of theaflavin and Trolox in ABTS+·-scavenging assay

圖5 茶黃素和Trolox 的相對Cu2+還原能力濃度曲線
Figure 5 The dose response curves of theaflavin and Trolox in Cu2+-reducing assay
3 結論
作為一種存在于紅茶中的天然抗氧化劑,茶黃素在DPPH自由基清除、ABTS清除、Cu2+還原力3個方面,其活性均明顯強于Trolox。它的抗氧化作用可能涉及氫原子轉移(HAT)和電子轉移(ET)。并且通過HAT機制,茶黃素可轉化為穩定的鄰苯醌式產物。此研究闡明了茶黃素抗氧化的化學機制,有助于理解抗氧化活性與結構的關系,為茶黃素類衍生物的開發利用提供理論基礎。但該試驗對于茶黃素所涉及的化學機制研究尚不全面,仍有待進一步分析完善。
[1] KUSANO R, MATSUO Y, SAITO Y, et al. Oxidation mechanism of black tea pigment theaflavin by peroxidase[J]. Tetrahedron Letters, 2015, 56: 5 099-5 102.
[2] GAO Ying, RANKIN G O, TU You-ying, et al. Inhibitory effects of the four main theaflavin derivatives found in black tea on ovarian cancer cells[J]. Anticancer Research, 2016, 36(2): 643-651.
[3] CAI Fei, LI Cai-rong, WU Ji-liang, et al. Theaflavin ameliorates cerebral ischemia-reperfusion injury in rats through its anti-inflammatory effect and modulation of STAT-1[J]. Mediators of Inflammation, 2006, 5: 30 490.
[4] MANGERICH A, KNUTSON C G, PARRY N M, et al. Infection-induced colitis in mice causes dynamic and tissue-specific changes in stress response and DNA damage leading to colon cancer[J]. Proceedings of the National Academy of Sciences of the United states of America, 2012, 109(27): E1 820-E1 829.
[5] 沈麗萍. 茶黃素研究進展[J]. 中國農學通報, 2010, 26(1): 134-139.
[6] 陳虎, 胡英, 周睿, 等. 茶黃素的抗氧化機理的研究進展[J]. 茶葉科學, 2005, 25(4): 237-241.
[7] SUR S, PAL D, MANDAL S, et al. Tea polyphenols epigallocatechin gallete and theaflavin restrict mouse liver carcinogenesis through modulation of self-renewal Wnt and hedgehog pathways[J]. Journal of Nutritional Biochemistry, 2016, 27: 32-42.
[8] LI Xi-can, WEI Gang, WANG Xiao-zhen, et al. Targeting of the shh pathway by atractylenolides promotes chondrogenic differentiation of mesenchymal stem Cells[J]. Biological & Pharmaceutical Bulletin, 2012, 35: 1 328-1 335.
[9] WANG Ting-ting, ZENG Gong-chang, LI Xi-can, et al. In vitro studies on the antioxidant and protective effect of 2-substituted-8-hydroxyquinoline derivatives against H2O2-Induced oxidative stress in BMSCs[J]. Chemical Biological Drug Design, 2010, 75(2): 214-222.
[10] LI Xi-can, CHEN Dong-feng, MAI Ying, et al. Concordance between antioxidant activities in vitro and chemical components of Radix Astragali (Huangqi)[J]. Natural Product Research, 2012, 26: 1 050-1 053.
[11] LI Xi-can, LIU Jing-jing, LIN Jian, et al. Protective effects of dihydromyricetin against ·OH-induced mesenchymal stem cells damage and mechanistic chemistry[J]. Molecules, 2016, 21: 604.
[12] LI Xi-can, JIANG Qian, WANG Ting-ting, et al. Comparison of the antioxidant effects of quercitrin and isoquercitrin: Understand-ing the role of the 6″-OH group[J]. Molecules, 2016, 21: 1 246.
[13] LI Xi-can, HAN Lu, LI Yung-rong, et al. Protective effect of sinapine against hydroxyl radical-induced damage to mesenchymal stem cells and possible mechanisms[J]. Chemical & Pharmaceutical Bulletin, 2016, 64: 319-325.
[14] LI Xi-can, HAN Wei-juan, MAI Wen-qiong, et al. Antioxidant Activity and Mechanism of Tetrahydroamentoflavone in vitro[J]. Natural Product Communications, 2013, 8: 787-789.
[15] WANG Guang-rong, LI Xi-can, ZENG He-ping. Synthesis, antioxidation activity of (E)-9-p-Tolyl-3-[2-(8-hydroxy-quinol-2-yl)vinyl]-carbazole and (E)-9-(p-Anisyl)-3-[2-(8-hydroxy-quinol-2-yl)vinyl]-carbazole and their induction proliferation of mesenchymal stem cells[J]. Acta Chimica Sinica, 2009, 67(9): 974-982.
[16] CHEN Dong-feng, LI Xi-can, XU Zhi-wei, et al. Hexadecanoic acid from buzhong yiqi decoction induces proliferation of bone marrow mesenchymal stem cells[J]. Journal of Medicinal Food, 2010, 13: 967-970.
[17] LI Xi-can, HU Qiu-ping, JIANG Shu-xia, et al.FlosChrysanthemiIndiciprotects against hydroxyl-induced damages to DNA and MSCs via antioxidant mechanism: A chemistry study[J]. Journal of Saudi Chemical Society, 2015, 19: 454-460.
[18] TAN Dun-xian, HARDELAND R, MANCHESTER L, et al. Mechanistic and comparative studies of melatonin and classic antioxidants in terms of their interactions with the ABTS cation radical[J]. Journal of Pineal Research, 2003, 34: 249-259.
[19] LIN Jian, LI Xi-can, CHEN Li, et al. Protective effect against hydroxyl radical-induced DNA damage and antioxidant mechanism of [6]-gingerol: A chemical study[J]. Bulletin of the Korean Chemical Society, 2014, 6: 1 633-1 638.
[20] LI Xi-can, MAI Wen-qiong, CHEN Dong-feng, et al. Chemical study on protective effect against hydroxyl-induced DNA damage and antioxidant mechanism of myricitrin[J]. Journal of the Chinese Chemical Society, 2014, 61: 383-390.
[21] LIU Jing-jing, LI Xi-can, LIN Jian, et al. Sarcandra glabra (Caoshanhu) protects mesenchymal stem cells from oxidative stress: A bioevaluation and mechanistic chemistry[J]. BMC Complementary and Alternative Medicine, 2016, 16: 423.
[22] VALENT I, TOPOLSKD, VALACHOVK, et al. Kine-tics of ABTS derived radical cation scavenging by bucillamine, cysteine, and glutathione: Catalytic effect of Cu2+ions[J]. Biophysical Chemistry, 2016, 212: 9-16.

