右美托咪定在腸道手術中的麻醉效果評價
丁 璐,王金保,底 妍,呂英冰,張在旺
腸道是體內最大的儲菌庫和內毒素庫[1],當受到手術刺激時,腸道黏膜受損,產生各種活性因子,激活炎癥細胞,釋放炎性介質,可引起一系列炎癥反應[2]。因此,抑制腸道手術炎癥反應,可延長生存時間。右美托咪定是一種高選擇性的α2腎上腺素能受體激動劑,具有鎮靜、鎮痛、抗交感神經、抑制應激反應作用,且無明顯呼吸抑制,作為全麻輔助用藥廣泛應用于臨床[3]。文獻報道,右美托咪定可通過抑制炎性因子的釋放,減輕細胞凋亡,降低敗血癥發生率[4-5];但是否對腸道手術患者的炎癥反應有抑制作用尚未定論。本研究擬評價右美托咪定對腸道手術炎癥反應的抑制作用,為此類手術患者麻醉期間用藥提供參考。現報告如下。
1 資料與方法
1.1一般資料 選取2016年5月—2017年5月就診于承德醫學院擇期行腸道手術的患者60例為研究對象。納入標準:年齡20~65歲;體重指數(BMI)19~29 kg/m2;美國麻醉醫師協會(ASA)分級Ⅰ級或Ⅱ級;無長期服用鎮靜鎮痛類藥物史;無化療或放療史;無嚴重心血管、內分泌和免疫性疾病;無精神病病史和藥物過敏史,無輸血史;患者及家屬對本研究知情并簽署同意書。排除標準:妊娠或哺乳期婦女;在外院治療后轉入我院者。按麻醉用藥方法分為對照組和觀察組,每組30例。觀察組男20例,女10例;年齡31~55(44.45±15.67)歲;BMI 19.5~27.9(24.56±4.33)kg/m2;結腸癌13例,直腸癌11例,腸梗阻4例,腸穿孔2例;ASA分級:Ⅰ級10例,Ⅱ級20例。對照組男21例,女9例;年齡32~56(45.67±15.33)歲;BMI 19.9~28.2(25.45±5.33)kg/m2;結腸癌14例,直腸癌12例,腸梗阻3例,腸穿孔1例;ASA分級:Ⅰ級9例,Ⅱ級21例。兩組一般資料比較差異無統計學意義(P>0.05),具有可比性。本研究已獲醫院倫理委員會批準。
1.2麻醉方法 兩組術前6 h禁食,3 h禁水;入手術室后均行心電圖、血氧飽和度、心率、無創血壓和腦電雙頻譜指數(BIS)及有創動脈測壓監測。觀察組麻醉誘導前10 min靜脈輸注右美托咪定(江蘇恒瑞醫藥股份有限公司,國藥準字:170826BP)1 g/kg[6],后以0.4 g/kg·h靜脈輸注至術畢;對照組給予等容量生理鹽水。兩組給藥10 min后均行麻醉誘導:咪達唑侖(江蘇恩華藥業股份有限公司,國藥準字:H20031071)0.05 mg/kg、丙泊酚(B.Braun Melsungen AG,注冊證號:17044033)1.0~2.0 mg/kg、順式阿曲庫銨(上海東英藥業有限公司,國藥準字:H20060927)0.10~0.15 mg/kg、舒芬太尼(宜昌人福藥業有限責任公司,國藥準字:H20036899)0.3~0.4 μg/kg靜脈注射;經口氣管插管術后行機械通氣后,以瑞芬太尼(宜昌人福藥業有限責任公司,國藥準字:H20030197)0.1~0.2 μg/kg·min,丙泊酚3~5 mg/kg·h靜脈滴注行麻醉維持,間斷應用肌肉松弛藥物,維持BIS值在45~55;并按心率、血壓等指標的變化對用藥劑量實時調整,維持生命體征平穩[7]。
1.3觀察指標 ①兩組不同時間點的心率、平均動脈壓(MAP)和BIS值;②兩組呼吸恢復時間、拔管時間和術后躁動發生率;③兩組不同時間點血清炎癥因子濃度。
1.4檢測方法 ①兩組分別于給藥前(T0)、泵入右美托咪定10 min后(T1)、手術開始即刻(T2)、手術開始后30 min(T3)和手術結束即刻(T 4)時記錄心率、收縮壓(SBP)、舒張壓(DBP)和BIS值。計算公式MAP=1/3(SBP-DBP)+DBP。BIS值[8]評分:總分為100分,清醒狀態81~100分,輕中度鎮靜61~80分,中重度鎮靜41~60分,抑制≤40分。②于手術結束后記錄兩組呼吸恢復時間、拔管時間和術后躁動發生情況。③兩組分別于T0、T1、T2、T3、T4時抽取左橈動脈血2 ml,采用ELISA法測定血清白細胞介素(IL)-6、IL-8、IL-10、腫瘤壞死因子(TNF)-α濃度[9],比濁法檢測血清C反應蛋白(CRP )濃度[10],流式細胞法檢測CD11b濃度[9],試劑盒購自石家莊市裕華區華瑞實驗用品公司。
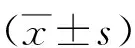
2 結果
2.1兩組不同時間點心率、MAP和BIS值比較 觀察組T1時心率低于T0時(P<0.05),對照組T2~T4時心率高于T0時(P<0.05),且觀察組T1~T4時心率均低于對照組(P<0.05)。兩組T2~T4時MAP低于T0時(P<0.05),觀察組T2~T4時MAP低于對照組(P<0.05);觀察組T1時BIS值低于T0時(P<0.05),兩組T2~T4時BIS值低于T0時(P<0.05),且觀察組T2~T4時BIS值低于對照組(P<0.05)。見表1。
2.2兩組呼吸恢復時間、拔管時間和術后躁動發生率比較 觀察組呼吸恢復時間、拔管時間和術后躁動的發生率均低于對照組(P<0.05)。見表2。
2.3兩組不同時間點血清炎癥因子濃度比較 兩組T2~4時IL-6、IL-8、IL-10、TNF-α、CRP、CD11b與T0時比較升高(P<0.05);觀察組T2~4時的IL-6、IL-8、TNF-α、CRP和CD11b與對照組比較降低(P<0.05),IL-10較對照組升高(P<0.05)。見表3。
3 討論
人體在創傷、麻醉、低血壓、缺血再灌注、嚴重感染等應激狀態下,可使腸黏膜受損、萎縮及屏障功能下降;腸道內細菌、內毒素經受損腸黏膜侵入腸道外組織,導致菌血癥或內毒素血癥[11]。腸黏膜損傷也可引起腸道菌群紊亂,導致細菌和內毒素進入血液循環,引發多器官功能障礙綜合征和衰竭[12-13]。因此,圍術期抑制腸道手術患者的炎癥反應為臨床研究的熱點和難點。
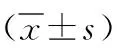
表1 兩組腸道手術不同時間點平均動脈壓、心率和腦電雙頻指數比較
注:觀察組給予右美托咪定,對照組給予等容量生理鹽水;T0為給藥前,T1為泵入右美托咪定10 min后,T2為手術開始即刻,T3為手術開始后30 min,T 4為手術結束即刻;與本組T0比較,aP<0.05;與對照組比較,cP<0.05
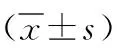
表2 兩組腸道手術呼吸恢復時間、拔管時間和術后躁動發生率比較
注:觀察組給予右美托咪定,對照組給予等容量生理鹽水
右美托咪定的消除半衰期為2 h,分布半衰期為6 min,起效時間大約15 min,其較短的分布半衰期使其成為一種理想的靜脈用藥[14]。本研究根據其藥代動力學特點選取了標本采集時間。右美托咪定對血流動力學作用與劑量、給藥速度存在正相關,快速予以負荷劑量(1 g/kg)則可引起血壓短暫性升高,反射性降低心率[15]。右美托咪定是一種α2腎上腺素能受體(ADRAR)激動劑,用藥初期可激動血管平滑肌上的該受體而收縮血管,升高血壓;繼而激動交感神經末梢突觸前膜的該受體,降低交感神經活性,抑制去甲腎上腺素(NE)釋放,減慢心率,減輕手術應激反應對血壓和心率的影響,確保血流動力學穩定[16]。右美托咪定還可通過脊髓后角突觸前膜ADRAR,促使細胞膜超極化,抑制疼痛信號向大腦中樞神經系統傳導,發揮較強的鎮痛作用,減輕應激反應,有利于血流動力學穩定[17]。本研究結果顯示,觀察組術中心率和MAP明顯低于對照組,且波動幅度小,說明術前給予右美托咪定可以穩定腸道手術患者的血流動力學,取得較好麻醉效果。
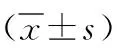
表3 兩組腸道手術不同時間點血清炎癥因子濃度比較
注:觀察組給予右美托咪定,對照組給予等容量生理鹽水;T0為給藥前,T1為泵入右美托咪定10 min后,T2為手術開始即刻,T3為手術開始后30 min,T 4為手術結束即刻;IL-6為白細胞介素-6,IL-8為白細胞介素-8,IL-10為白細胞介素-10,CRP為C反應蛋白,TNF-α為腫瘤壞死因子-α;與本組T0比較,aP<0.05;與對照組比較,cP<0.05
右美托咪定通過結合中樞、外周和自主神經系統中發現的G-蛋白偶聯的ADRAR,在全身各種重要器官和血管中發揮作用[18]。ADRAR有3種亞型:α2A,α2B和α2C。右美托咪定鎮靜作用的部位是藍斑,由NE神經元超極化介導,從而抑制NE釋放及抑制髓樣NE途徑的活性[19]。鎮痛作用主要通過α2C和α2A受體介導,通過抑制促進傷害性傳遞物質即P物質和谷氨酸的釋放和脊髓中間神經元的超極化作用,這些物質存在于第二層淺層背角的神經元中[20]。右美托咪定通過鎮靜和鎮痛作用能有效維持靜脈麻醉深度。BIS測定是目前評定鎮靜水平和麻醉深度的重要手段,當BIS在40~60分時能顯著降低術中知曉發生,具有較高可信度[21]。本研究結果表明,觀察組術中BIS值明顯低于對照組,且波動幅度小,說明術前給予右美托咪定可維持穩定麻醉深度,效果滿意。
本研究結果顯示,觀察組呼吸恢復時間、拔管時間和術后躁動的發生率明顯低于對照組,與Jiang等研究結果一致[22],認為右美托咪定的抗交感特性能減輕應激反應,使患者早脫機、早拔管,這對于重癥監護具有重要意義
右美托咪定可激動中樞神經及外周的ADRAR,降低交感神經活性及血漿兒茶酚胺濃度,減輕圍術期應激反應[23]。本研究結果顯示,觀察組IL-6、IL-8、TNF-α、CRP和CD11b濃度低于對照組,血清抑炎因子(IL-10)濃度高于對照組,說明術前給予右美托咪定可以抑制腸道手術的炎癥反應。
綜上所述,麻醉誘導前10 min靜脈輸注負荷劑量右美托咪定1 g/kg,隨后以0.4 g/kg·h速率靜脈輸注至術畢,對腸道手術患者術中血流動力學影響小,有利于患者術后蘇醒,減少其術后躁動,并抑制患者的炎癥反應。
[]
[1] 李秋榮.腸屏障損傷與腸源性感染[J].腸外與腸內營養,2017,24(2):65-67.
[2] Hurley J C, Nowak P, ?hrmalm L,etal. Endotoxemia as a Diagnostic Tool for Patients with Suspected Bacteremia Caused by Gram-Negative Organisms: a Meta-Analysis of 4 Decades of Studies[J].J Clin Microbiol, 2015,53(4):1183-1191.
[3] Weerink Mas, Struys Mmrf, Hannivoort L N,etal. Clinical Pharmacokinetics and Pharmacodynamics of Dexmedetomidine[J].Clin Pharmacokinet, 2017,56(8):893-913.
[4] Zeng X, Wang H, Xing X,etal. Dexmedetomidine Protects against Transient Global Cerebral Ischemia/Reperfusion Induced Oxidative Stress and Inflammation in Diabetic Rats[J].PLoS One, 2016,11(3):e0151620.
[5] Li B, Li Y, Tian S,etal. Anti-inflammatory Effects of Perioperative Dexmedetomidine Administered as an Adjunct to General Anesthesia: A Meta-analysis[J]. Sci Rep, 2015,5:123-142.
[6] 吳凡,梁濤,韋玄,等.不同劑量右美托咪定輔助硬膜外麻醉對老年直腸癌患者術后認知功能的影響[J].中國醫藥,2014,9(3):354-357.
[7] 唐安山.右美托咪定對食管癌根治術中瑞芬太尼復合丙泊酚用量和麻醉效果的影響[J].河北醫藥,2016,22(9):1446-1449.
[8] 張莉.早期BIS監測對膿毒癥相關性腦病的評估價值[J].中國急救醫學,2015,35(11):982-985.
[9] 陽毅,蒙煒.腸道屏障功能障礙:治療急性Stanford A型主動脈夾層全身炎性反應的新靶點[J].成都醫學院學報,2016,11(1):1-4.
[10] 王麗,林涵淼,邢珍,等.右美托咪定超前鎮痛對體外循環下行心臟瓣膜置換術患者肺炎性反應的影響[J].山東醫藥,2017,57(28):57-59.
[11] Zhou X, Zhang Z, Li J1,etal. Major contraindication to the endotoxemia activity assay in septic shock patients[J].J Crit Care, 2017,pii: S0883-9441(17):31263-31267.
[12] Krezalek M A,Skowron K B,Guyton K L,etal. The Intestinal Microbiome and Surgical Disease[J].Curr Probl Surg, 2016,53(6):257-293.
[13] 張睿,何桂珍.腸淋巴途徑與細菌移位[J].中華消化外科雜志,2011,10(6):479-480.
[14] Smuszkiewicz P, Wiczling P, Ber J,etal. Pharmacokinetics of dexmedetomidine during analgosedation in ICU patients[J]. J Pharmacokinet Pharmacodyn,2017, 45(2):277-284.
[15] 趙立紅,尹寧寧,李倩,等.右美托咪定對開顱術后延遲拔管患者應激性激素和血流動力學的影響[J].首都醫科大學學報,2015,(6):964-968..
[16] 陳坤明,焦相學.鹽酸右美托咪定對老年椎管內麻醉手術患者術中應激反應的影響研究[J].河北醫藥,2016,38(13):1957-1959.
[17] Vora K S, Baranda U, Shah V R,etal. The effects of dexmedetomidine on attenuation of hemodynamic changes and there effects as adjuvant in anesthesia during laparoscopic surgeries[J].Saudi J Anaesth, 2015,9(4):386-392.
[18] 王平,徐暉.右美托咪定的藥物相互作用[J].國際麻醉學與復蘇雜志,2016,37(6):551-554,576.
[19] Roosens E, Mulier J P, Heylens G,etal. The use of dexmedetomidine in extreme agitation[J].Tijdschr Psychiatr, 2017,59(9):554-558.
[20] Bisui B, Samanta S, Ghoshmaulik S,etal. Effect of Locally Administered Dexmedetomidine as Adjuvant to Levobupivacaine in Supraclavicular Brachial Plexus Block: Double-blind Controlled Study[J].Anesth Essays Res, 2017,11(4):981-986.
[21] Frost E A. Differential diagnosis of delayed awakening from general anesthesia: a review[J]. Middle East J Anaesthesiol, 2014,22(6):537-548.
[22] Jiang L, Hu M, Lu Y,etal. The protective effects of dexmedetomidine on ischemic brain injury: A meta-analysis[J].J Clin Anesth, 2017,40:25-32.
[23] Farghaly H S, Mahmoud A M, Abdel-Sater K A. Effect of dexmedetomidine and cold stress in a rat model of neuropathic pain: Role of interleukin-6 and tumor necrosis factor-α[J]. Eur J Pharmacol, 2016,776:139-145.

