基于Miseq高通量測序技術的辣椒醬核心細菌類群研究
沈馨,王艷,代凱文,尚雪嬌,董蘊,郭壯,*
(1.湖北文理學院化學工程與食品科學學院鄂西北傳統發酵食品研究所,湖北襄陽441053;2.當陽市婦幼保健院 檢驗科,湖北宜昌444100;3.當陽市食品藥品監督管理局,湖北宜昌444100)
辣椒醬是以破碎的鮮辣椒或干辣椒為原料,經發酵或非發酵加工制作而成的一種調味品,因具有促進食欲和健脾開胃的功效而深受消費者喜愛[1]。傳統的辣椒醬主要依靠辣椒自帶或環境中的乳酸菌自然發酵而成,制作工藝相對簡單,發酵周期也較長[2]。眾所周知,傳統發酵食品制作環境相對開放,基質中微生物的多樣性亦相對較高,不僅蘊含對產品品質形成具有積極意義或具有潛在益生特性的菌株,亦可能含有一些致病菌或條件致病菌[3]。然而令人遺憾的是,目前關于辣椒醬細菌微生物多樣性研究的報道尚少。
近年來以Miseq為代表的第二代高通量測序技術,采用宏基因組學的研究策略,不僅全面揭示了傳統發酵食品中微生物的群落結構,同時亦實現了微生物多樣性與產品品質的關聯分析[4],目前在葡萄酒[5]、臘腸[6]、泡菜[7]和窖泥[8]等微生物多樣性研究中有了廣泛的應用,這為解析辣椒醬中細菌微生物的多樣性提供了新的技術手段。作為產品品質的重要組成部分,滋味品質直接決定了消費者對辣椒醬產品的喜好程度。相對于感官鑒評方法,電子舌技術實現了醬類制品中酸、苦、澀、鮮和咸5個基本味及苦、澀和鮮味3個基本味回味的數字化評價,具有對試驗人員專業技能要求低且受外界影響小的優點[9]。
在采用Miseq高通量測序技術對辣椒醬中細菌微生物多樣性進行揭示的基礎上,本研究進一步使用電子舌這一仿生設備對產品的滋味品質進行了評價,同時探討了核心細菌類群對辣椒醬品質的影響,以期為后續辣椒醬中優勢菌株的分離及產品的產業化生產提供理論指導。
1 材料與方法
1.1 材料與試劑
樣品采集:從湖北省當陽市草埠湖鎮和玉泉辦事處的6個農戶家中,各采集1個自制辣椒醬樣品,每個樣品分別采集200 g左右,置于含有冰袋的采樣箱中進行DNA提取。
5×TransStartTM FastPfu Buffer、dNTPs Mix、FastPfu Fly DNA Polymerase:北京全式金生物技術有限公司;E.Z.N.A.?Soil DNA Kit試劑盒:美國OMEGA公司;陰離子溶液、陽離子溶液、味覺標準溶液、內部溶液和參比溶液:日本Insent公司。
1.2 儀器與設備
5810R臺式高速冷凍離心機:德國Eppendorf公司;ND-2000C微量紫外分光光度計:美國Nano Drop公司;DYY-12電泳儀:北京六一儀器廠;UVPCDS8000凝膠成像分析系統:美國BIO-R AD公司;vetiri梯度基因擴增儀:美國AB公司;Miseq高通量測序平臺:美國Illumina公司;R 920機架式服務器:美國DELL公司;SA 402B電子舌(配備 AAE、CT0、CA0、AE1和 C00測試傳感器):日本Insent公司。
1.3 試驗方法
1.3.1 DNA提取
取10 g辣椒醬加入40 mL蒸餾水,300 r/min離心10 min后取上清,繼而10 000 r/min離心10 min后取沉淀,采用E.Z.N.A.?Soil DNA Kit試劑盒進行微生物宏基因組DNA提取。
1.3.2 細菌16S rR NA序列V4-V5區擴增及擴增體系
DNA模板10 ng,5 μmol/L正向和反向引物各0.8 μL,5U/μLDNA 聚合酶0.4μL,2.5mmol/LdNTPsmix 2μL,5×PCR緩沖液4μL,體系用 ddH2O 補充至 20 μL。其中:正向引物為338F(5'-ACTCCTACGGGAGGCAGCA-3'), 反 向 引 物 為 806R(5'-GGACTACHVGGGTWTCTAAT-3'),在正向引物前端加入7個核苷酸標簽(barcode),以便進行生物信息學分析時將序列劃分到各個樣品。擴增條件:95℃變性3 min;95℃變性 30 s,55℃退火 30 s,72℃延伸 45 s,35個循環;72℃延伸10 min。
1.3.3 高通量測序及序列質控
PCR產物置于干冰中冷鏈寄往上海美吉生物醫藥科技有限公司,使用Miseq高通量測序平臺進行測序。數據下機后,首先將雙端序列拼接成一條序列,繼而根據barcode信息將拼接好的序列劃分到各樣品并進行序列方向校正,然后去除序列中的barcode和引物,最后將6個樣品的序列歸并為1個fna文件進行后續生物信息學分析。值得一提的是,若在拼接過程中成對序列的重疊區小于10 bp或最大錯配比率大于0.2、有barcode堿基錯配或引物堿基錯配數大于2 bp及切除barcode和引物后序列長度小于50 bp,則相對應的序列均予以剔除。
1.3.4 生物信息學分析
將質控后的序列文件導入QIIME(v1.7.0)[10]進行分析,首先調用PyNAST[11]軟件將所有序列對齊;其次采用UCLUST算法[12]進行序列劃分并建立分類操作單元(Operational taxonomic units,OTU),若某一 OTU 在所有樣品中均存在則將其定義為核心OTU;然后使用ChimeraSlayer[13]進行嵌合體去除;繼而挑選OTU中的代表性序列同時使用R DP(ribosomal database project,R elease 11.5)[14]和 Greengenes(R elease 13.8)[15]數據庫明確OTU分類學地位,若某一門或屬在所有樣品中均存在,則將其定義為核心門或屬;接著使用FastTree軟件[16]繪制代表性序列系統發育進化樹,并在此基礎上計算α多樣性指數—香農指數(Shannon index)、超1指數(Chao1 index)和發現物種數,進而繪制稀疏曲線圖和香農指數曲線。
1.3.5 核酸登錄號
本研究中所有Miseq高通量測序數據均已提交至MG-RAST數據庫,ID號為mgp336604。
1.3.6 辣椒醬樣品的滋味品質分析
取20.0 g辣椒醬用180 mL蒸餾水4℃浸泡過夜后,3 000 r/min離心10 min后取上清備用。傳感器活化、清洗后,首先在參比溶液中測得電勢值Vr;其次在樣品中測得電勢 Vs,C00、AE1、CA0、CT0 和 AAE 5 個傳感器對應的Vs-Vr值即為樣品酸、苦、澀、咸和鮮味等5個基本味的相對強度值;再次洗滌后,C00、AE1和AAE 3個傳感器分別在參比溶液中測得電勢Vr’,Vr’-Vr值為辣椒醬后味A(澀的回味)、后味B(苦的回味)和豐度(鮮的回味)的相對強度值。
1.3.7 數據統計學分析
使用皮爾森相關性分析法(Pearson correlation analysis)計算核心細菌類群和各滋味指標相對強度之間的相關系數,并選取相關系數絕對值大于0.5的指標,使用Cytoscape軟件(v3.5.1)進行網絡圖繪制。采用Mega5.0軟件繪制核心OTU系統發育樹;其他圖均由Origin 8.6軟件繪制。進行滋味品質分析時,每個辣椒醬樣品重復測定4次,選后3次納入數據分析。
2 結果與分析
2.1 序列豐富度和多樣性分析
納入本研究的6個辣椒醬樣品16s rRNA V4-V5區序列測序情況及各分類地位數量如表1所示。
由表1可知,本研究共有225 830條高質量16srRNA序列通過質控,平均每個樣品產出37 638條序列。本研究分別采用100%和97.0%相似性進行兩步UCLUST劃分,共得到74 179條代表性序列和4 709個OTU,在采用ChimeraSlayer進行嵌合體檢查時,去除了11個OTU,因而每個樣品平均有1 398個OTU。由表1亦可知,在6個辣椒醬樣品中LJ3的Chao 1指數最高同時Shannon指數最大,由此可見,LJ3樣品中細菌微生物的豐富度最大多樣性亦最高。本研究進一步繪制了隨著測序深度的加深,發現物種數指數和Shannon指數的變化曲線,進而對本研究的測序深度是否滿足后續生物信息學分析要求進行了評估,其結果如圖1所示。
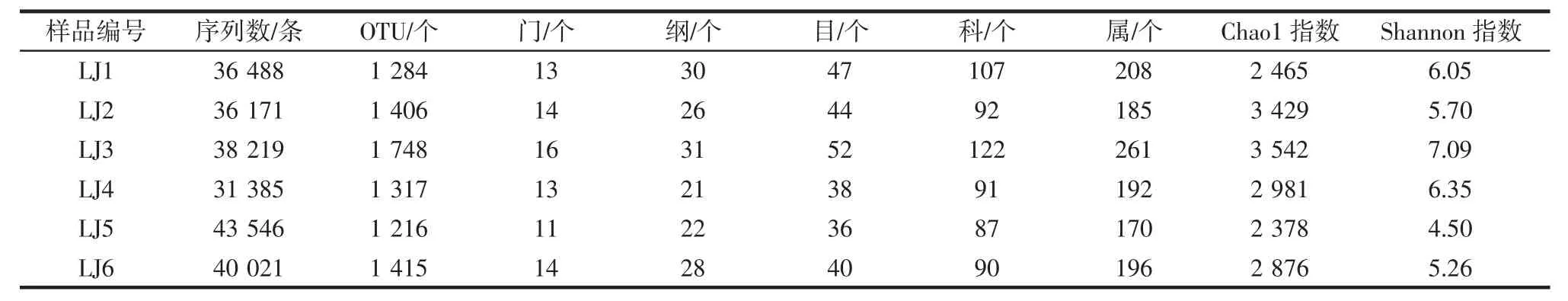
表1 樣品16s rRNA測序情況及各分類地位數量Table 1 16s rRNA read counts and number of identifiable units at different taxonomical levels
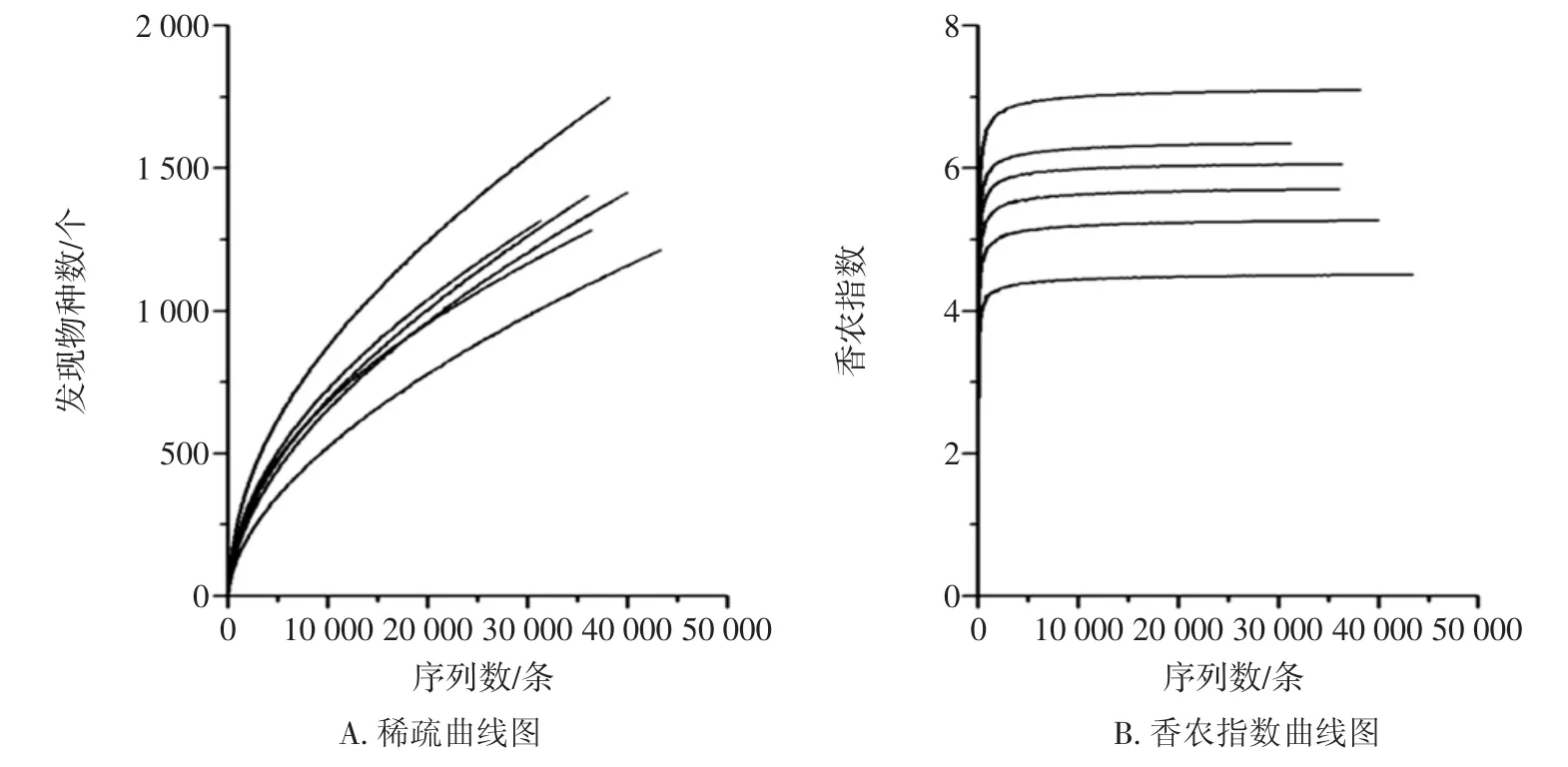
圖1 稀疏曲線和香農指數曲線圖Fig.1 Rarefaction analysis and shannon diversity estimates of the high throughput sequencing
由圖1(A)可知,即使達到本研究單個樣品的最大測序深度43 546條,稀疏曲線亦未進入平臺期,這說明隨著測序深度的增大,辣椒醬中依舊會有新的細菌種系型被發現。然而由圖1(B)可知,在測序深度達到2 000條左右時,所有的香農指數曲線已經進入了平臺期,這說明隨著測序量的增加雖然新的種系型會被發現,但細菌微生物的多樣性不會再隨之發生變化了,因而本研究的測序深度是可以滿足后續分析要求的。
2.2 基于各分類學地位辣椒醬細菌相對含量的分析
在對序列豐富度和多樣性分析的基礎上,本研究進一步對質控合格后的序列進行了鑒定,所有的序列鑒定為19個門、46個綱、65個目、160個科和387個屬,其中僅有0.056%和7.70%的序列不能鑒定到門和屬水平。因本研究僅采集了6個辣椒醬樣品,存在樣本量不足的缺陷,為了彌補這一不足同時減少樣品間差異性對分析結果造成的影響,本研究僅對平均相對含量大于1.0%的核心細菌門、屬和OTU進行了分析。辣椒醬樣品中相對含量大于1.0%的核心細菌門構成如圖2所示。

圖2 辣椒醬樣品中相對含量大于1.0%的核心細菌門Fig.2 Comparative analysis on the content of core bacterial phyla with relative abundance more than 1.0%in chilli sauce samples
由圖2可知,在門水平上,辣椒醬樣品中的細菌類群主要隸屬于硬壁菌門(Firmicutes)、變形菌門(Proteobacteria)和放線菌門(Actinobacteria),其平均相對含量分別為66.73%、22.79%和9.75%。辣椒醬樣品中相對含量大于1.0%的核心細菌屬構成如圖3所示。
由圖3可知,辣椒醬中平均相對含量大于1.0%的核心細菌屬包括隸屬于硬壁菌門(Firmicutes)的芽孢桿菌(Bacillus)、葡萄球菌(Staphylococcus)、梭菌(Clostridium)、魏斯氏菌(Weissella)和乳酸桿菌(Lactobacillus),其平均相對含量分別為37.62%、20.66%、2.5%、1.37%和1.09%;隸屬于變形菌門(Proteobacteria)的克雷白氏桿菌(Klebsiella)、腸桿菌屬(Enterobacter)和布丘氏菌屬(Buttiauxella),其平均相對含量分別為6.87%、1.18%和1.08%;以及隸屬于放線菌門(Actinobacteria)的棒狀桿菌(Corynebacterium),其平均相對含量為5.96%。
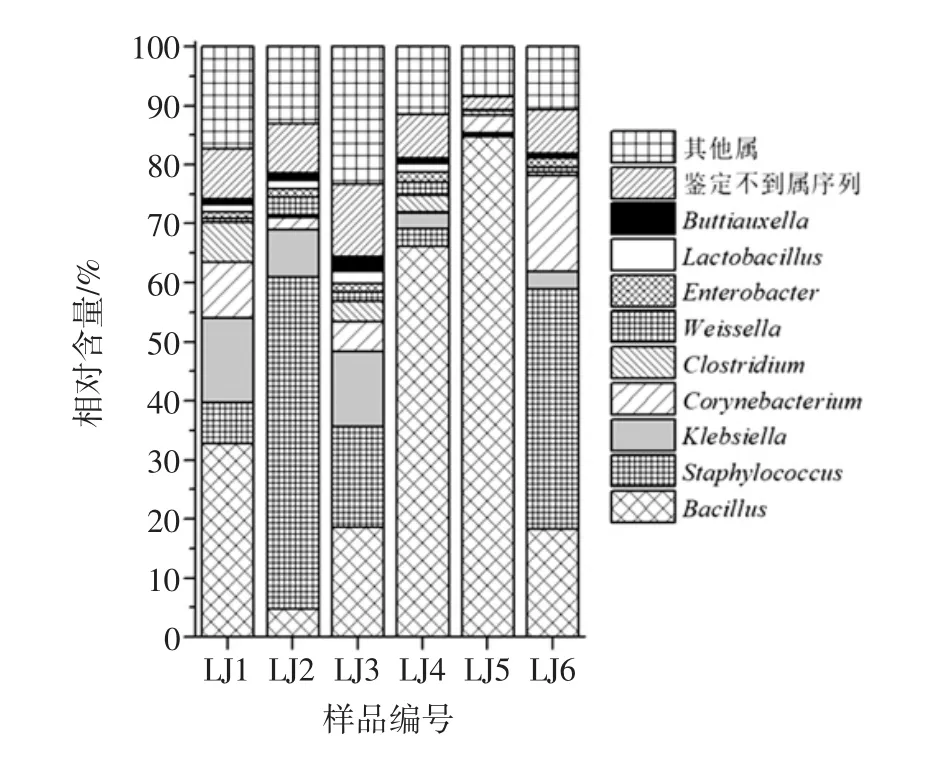
圖3 辣椒醬樣品中相對含量大于1.0%的核心細菌屬Fig.3 Comparative analysis on the content of core bacterial genera with relative abundance more than1.0%in chilli sauce samples
辣椒醬樣品中含有隸屬于乳桿菌目(Lactobacillales)的魏斯氏菌(Weissella)和乳酸桿菌(Lactobacillus),其平均含量分別為1.37%和1.09%。兩者均為乳酸菌,通過產生有機酸,同時生成醇、醛和酮等多種風味物質,對發酵食品的滋味和風味品質具有積極的影響[17]。此外,本研究發現辣椒醬中存在37.62%的芽孢桿菌(Bacillus),究其原因可能與辣椒醬中食鹽含量較高有關而芽孢桿菌具有較好的耐受性。值得一提的是,芽孢桿菌亦為細菌型豆豉中的優勢菌,對豆豉風味品質的形成具有積極的意義[18]。
從農戶家中采集的辣椒醬樣品含有大量的克雷白氏桿菌(Klebsiella)、腸桿菌(Enterobacter)、葡萄球菌(Staphylococcus)和梭菌(Clostridium),其累計平均含量達到了細菌序列總數的30.08%。隸屬于上述4個屬的部分細菌種為條件致病菌,例如作為克雷白氏桿菌(Klebsiella)中常見的種肺炎克雷伯氏菌(K.peneumoniae)是重要的醫源性感染菌之一[19],隸屬于腸桿菌屬(Enterobacter)的阪崎腸桿菌(E.Sakazakii)能引起新生兒腦膜炎和敗血癥[20],葡萄球菌(Staphylococcus)中的金黃色葡萄球菌(S.aureus)是人類化膿感染中最常見的病原菌[21],梭菌屬(Clostridium)中的致病性菌種可引起梭菌病這一人畜共患病[22]。由此可見,農家自制的辣椒醬樣品中存在大量的條件致病菌,具有一定的食品安全隱患,其與產品制作環境開放且發酵周期長有關,因而在后續研究中從辣椒醬中分離、純化、鑒定并篩選出具有優良發酵特性的優勢菌株用于產品的生產,無論是對實現辣椒醬的產業化生產,還是減少食品安全隱患均具有積極的意義。本研究亦發現辣椒醬中存在1%左右的布丘氏菌屬細菌,有報道指出隸屬于該菌屬的細菌為草魚肉冷藏過程中的優勢腐敗菌[23]。值得一提的是,本研究發現辣椒醬樣品中存在5.96%的隸屬于棒狀桿菌(Corynebacterium)的細菌,該屬中的谷氨酸棒狀桿菌(C.glutamicum)可在微生物發酵工程生產谷氨酸來制取味精[24],而同樣是隸屬該屬的白喉桿菌(C.diphtheriae)卻是引起小兒白喉的病原菌[25]。令人遺憾的是,由于Miseq測序長度較短,無法完成16s rRNA全長測序,因而僅能將序列鑒定到屬水平,在后續研究中采用單分子實時(single molecule real-time,SMRT)測序技術[26]或使用選擇性培養基對棒狀桿菌屬的細菌進行分離鑒定,進而進一步在種水平上對細菌的種系型進行確定是極為必要的。
本研究進一步統計了4 698個OTU在6個辣椒醬樣品中出現的次數,其結果如圖4所示。
由圖4可知,雖然核心OTU有271個,僅占OTU總數的5.77%,但其包含了196 955條序列,占所有質控后合格序列數的87.21%。此外,在6個樣品中出現5、4、3、2 次的 OTU 各有 176、183、279、522 個,分別占OTU總數的6.23%、1.96%、1.38%和1.34%,4類OTU共包含24 634條序列,占所有質控后合格序列數的10.91%。雖然在6個樣品中僅出現1次的OTU多達4 241個,占到OTU總數的69.54%,但其僅包含4 241條序列,平均每個OTU包含1.3條序列。由此可見,在OTU水平上,6個辣椒醬樣品亦共有大量的細菌類群,其累計平均相對含量達到87%以上。本研究進一步對271個核心OTU進行了分析,發現有14個OTU的平均相對含量大于1.0%,相對含量大于1.0%核心OTU在各辣椒醬樣品中相對含量的熱圖如圖5所示。
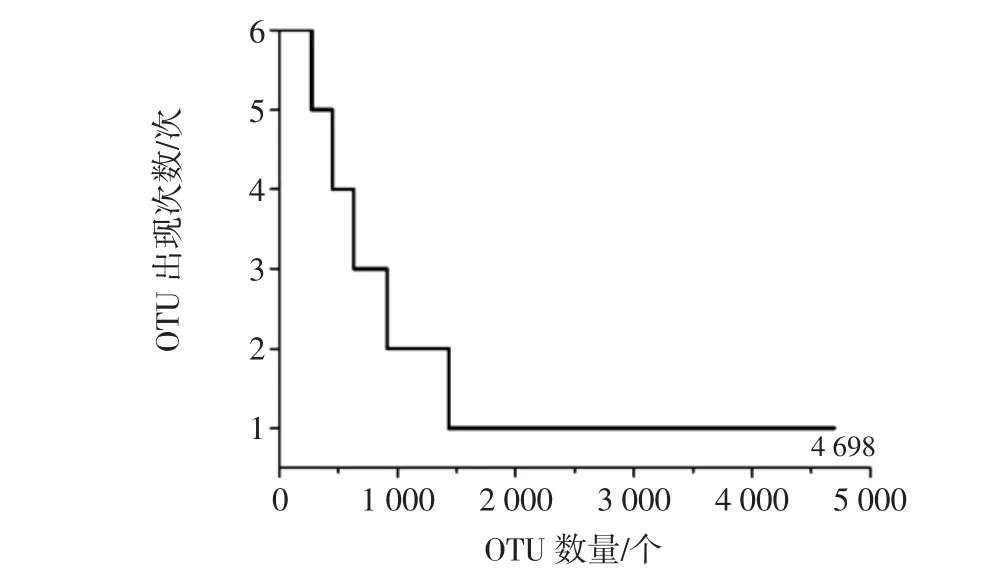
圖4 OTU在6個樣品中出現次數統計Fig.4 Distribution of OTU as a function of their prevalence in 6 samples
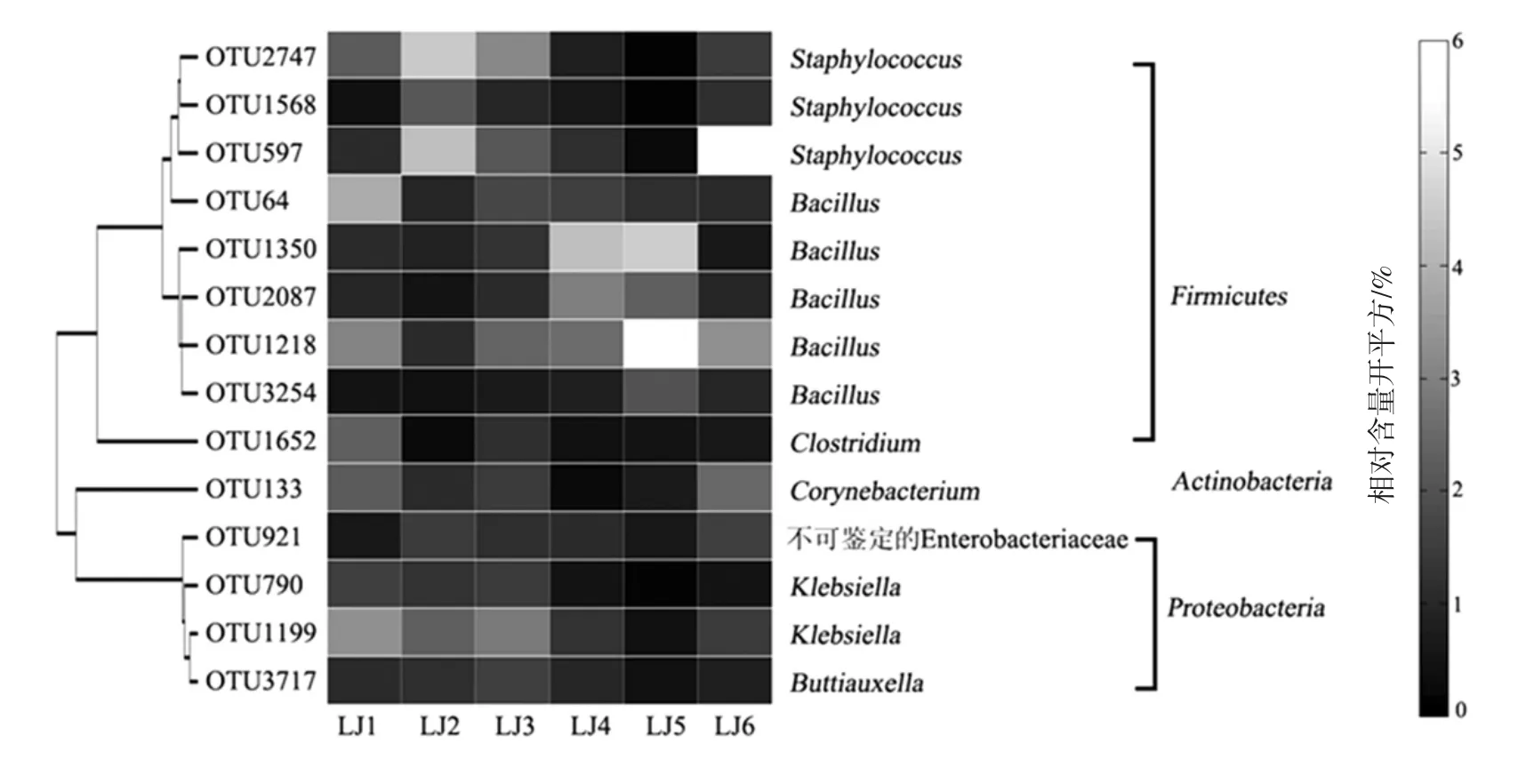
圖5 平均相對含量大于1.0%核心OTU在各辣椒醬樣品中相對含量的熱圖Fig.5 Heat map of the contents of core OTUs among chilli sauce samples
由圖5可知,本研究甄別出的14個核心OTU中3個隸屬于葡萄球菌(Staphylococcus),5個隸屬于芽孢桿菌(Bacillus)、2個隸屬于克雷白氏桿菌(Klebsiella),各有1個隸屬于梭菌(Clostridium)、棒狀桿菌(Corynebacterium)、布丘氏菌屬(Buttiauxella)和腸桿菌科(Enterobacteriaceae)。此外,14個核心OTU累計平均相對含量達到55.29%,尤其是OTU1218(隸屬于芽孢桿菌)、OTU597(隸屬于葡萄球菌)、OTU1350(隸屬于芽孢桿菌)和OTU2747(隸屬于葡萄球菌),其平均含量含量為11.41%、9.49%、7.03%和6.25%。值得一提的是,各核心OTU在樣品中的分布也存在較大的差異,例如OTU1350(隸屬于芽孢桿菌)在LJ4和LJ5中的相對含量分別為18.16%和20.21%,但在其他樣品中的相對含量均小于2.0%,OTU64(隸屬于芽孢桿菌)在LJ1中的相對含量達到15.40%,但在其他5個樣品中的相對含量均小于3.0%。由此可見,雖然存在于所有樣品中,但核心OTU在各樣品中的平均含量差異是較大的。平均相對含量大于1.0%核心OTU相關性的熱圖如圖6所示。

圖6 平均相對含量大于1.0%核心OTU相關性的熱圖Fig.6 Heat map of correlation among the core OTUs with relative abundance more than 1.0%
由圖6可知,OTU2747(隸屬于葡萄球菌屬)與OTU1568(隸屬于葡萄球菌屬)呈顯著正相關(R=0.905,P<0.05);OTU597(隸屬于葡萄球菌屬)與 OTU921(隸屬于腸桿菌科)呈顯著正相關(R=0.892,P<0.05);OTU1199(隸屬于克雷白氏桿菌屬)與OTU790(隸屬于克雷白氏桿菌屬)呈極顯著正相關(R=0.979,P<0.001),與OTU1652(隸屬于梭菌屬)呈顯著正相關(R=0.818,P<0.001);OTU64(隸屬于芽孢桿菌屬)與 OTU1652(隸屬于梭菌屬)呈極顯著正相關(R=0.989,P<0.001);OTU2087(隸屬于芽孢桿菌屬)與 OTU1350(隸屬于芽孢桿菌屬)呈非常顯著正相關(R=0.931,P<0.01);OTU3254(隸屬于芽孢桿菌屬)與 OTU1218(隸屬于芽孢桿菌屬)呈極顯著正相關(R=0.977,P<0.001)。由此可見,葡萄球菌可以促使芽孢桿菌和一些腸桿菌科細菌的增長。
2.3 辣椒醬核心細菌類群與滋味品質的關聯性分析
在對6個辣椒醬樣品核心細菌類群進行解析的基礎上,本研究進一步對樣品滋味品質的差異性進行了評價,同時通過構建核心細菌類群與滋味品質相關性的網絡圖,探討了核心細菌類群對鲊廣椒滋味品質的影響。辣椒醬各滋味指標相對強度值的箱形圖如圖7所示。
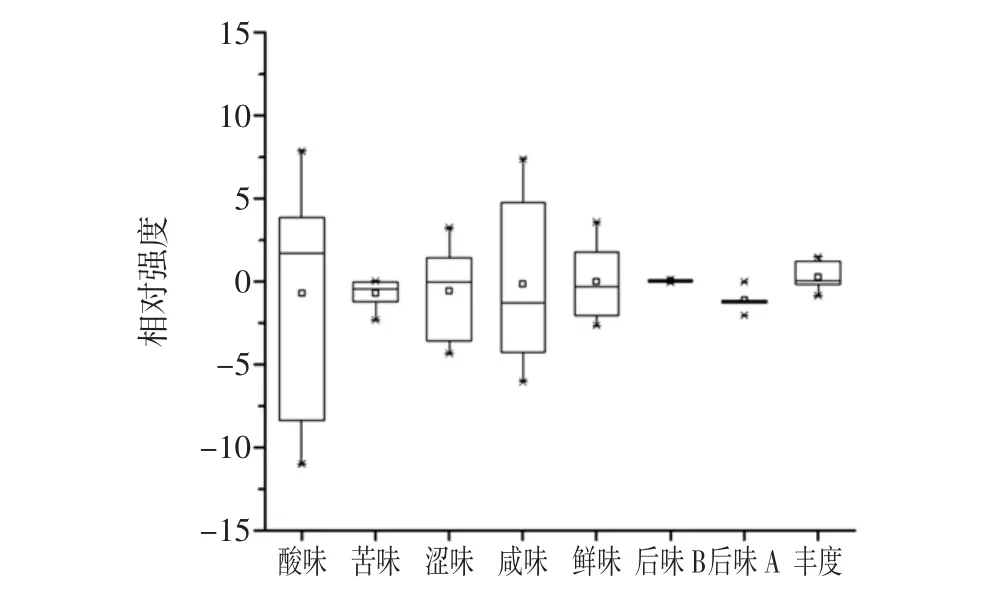
圖7 辣椒醬各滋味指標相對強度值的箱形圖Fig.7 The box plot of relative intensity of each taste index in chilli sauce samples
由圖7可知,納入本研究的辣椒醬樣品在酸味、咸味、澀味和鮮味上的差異較大,其極差值分別為18.85、13.41、7.56和6.22,而在后味A(澀的后味)和后味B(苦的回味)指標上的差異性較小,極差值僅為0.16和2.02。辣椒醬樣品在酸味上差異比較大的原因可能與樣品中含有2.46%的乳酸菌有關,而鮮味差異比較大的原因可能與樣品中含有棒狀桿菌有關,該屬的部分細菌可以產生谷氨酸等鮮味呈味物質。本研究進一步對辣椒醬核心細菌類群和滋味物質的相關性進行了計算,其結果如圖8所示。
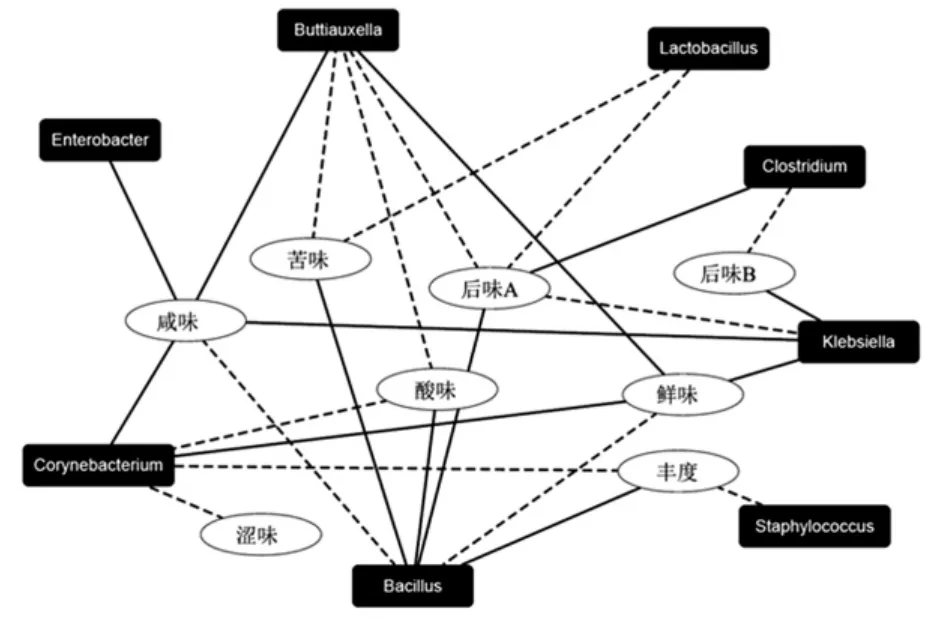
圖8 辣椒醬核心細菌類群和滋味指標相關性的網絡圖Fig.8 Correlation network diagram of core bacterial microflora and taste indexes among chilli sauce samples
由圖8可知,相對于乳酸桿菌(Lactobacillus)、梭菌(Clostridium)、葡萄球菌(Staphylococcus)和腸桿菌屬(Enterobacter)的核心細菌類群,芽孢桿菌(Bacillus)、魏斯氏菌(Weissella)、克雷白氏桿菌(Klebsiella)、布丘氏菌屬(Buttiauxella)和棒狀桿菌(Corynebacterium)對辣椒醬的滋味品質影響可能相對更大。由圖8亦可知,棒狀桿菌(Corynebacterium)、克雷白氏桿菌(Klebsiella)和布丘氏菌屬(Buttiauxella)的相對含量與辣椒醬的鮮味呈現正相關。本研究亦發現芽孢桿菌(Bacillus)與酸味呈現正相關,這可能與部分芽孢桿菌具有產酸特性有關[27],而乳酸桿菌(Lactobacillus)與酸味的相關性較弱。
3 結論
辣椒醬中的核心細菌類群主要由隸屬于硬壁菌門(Firmicutes)的芽孢桿菌(Bacillus)和葡萄球菌(Staphylococcus)構成,酸味是辣椒醬樣品間差異最大的滋味指標,微生物構成對辣椒醬滋味品質的形成具有較大的影響。
[1]郭琳,孟夢,郭淼,等.接種乳酸菌改善辣椒醬風味的研究[J].中國調味品,2016,41(5):1-7
[2]白露露,胡文忠,姜愛麗,等.辣椒加工工藝及其設備的應用現狀[J].食品工業科技,2014,35(15):369-372
[3]Gracias K S,Mckillip J L.A review of conventional detection and enumeration methods for pathogenic bacteria in food[J].Canadian journal of microbiology,2004,50(11):883-890
[4]Cocolin L,Alessandria V,Dolci P,et al.Culture independent methods to assess the diversity and dynamics of microbiota during food fermentation[J].International journal of food microbiology,2013,167(1):29-43
[5]Boynton P J,GREIG D.Fungal diversity and ecosystem function data from wine fermentation vats and microcosms[J].Data in brief,2016,8(12):225-229
[6]Justyna P,Annalisa R,Vincenza P,et al.Bacterial diversity in typical Italian salami at different ripening stages as revealed by highthroughput of 16s rDNA amplicons[J].Food microbiology,2015,46(4):342-356
[7]Yang H,Wu H,Gao L,et al.Effects of Lactobacillus curvatus and Leuconostoc mesenteroides on Suan Cai Fermentation in Northeast China[J].Journal of microbiology and biotechnology,2016,26(12):2148-2158
[8]Hu X,Du H,Ren C,et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Applied and environmental microbiology,2016,82(8):2506-2515
[9]Winquist F,Wide P,Lundstr?m I.An electronic tongue based on voltammetry[J].Analytica chimica acta,1997,357(1):21-31
[10]Caporaso J G,Kuczynski J,Stombaugh J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature methods,2010,7(5):335-336
[11]Caporaso J G,Bittinger K,Bushman F D,et al.PyNAST:a flexible tool for aligning sequences to a template alignment[J].Bioinformatics,2010,26(2):266-267
[12]Edgar R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2460-2461
[13]Haas B J,Gevers D,EARL A M,et al.Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J].Genome research,2011,21(3):494-504
[14]Cole J R,Chai B,Farris R J,et al.The ribosomal database project(RDP-II):introducing myRDP space and quality controlled public data[J].Nucleic acids research,2007,35(1):169-172
[15]Desantis T Z,Hugenholtz P,Larsen N,et al.Greengenes,a chimerachecked 16S rRNA gene database and workbench compatible with ARB[J].Appliedandenvironmentalmicrobiology,2006,72(7):5069-5072
[16]Price M N,Dehal P S,Arkin A P.Fasttree:computing large minimum evolution trees with profiles instead of a distance matrix[J].Molecular biology and evolution,2009,26(7):1641-1650
[17]劉畢琴,蘆夏霏,柳陳堅,等.乳酸菌貢獻細菌型豆豉風味的研究進展[J].核農學報,2016,30(1):136-144
[18]蘇悟,鄭小芬,徐睿烜,等.1種細菌型豆豉自然發酵過程中生物胺的變化[J].食品與發酵工業,2014,40(7):40-45
[19]Tong S Y C,Davis J S,Eichenberger E,et al.Staphylococcus aureus infections:epidemiology,pathophysiology,clinical manifestations,and management[J].Clinical microbiology reviews,2015,28(3):603-661
[20]Hu X,Dou W,Fu L,et al.A disposable immunosensor for Enterobacter sakazakii based on an electrochemically reduced graphene oxide-modified electrode[J].Analytical biochemistry,2013,434(2):218-220
[21]陳文秀,姜旋,馬曉燕,等.實時熒光環介導等溫擴增技術檢測乳粉中的肺炎克雷伯氏菌[J].食品科學,2014,35(20):192-197
[22]Hosie B D.Clostridial disease in domestic and wild animals[J].Veterinary record,2017,180(14):360-360
[23]王發祥,王滿生,劉永樂,等.低溫貯藏下草魚肉優勢腐敗菌鑒定及其消長規律[J].食品與發酵工業,2012,38(2):66-68
[24]張成林,龍輝,溫冰,等.雙底物指數流加和雙階段溶氧控制對谷氨酸棒狀桿菌生產L-異亮氨酸的影響[J].食品與發酵工業,2014,40(4):1-6
[25]Efstratiou A,George R C.Laboratory guidelines for the diagnosis of infections caused by Corynebacterium diphtheriae and C ulcerans[J].Communicable disease and public health,1999,2(4):250-257
[26]Mccarthy A.Third generation DNA sequencing:pacific biosciences'single molecule real time technology[J].Chemistry&biology,2010,17(7):675-676
[27]于華,黃丹,陳卓,等.四川麩醋醋醅中產酸芽孢桿菌的分離及發酵特性研究[J].中國食品添加劑,2017,24(1):83-90

