大豆11S球蛋白熱力學特性和溶液性質與表面疏水性關系研究
李 丹,魏冬旭,賈 燁,劉春雷,江連洲
(1.寧德師范學院,福建寧德 352100;2.黑龍江出入境檢驗檢疫局,黑龍江哈爾濱 150001;3.杭州娃哈哈集團有限公司,浙江杭州 310018;4.東北農業大學 食品學院,黑龍江哈爾濱 150030)
蛋白質的表面疏水性是由于部分疏水基團暴露于蛋白質表面引起的,是影響分子間相互作用的主要因素,是衡量蛋白質功能性質的關鍵指標之一。蛋白質的表面疏水性與蛋白質的理化性質和結構特性等密切相關。差示掃描量熱法(DSC)是一種研究熱性質的有效手段,變性溫度(Td)反應蛋白質的熱穩定性,變性焓(ΔH)是疏水作用和蛋白質結構緊密性的重要指標[1]。溶解性是大豆蛋白質可應用性的重要參數,是大豆蛋白質最重要的功能特性之一,溶解性差,通常伴隨著功能特性較差[2]。溶液性質是大豆蛋白質實際應用中的重要性質之一,是大豆蛋白質功能特性的基礎。溶液中可溶性聚集物的分子量及其分布以及流體動力學半徑及其分布反映蛋白質的聚集程度。ξ-電位反映蛋白質表面電荷情況,與表面疏水性共同作用,影響蛋白質溶液的穩定性[3]。
近年來,大量研究表明大豆蛋白質的理化性質和結構特性隨大豆品種和產地的不同而有所差異[4-6],而關于大豆蛋白質的表面疏水性與其理化性質和結構特性的關系研究報道不多,且研究大多數是以SPI(大豆分離蛋白)為對象,從純品大豆11S球蛋白的角度來研究品種差異對大豆蛋白表面疏水性的影響,探討大豆蛋白質熱力學特性和溶液性質與表面疏水性的關系,在國內外鮮有報道。本研究選擇我國常用的、具有區域代表性的11個大豆品種制備的11S球蛋白為實驗對象,探討大豆11S球蛋白熱力學特性和溶液性質與表面疏水性的關系,以期為今后開發大豆蛋白質特定功能性產品而進行的分子設計和重組提供重要的理論指導。
1 材料與方法
1.1 材料與儀器
大豆 東農42,東北農業大學大豆研究所;黑農46、合豐55 黑龍江省農業科學院大豆研究所;冀豆12 河北省農林科學院糧油作物研究所;皖豆28 安徽省農業科學院作物研究所;福豆234 福建省農業科學院作物研究所;ANS(1-苯胺基-8-萘磺酸) Sigma公司;KH2PO4、K2HPO4、NaCl、β-巰基乙醇 為優級純,其余試劑為國產分析純;標準蛋白(甲狀腺球蛋白、醛縮酶、牛血清白蛋白、卵白蛋白、腺苷酸激酶、激血球素) 上海康朗生物科技有限公司。
AKTA-蛋白質純化儀 美國GE公司;HiLoad 16/60 Superdex 200 prep grade凝膠預裝柱 美國GE公司;PE Pyris6差示掃描量熱儀 美國PULUS TA.XT公司;Zeta Plus電位及激光粒度分析儀 美國布魯克海文儀器公司;722型可見分光光度計 上海光譜儀器有限公司。
1.2 實驗方法
1.2.1 大豆前處理 不同品種大豆樣品粉碎后過40目篩,用正己烷脫脂,得脫脂大豆粉,以脫脂豆粉為原料制備大豆11S球蛋白,用凱氏定氮和SDS-PAGE電泳綜合分析其純度均在95%以上[7],備用。
1.2.2 表面疏水性的測定 采用ANS熒光探針法,具體參照李丹[8]和劉春雷等[9]的方法測定大豆蛋白的表面疏水性。
1.2.3 熱力學特性分析 利用PE Pyris 6-DSC熱力分析儀測定不同品種大豆11S球蛋白的熱力學特性[10]。稱取5 mg的樣品放入鋁盒中,再向其中加入10 μL的pH7.6的磷酸鹽緩沖液,壓盤密封,室溫條件下放置6 h。溫度掃描范圍:20~120 ℃;升溫速率:10 ℃/min;在120 ℃保持1 min;隨后從120 ℃降溫至20 ℃,降溫速率:30 ℃/min。記錄此過程中樣品的變性溫度(Td)和變性焓變(ΔH)。
1.2.4 溶解性的測定 參考Samoto等[11]的方法。將200 mg樣品分散于20 mL去離子水中,室溫下磁力攪拌30 min,室溫離心(10000×g,20 min)。上清液經適度稀釋,采用Lowry法測定蛋白質含量,吸光度橫坐標,蛋白質濃度為縱坐標,標準曲線如圖1所示。
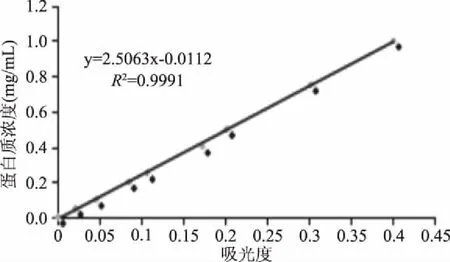
圖1 Lowry法蛋白含量測定試劑盒標準曲線
樣品溶解度(%)=上清液蛋白質量濃度/(樣品質量濃度×樣品蛋白質含量)×100
1.2.5 蛋白質溶液性質的測定
1.2.5.1 溶液的平均分子量分布的測定 采用體積排阻-凝膠色譜(SEC-HPLC)研究不同品種大豆11S球蛋白的分子量分布。應用AKTA-蛋白質純化儀和HiLoad 16/60 Superdex 200 prep grade凝膠預裝柱,采用紫外檢測器在280 nm處檢測。流動相為pH7.6的磷酸鹽緩沖液(2.6 mmol/L KH2PO4,32.5 mmol/L K2HPO4,0.4 mol/L NaCl,10 mmol/Lβ-巰基乙醇,離子強度0.5,pH7.6),在使用前經0.22 μm水系醋酸纖維素濾膜真空抽濾處理。通過預實驗,最終確認參數條件為流速1 mL/min,限制壓強0.3 MPa,柱溫25 ℃。進樣濃度10 mg/mL,進樣量1 mL,進樣前樣品過0.22 μm水系醋酸纖維素濾膜處理。
選擇6種標準蛋白進行標準曲線的繪制,分別為:甲狀腺球蛋白,分子量為669 kDa;醛縮酶,分子量為158 kDa;牛血清白蛋白,分子量為67 kDa;卵白蛋白,分子量為43 kDa;腺苷酸激酶,分子量為32 kDa;激血球素,分子量為17 kDa。標準曲線以洗脫體積為橫坐標,分子量的自然對數為縱坐標,如圖2所示。
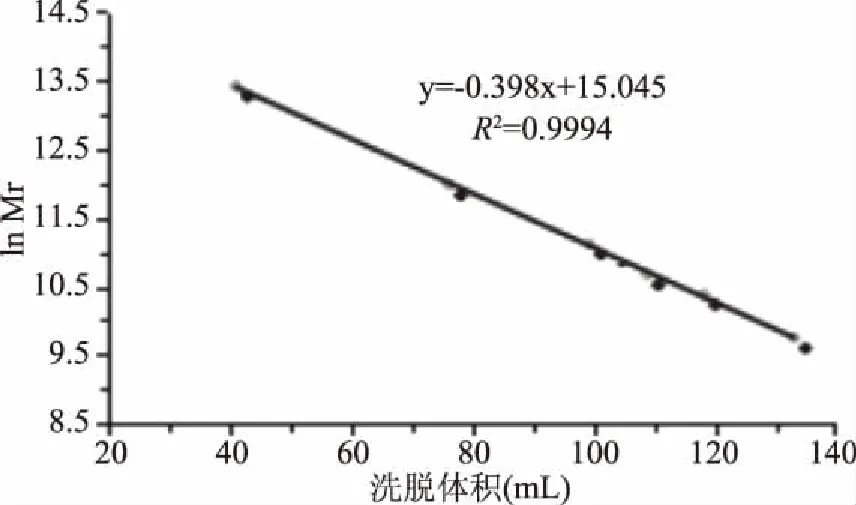
圖2 標準蛋白SEC-HPLC標準曲線
1.2.5.2 流體動力學半徑及其分布的測定 采用Zeta Plus粒度分析儀測定不同品種大豆11S球蛋白的流體動力學半徑及其分布。將樣品用pH7.6的磷酸鹽緩沖液配制成濃度為0.2%的蛋白溶液,過0.45 μm水系醋酸纖維素濾膜,室溫下進行測量,取三次測量的平均值。
1.2.5.3 ζ-電位的測定 采用Zeta Plus Zeta-電位儀測定不同品種大豆11S球蛋白溶液的ζ-電位。將樣品用pH7.6的磷酸鹽緩沖液配制成濃度為0.2%的蛋白溶液,上樣體積為1 mL,測定溫度為25 ℃。重復測量6次取平均值。
1.3 數據處理
單項實驗重復3次,結果表示為均值±標準差。采用SPSS V18.0軟件對數據進行單因素方差分析和相關性分析,如果方差分析差異性顯著(p<0.05),則使用Duncan進行多重比較。采用Origin 8.0軟件等進行圖譜分析處理和圖表制作。
2 結果與分析
2.1 表面疏水性分析
如圖3所示,6個品種大豆11S球蛋白的表面疏水性指數在1432.73~1623.00之間,東農42>合豐55>黑農46>冀豆12>皖豆28>福豆234。可見,品種差異對大豆11S球蛋白的表面疏水性影響極顯著(p<0.01),這可能與不同品種大豆11S球蛋白的結構特性和理化性質差異有關。
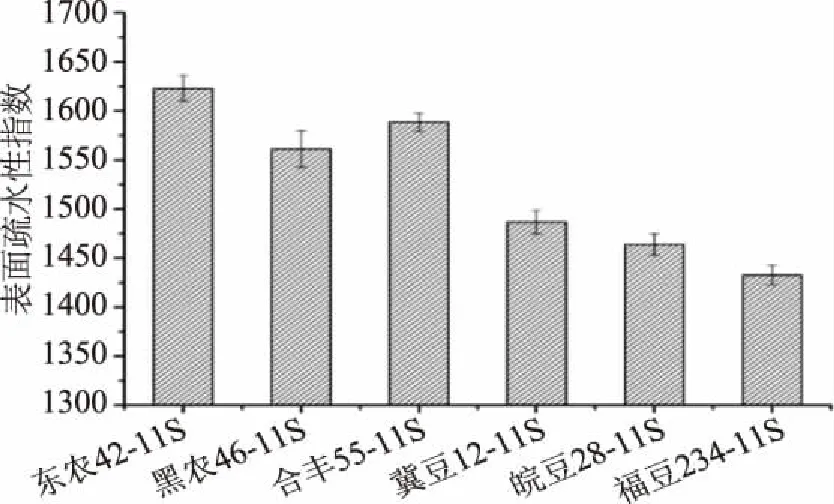
圖3 不同品種大豆11S球蛋白的表面疏水性
2.2 熱力學特性與表面疏水性的關系
由表1可知,6個品種大豆11S球蛋白之間的Td存在顯著性差異(p<0.01),福豆234>皖豆28>冀豆12>合豐55>黑農46>東農42;品種之間變性焓存在顯著性差異(p<0.01),福豆234>皖豆28>冀豆12>黑農46>合豐55>東農42。可見,品種差異對大豆11S球蛋白的熱力學特性影響極顯著。相關性分析表明:大豆11S球蛋白的表面疏水性與Td值呈顯著負相關(p=0.010),相關性系數為-0.918;與變性焓ΔH值呈顯著負相關(p=0.012),相關性系數為-0.908。分析其原因為:大豆11S球蛋白的熱變性溫度與變性焓較大時,其熱穩定性較高,使其完全變性所需要的能量較大,說明穩定其高級結構的氫鍵數量較多,分子結構緊密、構象穩定,暴露于分子表面的疏水性氨基酸殘基較少,使其具有較低的表面疏水性。
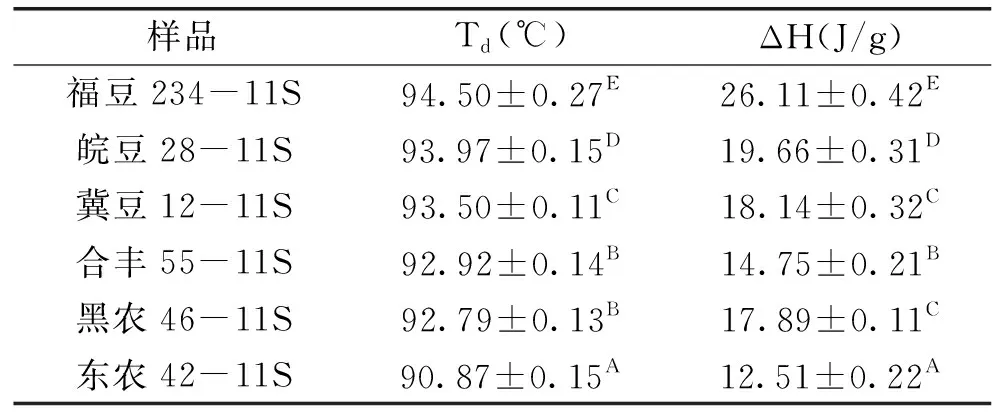
表1 不同品種大豆11S球蛋白的DSC分析結果
2.3 溶解性與表面疏水性的關系
如圖4所示,6個品種的大豆11S球蛋白均具有良好的溶解性,溶解度在85.69%~90.41%之間,福豆234>皖豆28>冀豆12>黑農46>合豐55>東農42,品種差異對大豆11S球蛋白的溶解性影響極顯著(p<0.01)。相關性分析表明:大豆11S球蛋白的溶解性與表面疏水性呈極顯著負相關(p=0.003),相關性系數為-0.953。分析其原因為:影響蛋白質溶解性的主要相互作用為疏水相互作用和離子相互作用。表面疏水性反映了蛋白質疏水相互作用的大小,表面電荷反映了離子相互作用的大小。Bigelow指出電荷、表面疏水性是決定蛋白質溶解性的兩個主要的特性,電荷越高、表面疏水性越低,蛋白質溶解性越好[12]。表面電荷的多少取決于蛋白質自身帶電荷情況和溶液的離子強度,因此在低離子強度時,大豆11S球蛋白的溶解性受表面疏水性的影響較大。
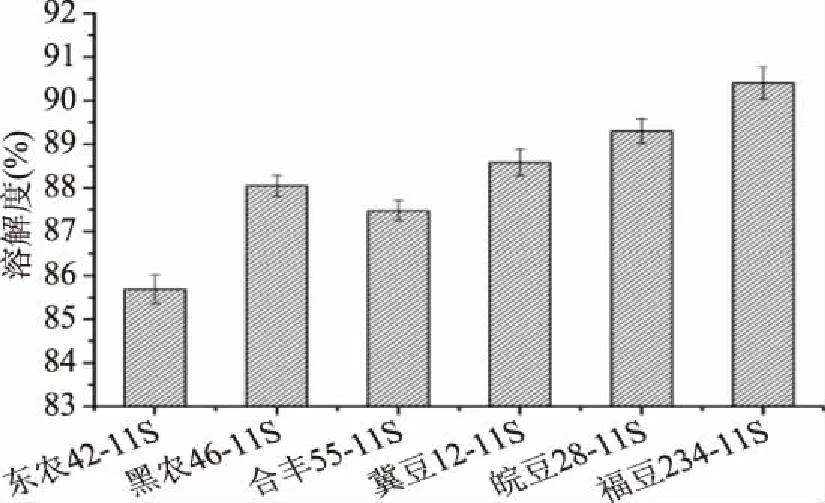
圖4 不同品種大豆11S球蛋白的溶解性
2.4 溶液的平均分子量及其分布與表面疏水性的關系
如圖5所示,6個品種大豆11S球蛋白溶液的分子量分布相似,均為一個主峰和三個小峰。通過標準蛋白SEC-HPLC標準曲線進行計算,主峰分子量約為370.49~376.43 kDa,與11S球蛋白在中性pH條件下的分子量相符[13],約占總量的83.00%;第一個小峰分子量約為594.21~640.13 kDa,是11S球蛋白的二聚體15S[14],約占總量的3.00%~5.00%;第二個小峰分子量約為468.73~474.93 kDa,是11S球蛋白的單聚體[14],約占總量的11.00%~14.00%;第三個小峰分子量約為148.27~149.57 kDa,是大豆7S球蛋白[15],是大豆11S球蛋白制備過程中存留的雜質,約占總量的1.30%~1.70%,因含量極少,在基線以下,故可忽略不計。
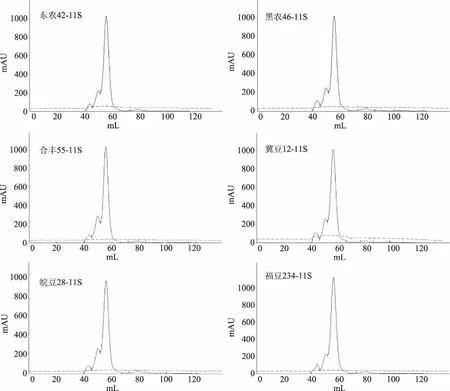
圖5 不同品種大豆11S球蛋白溶液的分子量分布圖譜
分析結果顯示,6個品種大豆11S球蛋白溶液中可溶性聚集物的平均分子量依次為東農42(397.73 kDa)>合豐55(395.74 kDa)>黑農46(395.43 kDa)>冀豆12(394.99 kDa)>皖豆28(393.43 kDa)>福豆234(392.88 kDa)。相關性分析表明:大豆11S球蛋白溶液可溶性聚集物的平均分子量與表面疏水性呈極顯著正相關(p=0.005),相關性系數為0.945。分析其原因為:大豆11S球蛋白的表面疏水性越小,即蛋白質表面的疏水相互作用越弱,溶液中形成的大分子聚集物越少,可溶性聚集物體積也越小,表現為平均分子量越小。
2.5 流體動力學半徑及其分布與表面疏水性的關系
如圖6所示,6個品種大豆11S球蛋白的流體動力學半徑分布相似,均呈現雙峰分布。分析結果顯示:峰1粒子較小,為天然大豆11S球蛋白分子;峰2粒子相對較大,為大豆11S球蛋白分子在溶液中形成的聚集體。6個品種大豆11S球蛋白溶液粒子的多分散性指數均較小,依次為東農42(0.41)>合豐55(0.40)>黑農46(0.39)>冀豆12和皖豆28(0.37)>福豆234(0.31),說明樣品溶液粒徑分布均勻[16]。6個品種大豆11S球蛋白溶液的平均粒子直徑依次為東農42(143.20 nm)>合豐55(98.90 nm)>黑農46(74.40 nm)>冀豆12(66.80 nm)>皖豆28(51.20 nm)>福豆234(40.00 nm)。相關性分析表明:大豆11S球蛋白溶液可溶性聚集物的平均直徑與表面疏水性呈顯著正相關(p=0.007),相關性系數為0.930。這是因為大豆11S球蛋白的表面疏水性越小,蛋白質分子之間的吸引力疏水相互作用越小,蛋白質分子相互聚集的程度越小,形成的可溶性聚集物粒子越小且越均勻,從而表現出平均直徑越小。
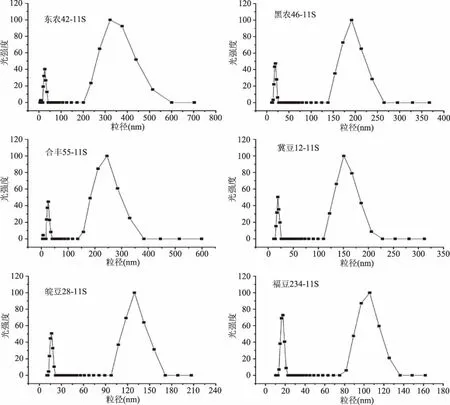
圖6 不同品種大豆11S球蛋白的流體動力學半徑分布圖
2.6 ξ-電位與表面疏水性的關系
如圖7所示,中性pH條件下,6個品種大豆11S球蛋白溶液的ξ-電位均為負值,且差異性極顯著(p<0.01),絕對值依次為皖豆28(30.77 mV)>福豆234(30.19 mV)>冀豆12(29.02 mV)>黑農46(28.89 mV)>合豐55(27.67 mV)>東農42(23.09 mV)。相關性分析表明:大豆11S球蛋白的ξ-電位絕對值(即表面電荷)與表面疏水性呈顯著負相關(p=0.034),相關性系數為-0.845,說明大豆11S球蛋白具有較高表面疏水性時,其溶液的ξ-電位絕對值較小,即蛋白質表面電荷較少。這可能是由于大豆11S球蛋白表面疏水性較高時,暴露于蛋白質表面的疏水基團數量較多,使蛋白質表面的極性氨基酸尤其是帶電荷氨基酸相對減少,表面電荷量減少,從而使得ξ-電位絕對值較小。
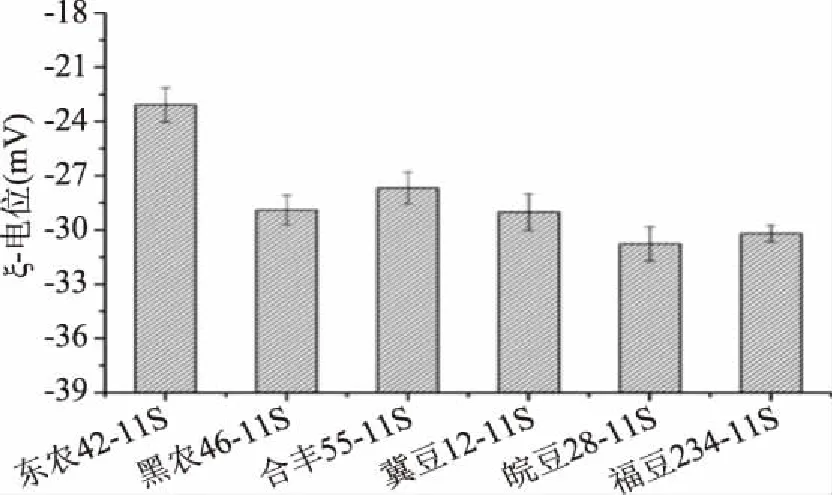
圖7 不同品種大豆11S球蛋白的ξ-電位
3 結論
大豆11S球蛋白的表面疏水性與其熱力學特性具有顯著相關性,具體表現為:大豆11S球蛋白的表面疏水性與其變性溫度呈顯著負相關,相關性系數為-0.918;與其變性焓呈顯著負相關,相關性系數為-0.908。大豆11S球蛋白溶液在低離子強度時,其溶解度受大豆11S球蛋白表面疏水性的影響較大,兩者呈極顯著負相關,相關性系數為-0.953。大豆11S球蛋白的溶液性質與其表面疏水性具有顯著相關性,具體表現為:大豆11S球蛋白溶液可溶性聚集物的平均分子量與其表面疏水性呈顯著正相關,相關性系數為0.945;平均直徑與表面疏水性呈顯著正相關,相關性系數為0.930;ξ-電位絕對值(即表面電荷)與表面疏水性呈顯著負相關,相關性系數為-0.845。
[1]Lakemond C M M,Dejonth H H J,Hessing M,et al.Heat denaturation of soy glycinin:Influence of pH and ionic strength on molecular structure[J].Journal of Agricultural and Food Chemistry,2000,48(6):1991-1995.
[2]Guan X,Yao H Y,Chen Z X.Some functional properties of oat bran protein concentrate modified by tuypsin[J].Food Chemistry,2007,101:163-170.
[3]Matsudimi N,Ishimura Y,Kato A.Improvement of gelling properties of ovalbumin by heating in dry state[J].Agricultural and Biological Chemistry,1991,55(3):879-881.
[4]Wang Wenyi,Bringe N A,Berhow M A,et al.β-Conglycinins among sources of bioactives in hydrolysates of different soybean varieties that inhibit leukemia cellsinvitro[J]. Journal of Agricultural and Food Chemistry,2008,56(11):4012-4020.
[5]Natarajan S,Xu Chenping,Bae H,et al. Proteomic and genetic analysis of glycinin subunits of sixteen soybean genotypes[J]. Plant Physiology and Biochemistry,2007,45(6/7):436-444.
[6]Fehr W R,Hoeck J A,Johnson S L,et al.Genotype and environment influence on protein components of soybeans[J]. Crop Science,2003,43(2):511-514.
[7]李丹,劉春雷,江連洲. 純品7S和11S蛋白結構與表面疏水性的相關性研究[J]. 食品研究與開發,2015,36(7):5-9,22.
[8]李丹,江連洲. 大豆7S和11S蛋白中氨基酸組成與表面疏水性的相關性研究[J]. 中國油脂,2015,40(3):25-29.
[9]劉春雷,孫立斌,李相昕,等. 大豆7S和11S蛋白二級結構與表面疏水性相關性的研究[J]. 食品科學,2015,36(17):28-32.
[10]許彩虹.大豆球蛋白糖基化接枝改性及其熱聚集行為研究[D].廣州:華南理工大學,2010.
[11]Samoto M,Maebuchi M,Miyazaki C,et al.Abundant proteins associated with lecithin in soy protein isolate[J].Food Chemistry,2007,102(1): 317-322.
[12]Bigelow C C.On the average hydrophobicity of proteins and the relation between it and protein structure[J].Journal of Theoretical Biology,1967,16(2):187-211.
[13]Badley R A,Atkinson D,Hauser H,et al.The structure,physical and chemical properties of the soy bean protein glycinin[J].Biochimica Et Biophysica Acta,1975,412(2):214-228.
[14]劉翀.大豆蛋白分級分離機理的研究[D].廣州:華南理工大學,2009.
[15]Hou D J,Chang K C.Structural characteristics of glycinin purified from soybeans stored under various conditions[J].Journal of Agricultural and Food Chemistry,2004,52:3792-3800.
[16]張忠慧.尿素變性大豆蛋白的分子結構及膠粘機理研究[D].無錫:江南大學,2008.

