4種園林綠化植物根際對土壤養分的富集效應
史 偉,楊 群,蔣躍軍,方秉俊
(成都農業科技職業學院,四川成都611130)
德國微生物學家Lorenz將根際(rhizosphere)定義為根際周圍受根際生長影響并且能夠從微環境中吸收大量養分的土體[1-2]。根際土是圍繞根際進行生物地球化學循環最活躍的區域,是土壤-植物根際-微生物三者相互作用的場所和各種物質循環、能量流動的門戶,對生態系統養分動態分布與循環、植物種間作用等發揮著重要作用,根際誘導產生根際土壤養分的變化已被證實[3-4]。良好的土壤養分環境是植物賴以生存的基礎,能否吸取充足的養分更得益于優質的植物根際微環境[5-7]。由于根際是土壤-植物根際-微生物生態系統物質交換的活躍界面,植物根際直接不斷地攝取養分,土壤養分通過質流和擴散的方式向根表皮遷移,加上根際分泌作用的影響,使根際微區的養分狀況在濃度、形態與分布等方面的變化都較為復雜,根際過程對于認識植物對土壤中養分的利用及適應顯得非常重要。
土壤是人類賴以生存的自然資源和基礎,作為生態系統中的重要組成部分,在生態系統的物質循環和能量流動方面起著重要作用[8-9]。綠化植物是城市、自然和景觀復合生態系統中具有重要自凈功能的組成部分,在減少陽光輻射、凈化空氣、重金屬修復、改善城市生態環境等方面有著重要的作用[10]。綠化植物“根際效應”及根際對養分的截留效應的影響較為明顯,其根際土壤特征可能是有效吸收、利用土壤養分和適應環境的最直接表征之一,而綠化植物根際土壤特征及對環境的適應中所起的作用等科學問題尚未得到充分的認識[11-12]。國內對根際的研究開始于20世紀80年代初,大部分集中在農作物和森林等生態系統和對農作物和樹木的根際養分、毒害離子、根際微生物、根際分泌物、簇根等方面,而對于綠化植物根際土壤養分富集效應的研究還少見報道。研究不同植物根際與非根際土壤養分分布特征與動態變化及其根際養分的富集作用,對于揭示綠化植物對土壤養分的保護、有效利用機制具有重要生態學意義。鑒于此,本試驗研究了不同植物根際土壤養分等指標,旨在探究不同綠化植物根際養分的差異以及是否存在顯著的根際效應,以期從根際微環境方面揭示不同綠化植物對土壤環境的適應及根際和非根際土壤養分的差異。
1 材料與方法
1.1 研究區概況
成都市綠化植物具有分布零散、結構形式多樣等特點,目前國內外對植物綠量的研究雖取得了很大成就,但對綠化植物的研究總體較少。本試驗以成都市4種常見綠化植物為主要對象進行了綠量相關研究。為了使研究結果更加具有科學性和說服性,通過對成都市主要街道的綠化現狀詳細調查,研究對象必須能夠代表和反映成都市的自然生態環境,同時考慮到4種環境對植物生長的影響,在遵循樹種選擇的多樣性以及各樹種在4種樣地內都有分布原則的基礎上,盡可能減少選樣誤差。筆者通過對成都市綠地現狀分布的全面調查,最后確定在成都市的主要街道選取主要的綠化植物大葉女貞、廣玉蘭、木芙蓉和夾竹桃。
1.2 樣品采集
2016年9月中旬,對成都市主要的公園綠地、道路綠地以及各高校校園綠地等城市綠地進行實地調查,分別在不同街道采集上述4種綠化植物,按照其長勢依次分為大、中、小各3株,3次重復,共27株,采集的綠化植物的形態特征和生長狀況見表1。不同綠化植物根際土壤樣品采集采用抖落法[1]。挖取具有完整根際的土體(根際主要分布的范圍),先輕輕抖落大塊不含根際的土壤,用小刀取下附在根際周圍的土壤為非根際土(S),裝入塑料袋內混勻,然后用刷子刷下黏附在根圍的土壤(距離根圍0~5 mm)作為根際土(R),取根際土盡量減少損害植物根際,對于混雜于根際土中的根系徹底去除。每種植物分別隨機采集3株大、中、小植物根際、非根際土壤(排除植物個體大小對根際的影響),每種植物采集27株,總共采集到植物108株和216個土樣(根際和非根際土,質量≥0.5 kg),剛采集的新鮮土樣塑封袋盛裝在保溫箱內4℃保存,以測定土壤重金屬含量,另一部分自然條件風干20 d后去除有機碎片,磨細,過2 mm篩,用以測定土壤養分。

表1 不同綠化植物生長特點
1.3 測定方法
1.3.1 土壤養分的測定[9]土壤 pH值:采用水浸提,pH計電位法測定;土壤有機碳:采用重鉻酸鉀容量法-外加熱法測定;土壤全氮:采用半微量凱氏定氮法測定;土壤堿解氮:采用堿解擴散法測定;土壤全磷:采用HClO4-H2SO4法測定;土壤速效磷:采用 0.05 mol/L HCl和 0.025 mol/L(1/2 H2SO4)法測定;土壤全鉀:采用原子吸收火焰光度法測定;土壤速效鉀:采用乙酸銨浸提-火焰光度法測定。
1.3.2 土壤微生物數目的測定[13]采用稀釋平板法對土樣中的細菌、真菌和放線菌進行分離計數。細菌培養采用牛肉膏蛋白胨瓊脂培養基,真菌培養采用馬丁氏培養基,放線菌培養采用高氏1號培養基。培養細菌、放線菌的土壤懸液稀釋104倍,培養真菌的土壤懸液稀釋102倍,用表面涂抹法進行平板接種。
1.4 數據處理
試驗所測數據用Microsoft Excel 2010和SPSS 18.0進行顯著差異分析、方差及相關性分析(平均數間的多重比較采用 Duncans檢驗方法,P<0.05表示差異顯著)。
根際富集率E(enrichment ratio)反映養分的富集程度,E值的大小反映土壤性狀值在植物根際的富集程度,同時也反映了植物根際效應的強弱,計算公式如下:
E=[(根際含量-非根際含量)/非根際含量]×100%。
2 結果與分析
2.1 不同綠化植物根際與非根際土壤pH值
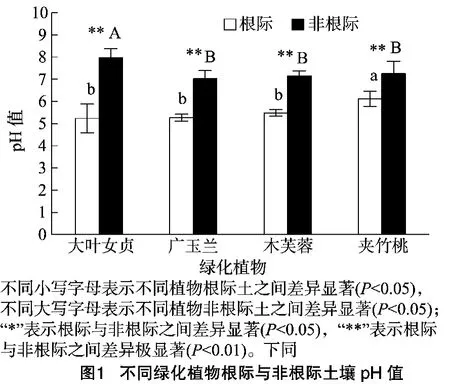
不同種植物表現出不同的根際效應,pH值作為根際微環境中最活躍因素之一,不僅受生物因素的影響,還受氣溫、降雨、母質因素等影響。從圖1可以看出,不同綠化植物根際土壤pH值均極顯著低于非根際的土壤(P<0.01)。不同樹種根際pH值降低程度不同,其中,大葉女貞、廣玉蘭的根際與非根際土壤pH值的差異最大,其根際pH值比非根際分別低2.13和1.86。根際pH值,其大小依次表現為大葉女貞<廣玉蘭<木芙蓉<夾竹桃,大葉女貞、廣玉蘭、木芙蓉根際pH值差異不顯著,顯著低于夾竹桃;非根際pH值,其大小依次表現為廣玉蘭<木芙蓉<夾竹桃<大葉女貞,廣玉蘭、木芙蓉、夾竹桃非根際pH值差異不顯著,顯著低于大葉女貞。造成根際土壤pH值低于非根際可能是因為:(1)植物根際呼吸作用產生二氧化碳溶于水,對土壤酸度有很重要的作用;(2)植物吸收土壤中陽離子使土壤酸度降低;(3)植物根系分泌有機酸對土壤pH的影響。
2.2 不同綠化植物根際與非根際土壤有機碳含量
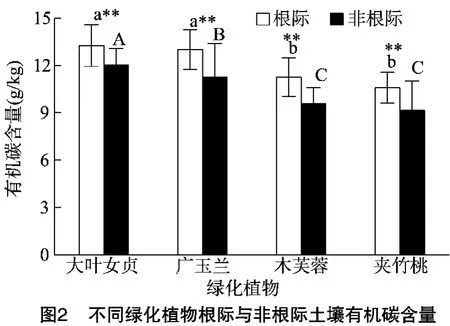
土壤中有機碳含量及其動態平衡是反映土壤質量或土壤健康的一個重要指標,直接影響土壤肥力和作物產量的高低。從土壤有機碳含量分析結果來看(圖2),綠化植物根際土壤有機碳含量均極顯著高于非根際土壤,根際土壤有機碳含量,其大小依次表現為大葉女貞>廣玉蘭>木芙蓉>夾竹桃,其中大葉女貞和廣玉蘭根際土壤有機碳含量差異不顯著,木芙蓉和夾竹桃根際土壤有機碳含量差異不顯著;非根際土壤有機碳含量,其大小依次表現為大葉女貞>廣玉蘭>木芙蓉>夾竹桃,其中木芙蓉和夾竹桃非根際土壤有機碳含量差異不顯著,顯著低于大葉女貞和廣玉蘭。
2.3 不同綠化植物根際與非根際土壤氮素含量
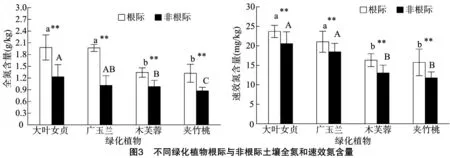
對根際和非根際土壤全氮素含量分析(圖3)表明,綠化植物根際土壤全氮含量都高于非根際土壤全氮,差異極顯著。不同綠化植物根際和非根際土壤全氮含量也都存在一定的差異。4種綠化植物根際土壤全氮比較,大葉女貞根際土壤全氮含量最高,為1.98 g/kg,夾竹桃根際土壤全氮含量最低,為1.32 g/kg;非根際土壤全氮比較,大葉女貞非根際土壤全氮含量最高,為1.23 g/kg,夾竹桃非根際土壤全氮含量最低,為0.87 g/kg。不同綠化植物根際和非根際土壤速效氮含量分析結果顯示,不同綠化植物根際土壤速效氮含量和非根際速效氮含量差異極顯著。4種不同綠化植物根際土壤速效氮含量分析顯示,大葉女貞根際土壤速效氮含量最高,夾竹桃根際土壤速效氮含量最低,分別為 23.69 mg/kg和 15.74 mg/kg;植物非根際土壤速效氮含量比較,大葉女貞非根際土壤速效氮含量最高,夾竹桃非根際土壤速效氮含量最低,分別為20.56 mg/kg和 11.74 mg/kg。氮素是植物生長發育所必需的營養元素,每種植物對氮素的吸收也不盡相同。
2.4 不同綠化植物根際與非根際土壤磷素含量
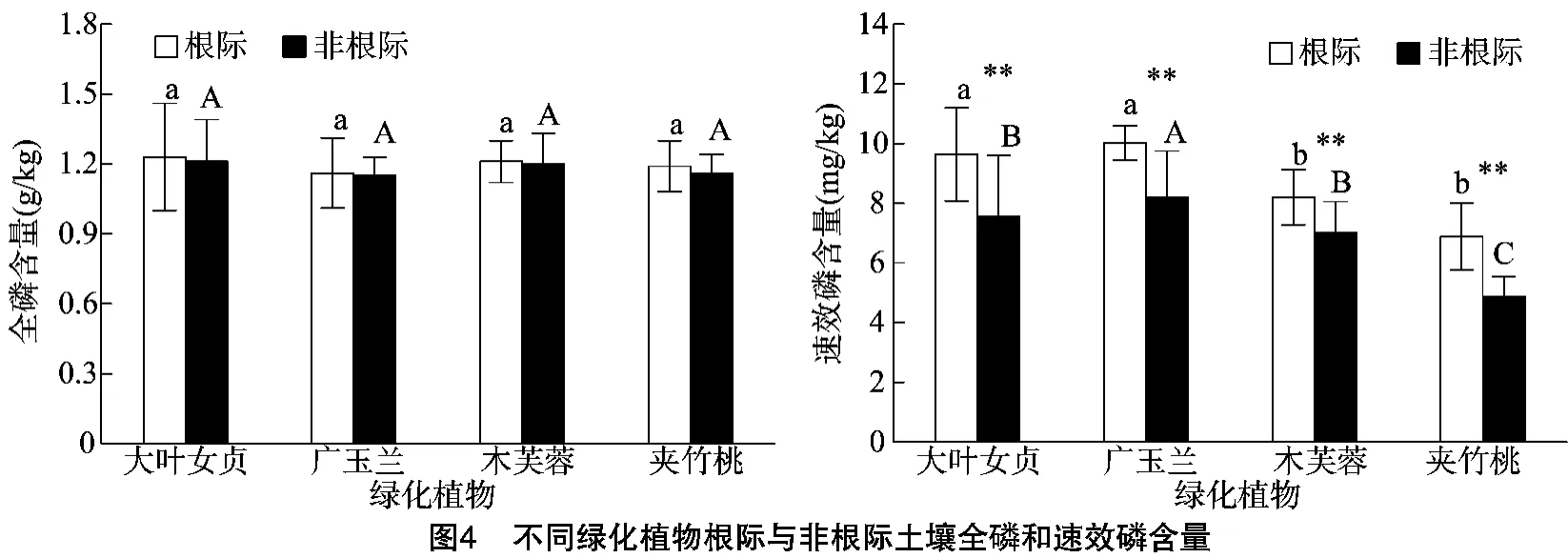
不同綠化植物根際和非根際土壤全磷含量比較分析結果(圖4)顯示,不同綠化植物根際土壤全磷含量均大于非根際土壤全磷含量,但差異不顯著。不同綠化植物之間比較,根際和非根際土壤全磷含量都存在差異,依次表現為大葉女貞>木芙蓉>廣玉蘭>夾竹桃。植物根際土壤全磷含量比較分析顯示,大葉女貞根際土壤全磷含量最高,為1.23 g/kg,廣玉蘭根際土壤全磷含量最低,為1.19 g/kg;非根際土壤全磷含量比較分析顯示,大葉女貞非根際土壤全磷含量最高,為1.21 g/kg,廣玉蘭全磷含量最低,為 1.16 g/kg。不同綠化植物根際和非根際土壤速效磷含量分析表明,大葉女貞和廣玉蘭、木芙蓉和夾竹桃根際土壤速效磷含量差異不顯著,依次表現為廣玉蘭>大葉女貞>木芙蓉>夾竹桃。植物根際土壤速效磷含量比較分析結果表明,廣玉蘭根際土壤速效磷含量最高,為 10.02 mg/kg,夾竹桃速效磷含量最低,為 6.89 mg/kg;同時比較分析非根際土壤速效磷含量,廣玉蘭非根際土壤速效磷含量最高,為8.21 mg/kg,夾竹桃速效磷含量最低,為487 mg/kg。
2.5 不同綠化植物根際與非根際土壤鉀素含量
從圖5可以看出,不同綠化植物根際和非根際土壤之間全鉀含量差異極顯著,依次表現為大葉女貞>廣玉蘭>木芙蓉>夾竹桃,其中木芙蓉和夾竹桃根際全鉀含量差異不顯著,顯著低于大葉女貞和廣玉蘭;非根際土壤全鉀含量依次表現為大葉女貞>廣玉蘭>木芙蓉>夾竹桃,其中木芙蓉和夾竹桃非根際全鉀含量差異不顯著,顯著低于大葉女貞和廣玉蘭。不同綠化植物根際和非根際土壤速效鉀含量比較分析顯示,4種綠化植物根際土壤速效鉀含量比較,大葉女貞最高,為236.6 mg/kg,夾竹桃最低,為 198.3 mg/kg;非根際土壤速效鉀分析,大葉女貞最高,為 213.5 mg/kg,夾竹桃最低,為169.3 mg/kg。


2.6 不同綠化植物根際與非根際土壤微生物數量
土壤是微生物生長和繁殖的天然培養基,微生物也是土壤養分循環和轉化的動力,通常會通過微生物的數量來表征根際活動的強弱。土壤中微生物的分布一方面可以反映土壤物質能量的轉化循環程度,另一方面也可以反映出土壤肥力狀況。從圖6可以看出,綠化植物根際土壤微生物總數、細菌、真菌和放線菌數量均顯著或極顯著高于非根際土壤。根際和非根際土壤微生物總數,其大小依次表現為大葉女貞>廣玉蘭>木芙蓉>夾竹桃,其中大葉女貞和廣玉蘭根際土壤微生物總數差異不顯著,廣玉蘭、木芙蓉和夾竹桃根際土壤微生物總數差異不顯著。根際土壤細菌數量,其大小依次表現為大葉女貞>廣玉蘭>木芙蓉>夾竹桃,不同綠化植物根際土壤細菌數量差異均顯著;非根際土壤細菌數量,其大小依次表現為大葉女貞>廣玉蘭>木芙蓉>夾竹桃,夾竹桃顯著低于其他3種綠化植物。根際土壤真菌數量,其大小依次表現為大葉女貞>廣玉蘭>木芙蓉>夾竹桃,廣玉蘭和木芙蓉根際土壤真菌數量差異不顯著;非根際土壤真菌數量,其大小依次表現為大葉女貞>廣玉蘭>木芙蓉>夾竹桃,不同綠化植物根際土壤真菌數量差異均顯著。根際土壤放線菌數量,其大小依次表現為大葉女貞>廣玉蘭>木芙蓉>夾竹桃,大葉女貞和廣玉蘭差異不顯著,木芙蓉和夾竹桃差異不顯著;非根際土壤放線菌數量,其大小依次表現為大葉女貞>廣玉蘭>木芙蓉>夾竹桃,不同綠化植物根際土壤放線菌數量差異均顯著。

表2 不同綠化植物土壤養分平均值和富集率
2.7 不同綠化植物土壤養分平均值和富集率
植物根系在從外界環境吸收養分的過程中,主要是受根際吸收的影響,不同的根際吸收速率導致根際養分虧缺或者富集。從表2可以看出,不同植物根際與非根際土壤養分含量差異均顯著(全磷除外),不同植物根際土壤養分含量均高于非根際土壤,根際土壤pH值顯著低于非根際土壤。由于根系呼吸分泌有機酸,同時也釋放CO2,進而導致微生物活動加強,大量分泌和產生有機酸致使根際土壤酸化,而根際土壤pH值的降低能夠提高多種礦質養分的有效性和促進養分有效性的轉化和活化,本研究中土壤pH值平均低1.03個單位,從而保證了綠化植物對營養元素的吸收。綜合來看,不同綠化植物根際對土壤養分表現出明顯的富集和截存效應,其中放線菌數量對根際的富集和截存效應表現得最敏感。
2.8 不同綠化植物土壤養分相關性分析
土壤是對微生物產生顯著影響的生態微環境,如土壤養分、水分、物理性狀等因子直接或間接影響著微生物結構與活性,而微生物從另一方面又對土壤肥力改善與穩定性產生作用。土壤微生物與土壤養分之間關系密切,土壤微生物可以促進土壤有機碳的積累,土壤養分的積累又可增強微生物活性,為微生物提供碳源。從表3可以看出,土壤有機碳、全氮、速效氮、全磷和速效磷與土壤微生物數量均有不同程度的相關性,微生物數量的變化可能是導致根際和非根際土壤養分發生變化的原因之一,其中細菌和真菌的數量變化與土壤養分的相關關系更為密切。有機碳和速效鉀含量是影響微生物數量與生物量碳、氮含量的主要因素,與微生物各指標呈顯著正相關。全氮與微生物總數、細菌、放線菌、生物量碳呈顯著正相關,pH值和速效磷含量與微生物總數、細菌、放線菌、生物量碳呈顯著負相關,速效氮含量與細菌數量呈顯著正相關;全磷與微生物各指標相關性程度均不顯著。
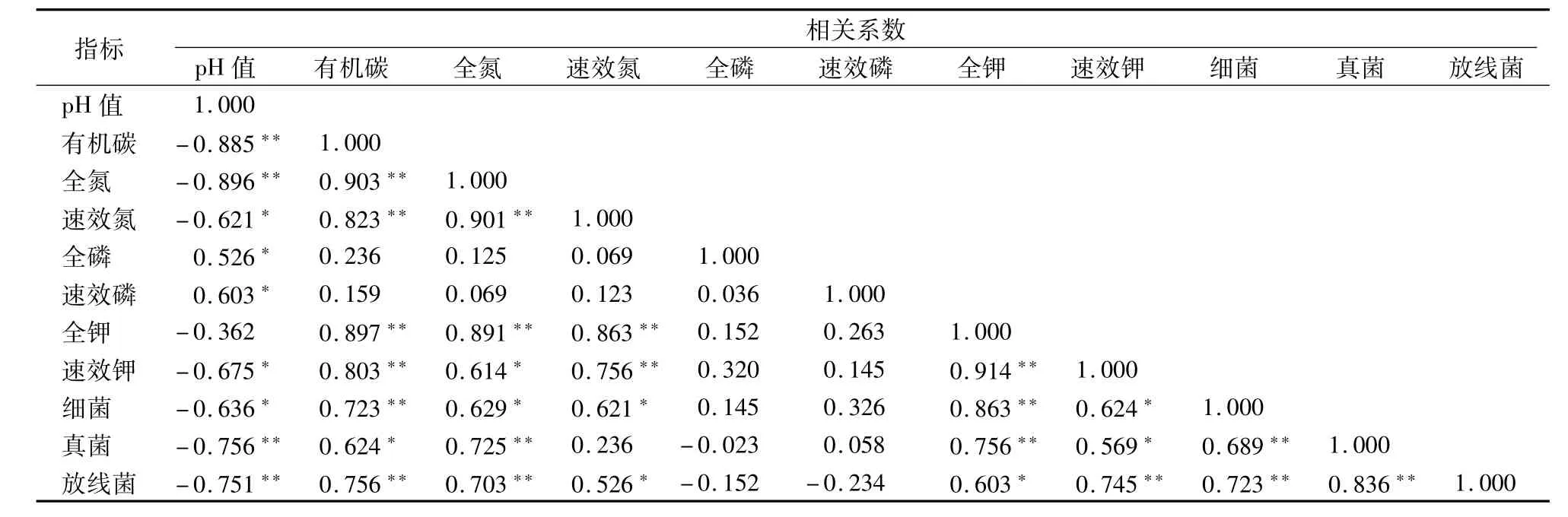
表3 綠化植物與根際土壤養分相關性分析
3 討論與結論
目前根際土壤pH值的研究是根際特征研究重要部分之一,大多數學者都認為,根際土壤pH值的變化是由根系呼吸作用釋放CO2,在離子的主動吸收、根尖細胞伸長過程中分泌質子和有機酸以及外界生態系統環境所致[14-15]。Chen等對根際微生態系統和微生物及其與植物營養的關系研究也表明,根系通過呼吸釋放CO2、根系分泌有機酸、根際微生物活動所產生有機酸和CO2等作用來降低根際土壤pH值[16]。本研究中,不同綠化植物根際和非根際土壤pH值差異顯著,根際土壤pH值顯著小于非根際土壤pH值,這是通過根際效應、根系系統調節作用來降低根際pH值。另一方面,相關性分析結果表明,土壤pH值與土壤中氮素和鉀素含量呈負顯著相關,pH值越小越有利于促進礦質養分有效性的轉化和活化,改善根際周圍土壤的堿性環境,也利于綠化植物根系對土壤中養分的吸收。
根系周圍有機物質的變化絕大部分是來源于植物在生長期間的活躍代謝作用,有時也認為是根系釋放到根際的光合產物以及死亡根系的分解[17]。本試驗數據顯示不同綠化植物根際土壤有機碳含量顯著高于非根際土壤有機碳含量,植物根系土壤有機碳含量也具有一定的差異,這說明不同植物根系分泌的有機和無機物質是不同的,這種不同必然會引起其根際有機碳數量上的差異。另外,大葉女貞根系統發達,繁密程度遠大于其他植物,這為根系周圍有機碳的產生提供有利條件,表現出較高的養分含量和明顯的根際養分富集效應。一般認為,根系分泌物及根產物等引起根際土壤養分富集效應。值得注意的是,在本研究中,不同綠化植物根際全磷出現很小程度的虧缺現象。秦嗣軍等研究發現,由于植物根系和微生物對磷元素的吸收利用強烈,而當土壤磷緩沖能力較強的時候,非根際土壤中的磷無法迅速運輸至根際,土壤固定磷解吸附作用較弱,造成植物根際磷元素出現了不同程度的虧缺[18]。因此,認識和調控根際沉積及養分的流量和方向對于建立根際環境中養分的合理分配模式具有重要作用。
本研究中絕大部分綠化植物根際土壤中氮素都顯著高于非根際土壤,這可能是由于植物在生長發育過程中,根系代謝活躍,產生的光合產物(主要是氮碳類化合物)多分泌到土壤中,使得根際土壤中氮素含量增加[19]。根系要汲取周圍土壤中營養元素來維持綠化植物的正常生理生長,這離不開土壤中磷等養分的支持,因此根系周圍磷含量要低于非根際土壤[20]。土壤肥力指標也顯示,不同綠化植物根際和非根際土壤中有機碳、氮磷含量表現為虧缺,而土壤中鉀素表現為富裕,土壤中鉀素的供應狀況與土壤pH值、含水量、根系分泌物的多少以及植物生長發育時期相關。此外,可通過一系列措施來減少根際養分損失、緩解環境的脅迫,也能通過地下根際的可塑性分配適應土壤養分有效性的改變。
總之,根際土壤中的養分的富集與虧缺是植物、土壤和土壤生物之間復雜的相互作用的結果,不同的綠化植物表現出不同程度的根際效應,也與植物體自身的生理特征、生活型、根系特征及環境對植物的反饋作用相關。為了有助于綠化植物的生理生長,要制定適宜的施肥機制,主要是施用氮磷肥,合理利用周圍的生態環境,才能持續發展。綜上所述,本研究初步表明綠化植物土壤養分在根際存在一定的富集,它們通過降低根際pH值可以提高根際養分含量,有利于土壤養分的有效利用。
參考文獻:
[1]Mohamed M A N,Elsebai T N M,Hartmann A. Effect of co-enrichment,soybean rhizosphere and p-hydroxybenzoic acid,on microbialmetabolic diversity and p-HBA degradation[J].Research Journal of Agriculture&Biological Sciences,2009,5(4):301-309.
[2]李廷軒,張錫洲,王昌全,等.根系CEC、ATP酶活性和根際微生物對籽粒莧富鉀能力的影響[J].四川農業大學學報,2002,20(4):354-356.
[3]郁珊珊,王 浩,王亞軍,等.南京市不同園林植物根際土壤養分和重金屬富集特征[J].水土保持學報,2016,30(3):120-127.
[4]Calvaruso C,Collignon C,Kies A,et al.Seasonal evolution of the rhizosphere effect on major and trace elements in soil solutions of Norway spruce(Piceaabies Karst)and beech(Fagus sylvatica)in an acidic forest soil[J].Open Journal of Soil Science,2014,4(9):323-336.
[5]倪方方,彭三妹,徐建中,等.通過改變土壤pH及菌群結構緩解杭白菊連作障礙[J].中藥材,2017,40(4):762-768.
[6]Maltais-Landry G,Scow K,Brennan E.Soil phosphorusmobilization in the rhizosphereof cover cropshas little effecton phosphorus cycling in California agricultural soils[J].Soil Biology& Biochemistry,2014,78:255-262.
[7]Singh S K,Reddy V R,Sharma M P,et al.Dynamics of plant nutrients,utilization and uptake,and soil microbial community in crops under ambient and elevated carbon dioxide[M].Springer India,2015:381-399.
[8]Huston M.Soil nutrients and tree species richness in costa rican forests[J].Journal of Biogeography,1980,7(2):147-157.
[9]Schlesinger W H,Raikes J A,Hartley A E,et al.On the spatial pattern of soil nutrients in desert ecosystems[J].Ecology,1996,77(2):364-374.
[10]Mercado-Díaz J A,Gould W A,González G.Soil nutrients,landscape age,and Sphagno - Erioporetum vaginati plant communities in arctic moist-acidic tundra landscapes[J].Open Journal of Soil Science,2014,4(4):375-387.
[11]Gilliland K,Huntly N,Knudsen J.The relationships between human settlement,soil nutrients,plant diversity and productivity,and grazing in a tundra landscape[C]//Ecological Society of America Annual Meeting.2005.
[12]闞麗艷,奚霄松,何曉穎,等.有機覆蓋物對城市園林植物土壤養分狀況的影響[J].上海交通大學學報(農業科學版),2014,32(1):79-88.
[13]Gyaneshwar P,Kumar G N,Parekh L J,et al.Role of soil microorganisms in improving P nutrition of plants[J].Plant and Soil,2002,245(1):83-93.
[14]Tiquia S M,Lloyd J,Herms D A,et al.Effects of mulching and fertilization on soil nutrients,microbial activity and rhizosphere bacterial community structure determined by analysis of TRFLPs of PCR-amplified 16S rRNA genes[J].Applied Soil Ecology,2002,21(1):31-48.
[15]Moritsuka N,Yanai J,Kosaki T.Effect of plant growth on the distribution and forms of soil nutrients in the rhizosphere[J].Soil Science and Plant Nutrition,2000,46(2):439-447.
[16]Chen Y L,Guo Y Q,Han S J,et al.Effect of root derived organic acids on the activation of nutrients in the rhizosphere soil[J].Journal of Forestry Research,2002,13(2):115-118.
[17]Das A C,Mukherjee D.Effect of insecticides on the availability of nutrients,nitrogen fixation,and phosphate solubility in the rhizosphere soil of rice[J].Biology and Fertility of Soils,1994,18(1):37-41.
[18]秦嗣軍,呂德國,李作軒,等.櫻桃根際土壤酶活性與土壤養分動態變化及其關系研究[J].土壤通報,2006,37(6):1175-1178.
[19]Mueller K E,Shann JR.Effectsof tree root-derived substrates and inorganic nutrients on pyrenemineralization in rhizosphere and bulk soil[J].Journal of Environmental Quality,2007,36(1):120-127.
[20]Wang ZY,Kelly JM,Kovar JL.Depletion ofmacro-nutrients from rhizosphere soil solution by juvenile corn,cottonwood,and switchgrass plants[J].Plant&Soil,2007,270(1/2):213-221.

