硝普鈉浸種對低溫脅迫下小麥種子萌發(fā)和幼苗生長的影響
戴知寧,陳明堂,劉 穎,吳紀中*
(1.江蘇省溧水高級中學,江蘇南京211200;2.江蘇省農墾農業(yè)發(fā)展有限公司弶港分公司,江蘇東臺224236;3.江蘇省農業(yè)科學院種質資源與生物技術研究所,江蘇南京210014)
江蘇是我國稻茬小麥的主產區(qū),稻茬小麥播種面積占小麥播種面積的80%以上。近年來,隨著偏遲熟粳稻品種的應用,水稻騰茬較晚,小麥播種期推遲,嚴重影響了稻茬小麥的播種質量和幼苗素質的提高。據統計,2016年江蘇小麥播種面積為218萬hm2,其中遲播(較適播期晚10 d以上)面積為145萬hm2,遲播面積占66.4%,有30%以上的稻茬小麥播種期推遲1個月以上。遲播小麥由于受低溫的影響,種子萌發(fā)慢、活力低、出苗率下降、幼苗生長緩慢,難以在冬前形成壯苗,幼苗的抗凍能力也顯著降低,極易造成凍害,嚴重影響小麥的產量和品質形成。因此,明確低溫脅迫對小麥種子萌發(fā)和幼苗生長的影響及其機理,探求緩解低溫脅迫的調控途徑,是當前小麥生產中亟待解決的問題。
前人研究表明,低溫脅迫降低種子內淀粉酶活性、誘導種子活性氧產生、降低抗氧化酶系統清除效率、影響種子呼吸,從而導致腺嘌呤核苷三磷酸(ATP)含量下降,進而抑制小麥種子萌發(fā)[1-3]。低溫脅迫對小麥幼苗生長的影響主要通過抑制小麥幼苗根系分生組織的分裂能力,降低生長素(IAA)積累,從而抑制根系生長,同時,地上部蔗糖合成降低、光合電子傳遞受阻,導致光合作用降低[3-5]。一氧化氮(NO)作為植物信號分子,在種子萌發(fā)過程中起著重要的作用[6]。Bethke等研究發(fā)現NO可能參與打破種子休眠的過程,外源NO供體硝普鈉(SNP)處理可顯著提高逆境和正常條件下植物種子的萌發(fā)[7-8]。使用SNP噴灑小麥幼苗葉片后,低溫環(huán)境下的植株存活率提高,低溫傷害后植株的康復能力也有所提高[9]。然而,關于SNP浸種對低溫脅迫下小麥種子萌發(fā)和幼苗生長的影響及其機理尚不明確。因此,本試驗采用光照培養(yǎng)箱模擬低溫的方法研究了SNP浸種對低溫脅迫下小麥種子萌發(fā)過程中胚根和胚芽鞘生長進程、淀粉代謝及相關酶活性、幼苗抗氧化系統的影響,以期探尋低溫條件下促進小麥種子萌發(fā)和幼苗生長的有效途徑,為遲播小麥的高產提供理論依據和技術支持。
1 材料與方法
1.1 試驗設計
1.1.1 種子萌發(fā)試驗。以長江流域大面積推廣的小麥品種揚麥16為試驗材料,選取籽粒飽滿、大小一致的種子,經1%NaClO消毒10~15 min,蒸餾水沖洗干凈。將種子分別在(26±1)℃條件下用蒸餾水(S0)、0.1 mmol/L SNP(S1)浸種 12 h 催芽。催芽后,挑選一致的種子,置于直徑為9 cm鋪有3層濾紙的培養(yǎng)皿內,在光照培養(yǎng)箱內進行萌發(fā)處理。設置晝 /夜溫度為 20/10℃(T0,對照)、15/8℃(T1)和10/4℃(T2)3個溫度處理,以分別模擬小麥適播期、遲播10 d和遲播20 d的晝夜溫度。每處理6次重復,每重復50粒種子,保持培養(yǎng)皿水分充足。于發(fā)芽第7天取樣,分別測定胚根長和胚芽鞘長,部分樣品分為胚芽鞘、根系和剩余種子3部分,在105℃下殺青30 min,70℃烘干至恒質量并測定干質量,樣品用于測定種子淀粉、可溶性糖和游離氨基酸含量;部分樣品液氮冷凍后保存于-80℃冰箱,用于測定α-淀粉酶和β-淀粉酶活性。
1.1.2 幼苗生長試驗。試驗材料、浸種處理和溫度設置與種子萌發(fā)試驗相同,浸種后將種子擺進含有塑料紗網的特制的培養(yǎng)周轉箱(長×寬×高為310 mm×210 mm×110 mm),萌發(fā)期周轉箱內供給清水使種子保持濕潤,待種子長至1葉1心時周轉箱內供給Hoagland營養(yǎng)液進行培養(yǎng),每箱保持60株。苗期每天提供12 h的光照,光照強度為360 μmol/(m2·s)。試驗采用完全隨機區(qū)組試驗,設6次重復。于2葉1心時收獲,分別測定株高、根長和葉綠素含量。樣品分為根系和地上部(葉片),部分樣品液氮冷凍后保存于-80℃冰箱,用于測定超氧化物歧化酶(SOD)、過氧化物酶(POD)活性以及丙二醛(MDA)、可溶性蛋白含量;部分樣品用于測定地上部和根系干質量、可溶性糖和游離氨基酸含量。
1.2 測定項目與方法
1.2.1 種子發(fā)芽指標。以種子的胚根和胚芽鞘的長度分別達到種子的全長和半長作為發(fā)芽標準。發(fā)芽率(GR)為萌發(fā)后7 d培養(yǎng)皿中已發(fā)芽種子占發(fā)芽種子總數的百分比。平均發(fā)芽時間(MGT)根據Ellis等的方法[10]計算,即 MGT=∑(f× x)/∑f,其中,f是每天萌發(fā)的種子數,x是計算的天數。發(fā)芽指數(GI)參考 Wang等的方法[11]計算,即 GI=∑(Gi/Ti),其中Gi是第i天的發(fā)芽率,Ti是萌發(fā)試驗天數。
1.2.2 根長。根長測定采用根系掃描儀(Epson 1680,Indonesia),并通過專用分析軟件(WinRhizo ProVision 5.0)進行分析,計算單株總長度。
1.2.3 貯藏物質含量。可溶性糖含量測定采用蒽酮法[12];游離氨基酸含量測定采用Moore等的方法[13];總淀粉含量和可溶性蛋白含量測定分別采用茚三酮比色法和考馬斯亮藍法[12]測定。
1.2.4 葉綠素含量。采用乙醇-丙酮混合法[12]測定。
1.2.5 淀粉酶活性和活性氧代謝。α-淀粉酶和β-淀粉酶活性的測定采用3,5-二硝基水楊酸法[13];丙二醛(MDA)含量、超氧化物歧化酶(SOD)和過氧化物酶(POD)活性測定分別采用TBA比色法、NBT比色法和愈創(chuàng)木酚比色法[14]。
1.3 數據分析
采用SPSS10.0軟件對試驗數據進行方差分析和顯著性測驗,采用SigmaPlot 10.0進行作圖。
2 結果與分析
2.1 SNP浸種對低溫脅迫下小麥種子萌發(fā)的影響
小麥種子發(fā)芽率、胚根長、胚芽鞘長、胚根和胚芽鞘干質量均隨溫度的降低而降低,而剩余種子干質量(種子余質量)顯著增加(表1)。與T0處理相比,T1、T2處理的平均發(fā)芽率均顯著下降,但T1達到95%以上,而T2處理的發(fā)芽率在70%左右。與清水浸種處理(S0)相比,相同低溫脅迫T1和T2處理下SNP浸種處理(S1)均顯著提高了種子的發(fā)芽指數、胚根長和胚芽鞘長(P<0.05),并且縮短了平均發(fā)芽時間,同時顯著降低種子余質量(P<0.05)。但T1處理下SNP浸種處理顯著提高了胚根和胚芽鞘干質量(P<0.05),T2處理下略有增加但無明顯差異。表明SNP浸種處理明顯緩解了低溫脅迫對種子萌發(fā)的抑制,且T1處理下SNP浸種顯著改善發(fā)芽質量,而過低的溫度T2處理下SNP對種子發(fā)芽的促進作用降低。
2.2 SNP浸種對低溫脅迫下小麥種子貯藏物質分解的影響
表2表明,低溫處理(T1、T2)下種子淀粉含量顯著高于對照(T0),而可溶性糖含量和游離氨基酸含量分別顯著低于對照(P<0.05),且萌發(fā)溫度越低,淀粉分解越慢,導致可溶性糖和游離氨基酸含量顯著降低(P<0.05)。與清水處理(S0)相比,相同溫度下S1處理顯著降低了小麥萌發(fā)種子內淀粉含量,并顯著提高了可溶性糖含量(P<0.05),表明SNP浸種加速了種子淀粉的降解。同時發(fā)現T1-S1處理的淀粉和可溶性糖含量接近T0-S0處理,與其他低溫處理差異顯著(P<0.05),表明在過低的溫度下SNP的作用下降。
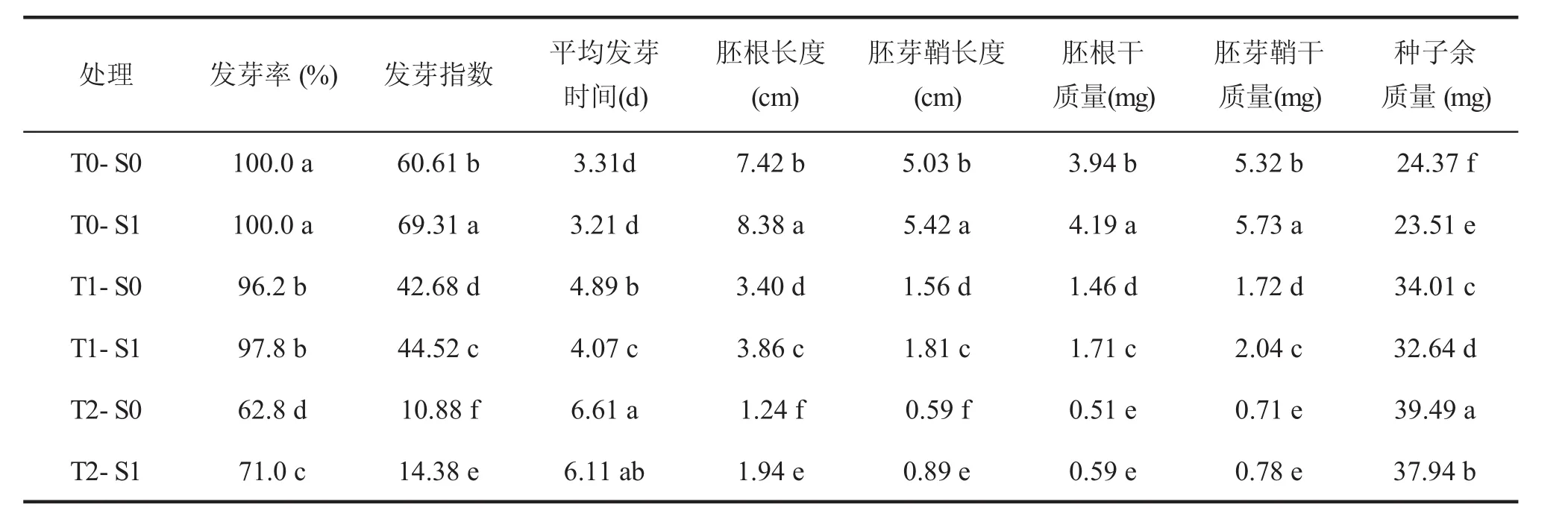
表1 SNP浸種對低溫脅迫下小麥種子萌發(fā)的影響

表2 SNP浸種對低溫脅迫下小麥種子淀粉、可溶性糖和游離氨基酸含量的影響
2.3 SNP浸種對低溫脅迫下小麥種子淀粉酶活性的影響
低溫處理顯著降低了種子內α-淀粉酶和β-淀粉酶活性,且2種淀粉酶活性隨溫度的降低而降低(圖1)。在T0、T1處理下,與S0比較,SNP浸種均顯著提高了α-淀粉酶和β-淀粉酶活性,但在T2處理下,SNP浸種處理與S0處理差異不顯著,表明低溫抑制種子內淀粉降解,且SNP對低溫脅迫的緩解作用受溫度的影響。
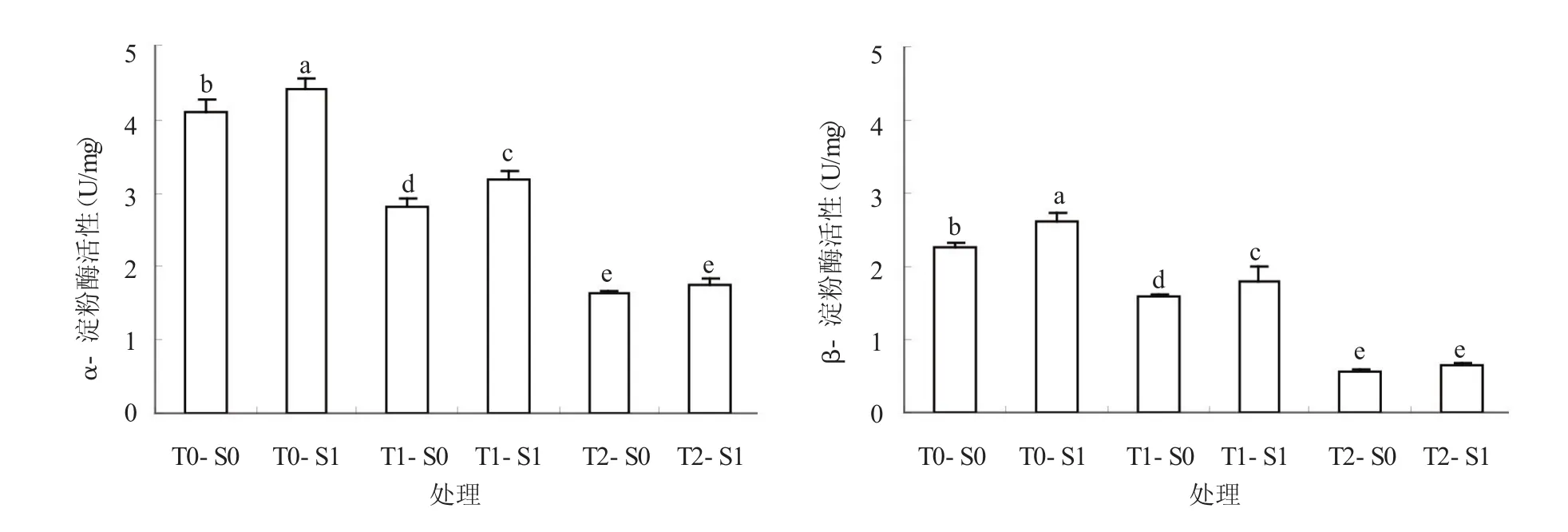
圖1 SNP浸種對低溫脅迫下小麥種子淀粉酶活性的影響
2.4 SNP浸種對低溫脅迫下小麥幼苗生長和葉綠素含量的影響
與適溫對照(T0)相比,低溫處理(T1、T2)顯著降低了幼苗地上部和根系干質量及葉片葉綠素含量(P<0.05,表3)。與清水浸種處理(S0)相比,相同溫度處理下SNP浸種(S1)處理均顯著提高了小麥株高、根長、干質量和葉綠素含量(P<0.05),表明SNP浸種處理促進了小麥幼苗的生長。同時發(fā)現,SNP浸種處理下小麥株高、地上部和根系干質量的增加幅度隨著溫度的降低而降低,說明SNP浸種對低溫脅迫的緩解作用因溫度而異。
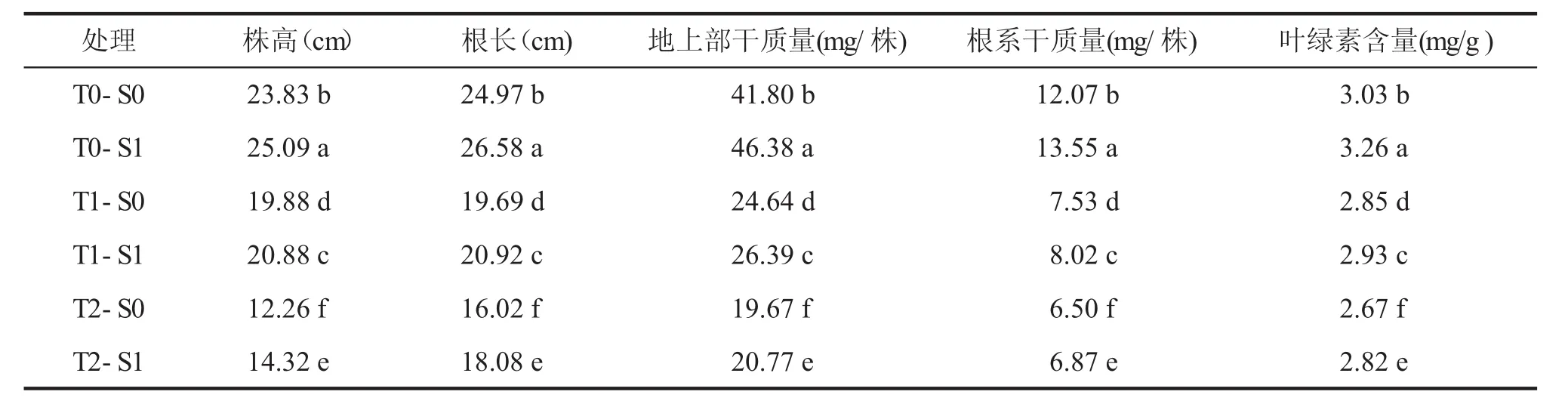
表3 SNP浸種對低溫脅迫下小麥幼苗生長和葉綠素含量的影響
2.5 SNP浸種對低溫脅迫下小麥幼苗碳氮含量的影響
與適溫對照(T0)相比,低溫處理(T1、T2)顯著降低了小麥幼苗根系和地上部可溶性糖含量,但顯著提高了游離氨基酸和可溶性蛋白含量(P<0.05,表4)。除T2處理的根系游離氨基酸含量外,相同溫度下SNP浸種(S1)均提高了小麥幼苗根系和地上部可溶性糖含量,但降低了游離氨基酸和可溶性蛋白質含量,改善了小麥幼苗植株體內的碳氮平衡,有利于植株生長。此外,T1處理下SNP浸種顯著提高了根系和地上部可溶性糖含量(P<0.05),而對T2處理的地上部可溶性糖含量無顯著影響,表明過低溫度條件下SNP緩解低溫脅迫對幼苗生長的效應降低。
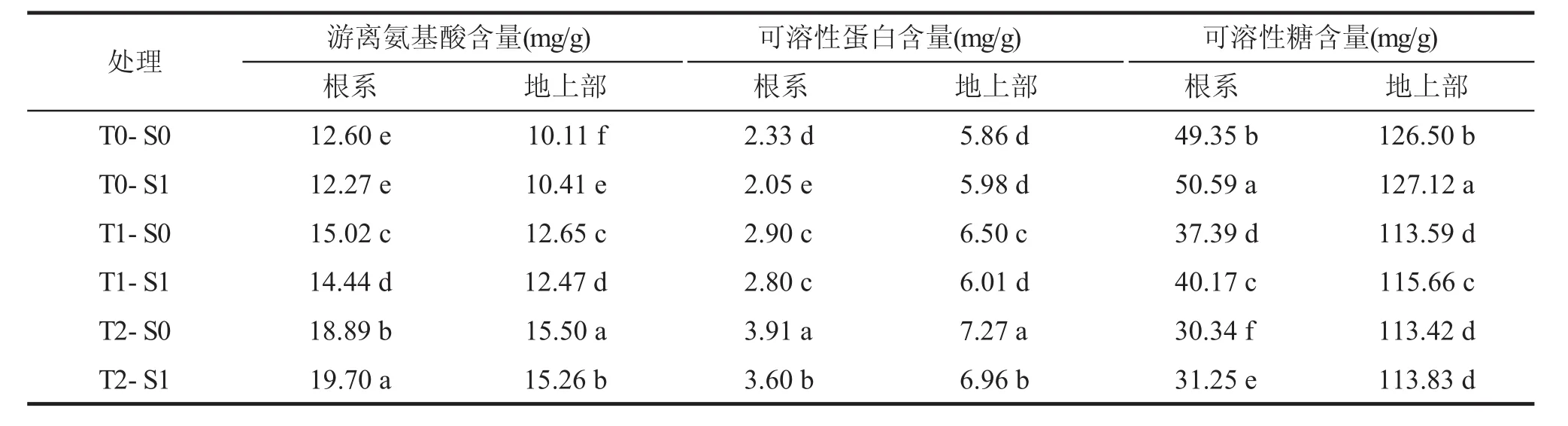
表4 SNP浸種對低溫脅迫下小麥幼苗游離氨基酸、可溶性蛋白和可溶性糖含量的影響
2.6 SNP浸種對低溫脅迫下小麥幼苗抗氧化系統的影響
表5表明,低溫處理下小麥幼苗根系和葉片SOD、POD活性及MDA含量隨溫度的降低而顯著提高。在T1和T2處理下,與S0相比,SNP浸種均顯著提高了小麥幼苗根系和葉片SOD、POD活性(P<0.05),T1處理下,SNP浸種顯著降低了根系和葉片MDA含量(P<0.05),T2處理下,SNP浸種顯著降低了根系MDA含量(P<0.05)。表明SNP通過增強植株抗氧化活性,降低膜脂過氧化,緩解了低溫對生長的抑制。
3 討論
種子萌發(fā)是作物生長發(fā)育過程中最重要的階段,也是衡量作物抗逆能力強弱的關鍵時期。隨著種子萌發(fā)進程,種子內胚、胚乳、子葉中細胞內部會發(fā)生一系列生理生化變化,包括酶系統的活化、貯藏物質的轉化與轉移、呼吸作用增強、ATP和內源激素的合成與活化等,這一系列過程受溫度、激素和信號物質的調控。陳蕾太等研究表明,干旱、低溫等逆境條件顯著降低了不同小麥品種種子的活力、發(fā)芽勢及種子內的生理代謝活性[1]。王興等研究表明,6-BA處理可促進小麥種子發(fā)芽,調節(jié)植株內源激素和膜脂過氧化作用,提高抵御低溫的能力[15]。張華研究表明,NO可促進滲透脅迫下小麥種子的吸脹、萌發(fā)和胚芽胚根的生長,加速貯藏物淀粉降解,提高種子萌發(fā)過程中的抗氧化能力[16]。本研究表明,低溫顯著降低了小麥的發(fā)芽率,延緩了胚根、胚芽鞘的生長。然而,SNP浸種顯著提高了低溫脅迫下種子的發(fā)芽率、發(fā)芽速率和發(fā)芽指數,促進了胚根和胚芽的生長,說明SNP對促進種子萌發(fā)和緩解低溫脅迫具有重要的作用。種子萌發(fā)所需要的物質和能量完全來源于貯藏物質動員,小麥種子胚乳中儲存的淀粉是其萌發(fā)所需物質和能量的主要來源。α-淀粉酶和β-淀粉酶是主要的淀粉水解酶,由SNP產生的NO能提高脅迫和非脅迫下種子萌發(fā)及淀粉酶活性[17-18]。NO能誘導自由型β-淀粉酶活化上調β-淀粉酶基因轉錄水平,増加β-淀粉酶蛋白的表達,同時能夠誘導β-淀粉酶的快速應答[19]。在本研究中,SNP顯著提高了α-淀粉酶和β-淀粉酶活性,加速了淀粉的降解,提高了種子萌發(fā)過程中可溶性糖含量,表明SNP能夠通過提高低溫脅迫下小麥籽粒淀粉代謝能力,促進小麥種子的萌發(fā)。
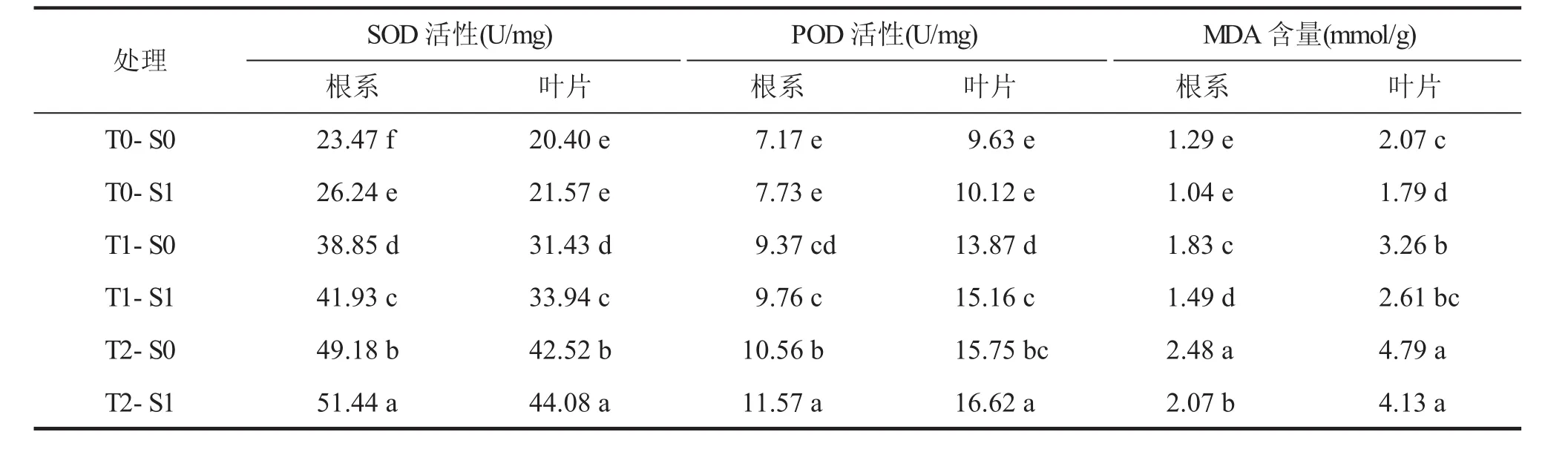
表5 SNP浸種對低溫脅迫下小麥幼苗SOD、POD活性和MDA含量的影響
低溫脅迫下小麥幼苗細胞平衡被打破,活性氧(ROS)大量積累,引起細胞膜、磷脂、蛋白質和核酸的氧化損傷,同時,植株細胞內SOD酶被激活,降低超氧陰離子(O2-)積累,從而減輕逆境對細胞的氧化傷害[20]。Mur等研究表明,植物應對諸如高溫、低溫、干旱等脅迫時,產生ROS和活性氮(NO),兩者在逆境脅迫下都起到信號傳遞作用[21]。鄭春芳等研究指出,NO顯著提高鹽脅迫下萌發(fā)的小麥種子線粒體內SOD、CAT活性,抑制超氧陰離子產生速率,同時降低了H2O2和MDA積累[22]。本研究結果表明,低溫處理顯著提高了小麥幼苗根系、地上部SOD、POD活性和MDA含量,說明低溫脅迫激活了小麥體內ROS酶促系統,維持ROS平衡。SNP浸種提高了小麥幼苗根系和地上部SOD、POD活性,降低了MDA含量,促進低溫脅迫下小麥幼苗的生長。同時,根系SOD、POD活性增加幅度顯著高于地上部,說明根系對低溫脅迫和SNP較敏感。因此,SNP浸種可提高低溫脅迫下小麥幼苗的抗氧化能力,增強幼苗的耐低溫能力。
綜上所述,低溫脅迫抑制了小麥種子萌發(fā)和幼苗生長,SNP浸種提高了低溫脅迫下小麥種子的發(fā)芽率、發(fā)芽指數、發(fā)芽速度和種子淀粉酶活性、游離氨基酸含量、可溶性糖含量,加快了貯藏淀粉的降解,促進胚根和胚芽鞘的生長。同時,SNP浸種可激活幼苗的抗氧化系統,提高SOD、POD活性,降低ROS對幼苗的傷害,增強幼苗對低溫的耐性。因此,SNP浸種可作為一種有效的調控遲播小麥出苗質量的重要手段。
參考文獻:
[1]陳蕾太,孫愛清,楊 敏,等.逆境條件下小麥種子活力與種子萌發(fā)相關酶活性及其基因表達的關系[J].應用生態(tài)學報,2017,28(2):609-619.
[2]劉 美,張 鳳,楊翠翠,等.小麥種子萌發(fā)早期淀粉降解關鍵酶活性及基因表達量研究[J].山東農業(yè)科學,2014,46(9):39-45.
[3]李向楠.小麥低溫抗性誘導的技術途徑及其生理機制研究[D].南京:南京農業(yè)大學,2014.
[4]顧大路,楊文飛,文廷剛,等.凍害脅迫下防凍劑處理對小麥生理特征和產量的影響[J].江蘇農業(yè)學報,2016,32(3):490-496.
[5]關雅楠,黃正來,張文靜,等.低溫脅迫對不同基因型小麥品種光合性能的影響[J].應用生態(tài)學報,2013,24(7):121-125.
[6]王樹剛,王振林,王 平,等.不同小麥品種對低溫脅迫的反應及抗凍性評價[J].生態(tài)學報,2011,31(4):1064-1072.
[7]BETHKE P C,LIBOUREL I G,JONES R L.Nitric oxide reducesseeddormancyinArabidopsis[J].JournalofExperimental Botany,2006,57(3):517.
[8]BETHKE P C,BADGER M R,JONES R L.Apoplastic synthesis ofnitric oxide byplant tissues[J].Plant Cell,2004,16(2):332-341.
[9]孫永剛,凌騰芳,王家杰,等.外源一氧化氮供體硝普鈉對小麥種子萌發(fā)早期β-淀粉酶及其亞細胞分布的影響[J].作物學報,2008,34(9):1608-1614.
[10]ELLIS R H,ROBERTS E H.Towards a rational basis for testingseed quality[D].London:UniversityofNottingham,1978.
[11]WANG Y R,YU L,NAN Z B,et al.Vigor tests used to rank seed lot quality and predict field emergence in four forage species[J].Crop Science,2004,44(2):535-541.
[12]王學奎,黃見良.植物生理生化實驗原理與技術[M].北京:高等教育出版社,2015.
[13]MOORE S,STEIN W H.A modified ninhydrin reagent for the photometric determination of amino acidsand related compounds[J].Journal of Biological Chemistry,1954,211(2):907-13.
[14]ZHENG C F,JIANG D,LIU F L,et al.Exogenous nitric oxide improves seed germination in wheat against mitochondrial oxidative damage induced by high salinity[J].Environmental&Experimental Botany,2009,67(1):222-227.
[15]王 興,徐 琛,蒼 晶,等.外源6-BA對小麥種子萌發(fā)及越冬期植株凍害的緩解作用[J].麥類作物學報,2013,33(2):357-363.
[16]張 華.外源一氧化氮促進小麥種子萌發(fā)及其信號作用機制研究[D].南京:南京農業(yè)大學,2005.
[17]ESIM N,ATICI O,MUTLU S.Effects of exogenous nitric oxide in wheat seedlings under chilling stress[J].Toxicology&Industrial Health,2014,30(3):268-274.
[18]ZHANG H,SHEN W B,ZHANG W,et al.A rapid response of β-amylase to nitric oxide but not gibberellin in wheat seeds duringthe earlystage ofgermination[J].Planta,2005,220(5):708.
[19]BAEK K H,SKINNER D Z.Production of reactive oxygen speciesbyfreezingstress and the protective roles ofantioxidant enzymes in plants[J].Journal of Agricultural Chemistry&Environment,2012,1(1):34-40.
[20]HODGES D M,ANDREWS C J,JOHNSON D A,et al.Antioxidant enzyme responses to chilling stress in differentially sensitive inbred maize lines[J].Physiologia Plantarum,1996,98(4):1105-1113.
[21]MUR L A,MANDON J,CRISTESCU S M,et al.Methods of nitricoxidedetection in plants:a commentary[J].Plant Science,2011,181(5):509-519.
[22]鄭春芳,姜 東,戴廷波,等.外源一氧化氮供體硝普鈉浸種對鹽脅迫下小麥幼苗碳氮代謝及抗氧化系統的影響[J].生態(tài)學報,2010,30(5):1174-1183.

