三乙胺催化的α-硝基乙酸酯與α,β-不飽和酰基吡唑的Michael加成反應
劉瑩瑩,何 謙,陳 峰,李雪鋒
(西南民族大學化學與環境保護工程學院,四川 成都 610041)
Michael加成反應是構建碳碳鍵的重要方法之一,因為高度的原子經濟性而備受有機化學家的關注[1]。 近年來隨著金屬催化[2]和有機催化[3]的蓬勃發展,Michael加成反應也取得了一系列重要進展。總結目前的研究工作我們發現,當前報導的Michael加成反應主要以α,β-不飽和醛/酮[4]、α,β-不飽和硝基烯烴[5]以及β,γ-不飽和α-酮酸酯[6]作為受體,其它受體參與的反應相對較少。α,β-不飽和羧酸衍生物[7]因為較低的反應活性而不能有效地參與Michael加成反應,其中α,β-不飽和酰基吡唑在發生氮雜Michael加成反應時,需要在當量的催化劑下經過長時間反應,才能以滿意的產率轉化為加成產物[8];此外,只有雙鍵末端含強吸電子三氟甲基的α,β-不飽和酰基吡唑才能夠有效與苯硫酚發生加成反應[9]。因此,發展α,β-不飽和羧酸衍生物參與的Michael加成反應,無疑具有一定的挑戰性。
α-硝基乙酸酯是一種高活性的親核試劑,其加成產物經過簡單的還原-水解處理即轉化為取代的α-氨基酸,因此在合成領域受到廣泛關注[10-12]。 盡管α-硝基乙酸酯已經被廣泛運用于Manich反應,但是其作為給體的Michael加成反應還有待進一步開發[13-19]。我們一直致力于發展α,β-不飽和酰基吡唑參與的Michael加成反應,[20]在本論文中,我們進一步拓展給體類型,成功發展了α,β-不飽和酰基吡唑與α-硝基乙酸酯的Michael加成反應;同時我們還發現,得到的加成產物經過簡單處理,即轉化為相應的功能分子。
1 實驗部分
1.1 藥品及儀器
苯和甲醇均購至成都科龍試劑公司。3,5-二甲基吡唑、乙腈、三乙胺(TEA)和1,8-二氮雜雙環[5.4.0]十一碳-7-烯(DBU)購自上海泰坦科技股份有限公司。二環己基二亞胺(DCC)、4-二甲氨基吡啶(DMAP)、α-硝基乙酸乙酯、α-硝基乙酸甲酯、偶氮二異丁腈(AIBN)和三丁基氫化錫購自阿拉丁試劑有限公司。α,β-不飽和羧酸購自天津希恩思生化科技有限公司。所有溶劑和α-硝基乙酸酯未經純化直接使用。所有試劑均為分析純。
Varian 400 MHz型核磁共振儀(CDCl3為溶劑,TMS為內標),Bruker Daltonics LCQDECA型離子阱高分辨質譜儀。
1.2 合成
1.2.1 α,β-不飽和酰基吡唑的合成[21]
α,β-不飽和酰基吡唑的合成反應式:
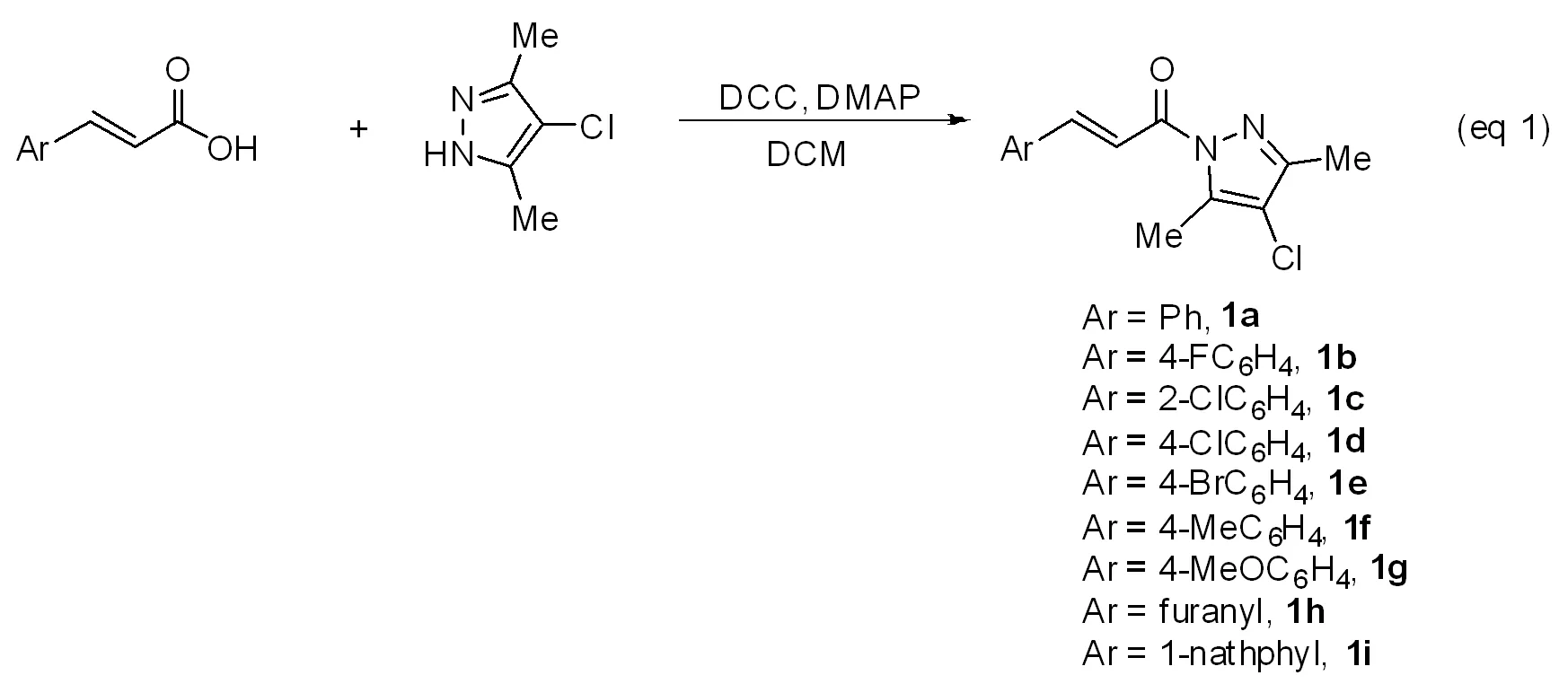
在100 mL圓底瓶中加入肉桂酸(1.1g, 10 mmol)和3,5-二甲基-4-氯吡唑(1.3g, 10 mmol),將混合物溶解于二氯甲烷(30 mL)后置于冰浴中冷卻。然后向溶液中加入二環己基二亞胺(DCC,2.25g, 12 mmol),接著滴加4-二甲氨基吡啶(DMAP,0.123g,1 mmol)的二氯甲烷溶液(10 mL)。滴加完畢后,反應混合物繼續在冰浴中攪拌30min,然后移走冰浴逐漸升至室溫,并繼續攪拌24h。待α,β-不飽和羧酸完全反應后,蒸除大部分溶劑,然后加入50 mL乙醚。過濾取濾液,濃縮后經柱層析得到白色粉末1.55g, 產率78%。1H NMR(400 MHz,CDCl3) δ(ppm)7.95~7.87(m,2H),7.69~7.67(m,2H),7.43~7.41(m, 3H),2.63(s,3H),2.31(s,3H);13C NMR(100 MHz,CDCl3)δ(ppm)164.9,149.2,146.8,139.5,134.6,130.8,128.9,128.7,116.8,114.8,12.6,11.8。
化合物1b-1i按照類似方法合成。
1b,黃色晶體,產率60%;1H NMR(400 MHz,CDCl3)δ (ppm) 7.88~7.77 (m,2H),7.67~7.62(m,2H),7.12~7.07(m,2H),2.60(s,3H),2.27(s,3H)。
1c,黃色晶體,產率80%;1H NMR(400 MHz, CDCl3)δ(ppm)8.35(d,J=15.6 Hz,1H ),7.90(d,J=16.0 Hz,1H ),7.85~7.83(m,1H),7.45~7.43(m,1H),7.34~7.30(m,2H),2.63 (s,3H),2.30(s,3H)。
1d,黃色晶體,產率77%;1H NMR(400 MHz, CDCl3)δ(ppm)7.84~7.83(m,2H),7.59~7.57(m,2H),7.38~7.35(m,2H),2.60(s,3H),2.28(s, 3H)。
1e,黃色晶體,產率75%;1H NMR(400 MHz,CDCl3)δ(ppm)7.89(d,J=15.6 Hz,1H ),7.82(d,J=16.0 Hz,1H ),7.56~7.26(m,4H),2.62(s,3H),2.30(s, 3H)。
1f,黃色晶體,產率83%;1H NMR(400 MHz, CDCl3)δ(ppm)7.84~7.82(m,2H ),7.54~7.52(m,2H),7.19~7.17(m,2H),2.58(s,3H),2.36(s,3H)2.27(s,3H)。
1g,黃色晶體,產率65%;1H NMR(400 MHz,CDCl3)δ(ppm)7.86(d,J=16.0 Hz,1H ),7.74(d,J=15.6 Hz,1H ),7.63~7.60(m,2H),6.93~6.89(m,2H),3.84(s,3H),2.61(s,3H), 2.29(s,3H)。
1h,黃色晶體,產率62%;1H NMR(400 MHz,CDCl3)δ(ppm)7.74(d,J=16.0 Hz,1H ),7.64(d,J=15.6 Hz,1H ),7.541~7.539(m,1H),6.74(d,J=3.2 Hz,1H)6.51~6.50(m,1H), 2.62(s,3H)2.30(s,3H)。
1i,黃色晶體,產率60%;1H NMR(400 MHz,CDCl3)δ(ppm)8.75(d,J=15.6 Hz,1H ),8.24(d,J=8.8 Hz,1H),7.96(d,J=22.8 Hz,1H),7.95(s,1H),7.88(d,J=8.4 Hz,1H),7.84(d,J=8.4 Hz,1H)7.56(t,J=7.6 Hz,1H),7.52~7.45(m,2H),2.62(s,3H),2.28(s,3H)。
1.2.2 α,β-不飽和酰基吡唑與α-硝基乙酸酯的Michael加成反應
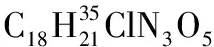
化合物3ab-3ai, 3ba按照類似方法合成。
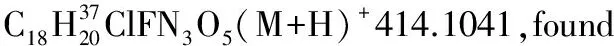
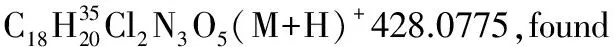
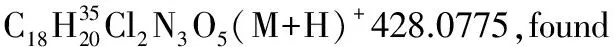
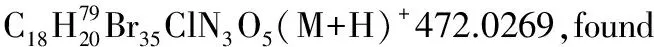
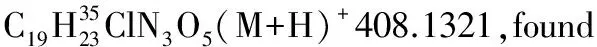
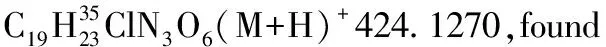
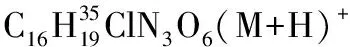

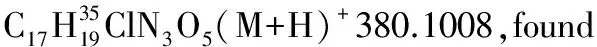
1.2.3 加成產物的醇解[22]

將3aa (39.3 mg, 0.1 mol)溶于甲醇(0.2 mL)中,然后加入DBU(10 μL,0.67 mol),并在30 ℃下攪拌過夜。薄層色譜顯示3aa完全轉化后,減壓蒸除溶劑,殘余物經乙酸乙酯/石油醚體系柱層析后得到白色固體27.0 mg, 產率96%, dr值為1∶1。1H NMR(400 MHz,CDCl3)δ(ppm)7.31~7.26(m,10H),5.55(d,J=10.0 Hz,1H), 5.47(d,J=8.8 Hz,1H),4.23~4.20(m,2H),3.84(s,3H),3.61(s,3H),3.59(s,3H),3.58(s,3H),3.00~2.81(m,4H);13C NMR(100 MHz,CDCl3)δ(ppm)170.8,170.7,163.8,163.4,137.0,136.1,129.0,128.33,128.29,128.1,127.9,91.0,90.9,53.7,53.5,51.95,51.92,42.6,42.4,36.7, 36.4;ESI-HRMS:calcd.for C13H16NO6(M+H)+282.0972,found 282.0975。
2 結果與討論
α-硝基乙酸酯與α,β-不飽和酰基吡唑的Michael加成反應:
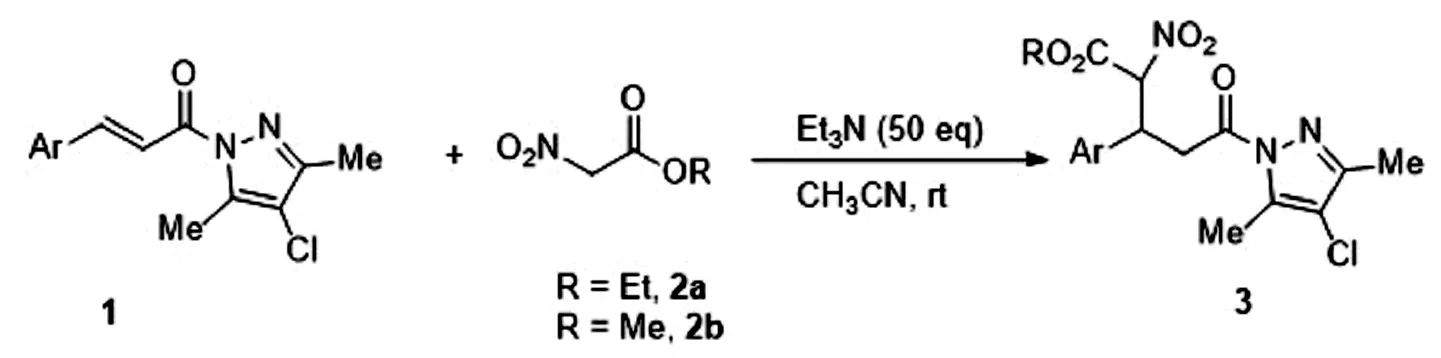
α-硝基乙酸酯與α,β-不飽和酰基吡唑的Michael加成反應條件及收率見表1。
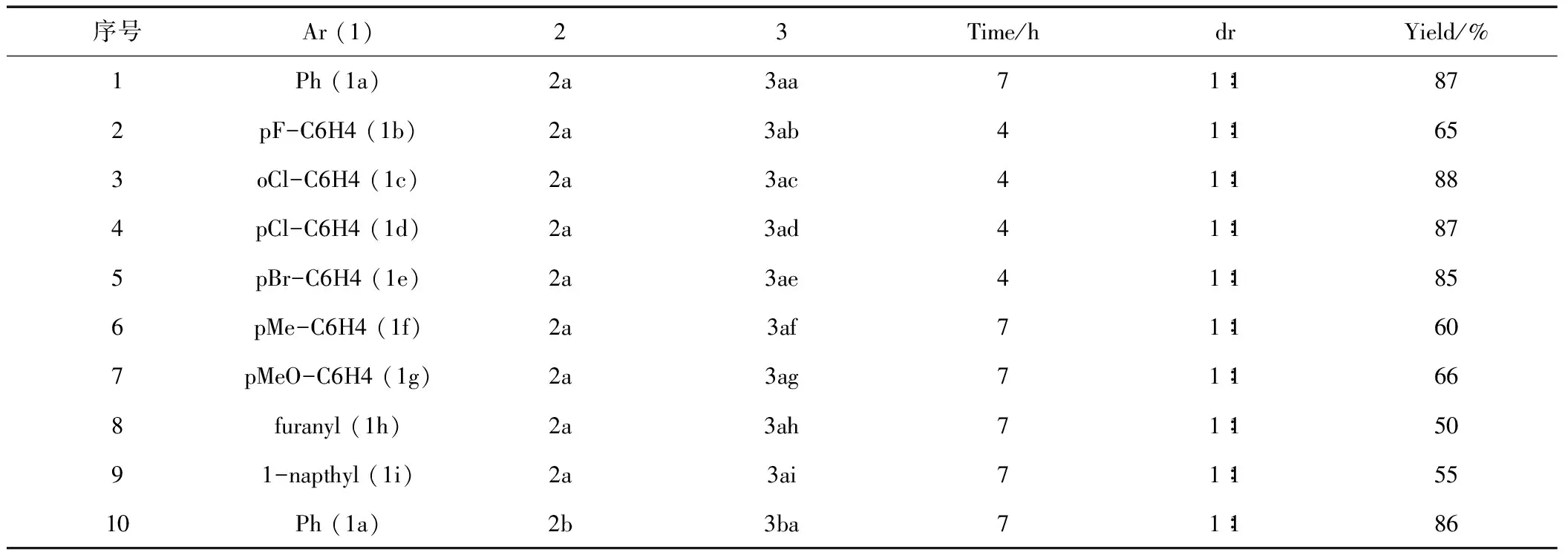
表1 α-硝基乙酸酯與α,β-不飽和酰基吡唑的Michael加成反應Tab.1 Michael addition of α,β-unsaturated pyrazolamides and α-nitroacetate.
雖然早期的研究表明,α,β-不飽和酰基吡唑在Michael加成反應中活性較低;然而我們發現,如果選用活性較高的α-硝基乙酸酯作為給體,相應的Michael加成能夠順利進行,在三乙胺的催化下在較短的時間內以中等及以上產率(50%~88%)得到加成產物。反應表現出較好的底物適應性,各種電子性質的α,β-不飽和酰基吡唑都能順利參與加成反應,只是富電子的酰基吡唑1f-1g活性比貧電子的酰基吡唑1b-1e活性略低,相應的共軛加成反應需要更長的反應時間(entries 6 and 7 vs entries 2-5)。含有雜芳基的化合物1h也能作為受體參與加成反應,只是呋喃環較大的電子云密度導致了較低的反應活性(entry 8)。含有萘環的酰基吡唑1i也是合適的受體,反應較低的轉化率可能是萘環的位阻所致(entry 9)。除α-硝基乙酸乙酯2a,α-硝基乙酸甲酯2b也能夠順利參與反應(entry 10)。
加成反應得到的產物是有用的合成子,能夠轉化為其它的功能分子。在DBU的作用下,化合物3aa順利發生醇解反應,以較高的產率轉化為γ-位官能化的酯4(eq 3)。
3 結論
綜上所述,我們成功地發展了α,β-不飽和酰基吡唑與α-硝基乙酸酯的Michael加成反應。反應表現出較好的底物適應性,一系列不同類型的α,β-不飽和酰基吡唑都能夠順利與α-硝基乙酸酯發生共軛加成。產物的結構都經過1H-NMR、13C-NMR和HRMS驗證。得到的產物在溫和的條件下即轉化為有用的功能分子。目前我們課題組正在嘗試發展相應的不對稱合成方法,期待能夠高對映選擇性地構建一系列γ-取代的羧酸衍生物。
[1] Sibi MP,Manyem S. Enantioselective conjugate additions[J].Tetrahedron,2000,56(41):8033-8061.
[2] Christoffers J,Koripelly G,Rosiak A,R?ssle M.Recent advances in metal-catalyzed asymmetric conjugate additions[J].Synthesis,2007(9):1279-1300.
[3] Almasi D, Alonso DA,Najera C.Organocatalytic asymmetric conjugate additions[J].Tetrahedron:Asymmetry,2007,18(3):299-365.
[4] Xu L W,Luo J,Lu Y.Asymmetric catalysis with chiral primary amine-based organocatalysts[J].Chemical Communications,2009(14):1807-1821.
[5] Berner O M,Tedeschi L,Enders D.Asymmetric michael additions to nitroalkenes[J].European Journal of Organic Chemistry,2002,2002(12): 1877-1894.
[6] Desimoni G,Faita G,Quadrelli P.Substituted (E)-2-Oxo-3-butenoates:Reagents for every enantioselectively-catalyzed reaction[J].Chemical Reviews,2013,113(8): 5924-5988.
[7] Desimoni G,Faita G,Quadrelli P.Enantioselective catalytic reactions with N-acyliden penta-atomic aza-heterocycles. heterocycles as masked bricks to build chiral scaffolds[J].Chemical Reviews,2015,115(18):9922-9980.
[8] Sibi M P,Itoh K.Organocatalysis in conjugate amine additions.Synthesis of β-amino acid derivatives[J].Journal of the American Chemical Society,2007,129(26): 8064-8065.
[9] Dong X Q,Fang X,Tao H Y,et al.Highly efficient catalytic asymmetric sulfa‐michael addition of thiols to trans‐4, 4, 4‐trifluorocrotonoylpyrazole[J].Advanced Synthesis & Catalysis,2012,354(6):1141-1147.
[10] Singh A,Yoder R A,Shen B,et al.Chiral proton catalysis:enantioselective br?nsted acid catalyzed additions of nitroacetic acid derivatives as glycine equivalents[J]. Journal of the American Chemical Society,2007,129(12):3466-3467.
[11] Singh A,Johnston J N.A diastereo- and enantioselective synthesis of α-substituted syn-α,β-diamino acids[J].Journal of the American Chemical Society,2008,130(18):5866-5867.
[12] Shen B,Johnston J N.A formal enantioselective acetate mannich reaction: the nitro functional group as a traceless agent for activation and enantiocontrol in the synthesis of β-amino acids[J].Organic Letters,2008,10(20):4397-4400.
[13] Lu R-j,Wei W-t,Wang J-j,et al.Organocatalytic conjugate addition of α-nitroacetates to β,γ-unsaturated α-keto esters and subsequent decarboxylation:synthesis of optically active δ-nitro-α-keto esters[J].Tetrahedron,2012,68(46):9397-9404.
[14] Wang Q,Gong J,Liu Y,et al.Chiral bifunctional squaramide catalyzed asymmetric Michael addition of ethyl α-nitroacetate to β,γ-unsaturated α-ketoesters[J].Tetrahedron,2014,70(43):8168-8173.
[15] Liu R l,Yan Y y,Zhang T,et al.A practical synthesis of optically active δ-nitro-α-ketoesters and 4-cyclohexyl-proline catalyzed by chiral squamides[J].Tetrahedron: Asymmetry,2015,26(24):1416-1422.
[16] Shirakawa S,Terao S J,He R,et al.Diastereo- and enantioselective conjugate addition of [small alpha]-substituted nitroacetates to maleimides under base-free neutral phase-transfer conditions[J].Chemical Communications,2011,47(38):10557-10559.
[17] Liu R l,Tang X Z,Zhang X J,et al.Organocatalytic asymmetric conjugate addition of t-butyl nitroacetate to o-quinone methides:synthesis of optically active [small alpha]-nitro-[small beta],[small beta]-diaryl-propionates[J].RSC Advances,2017,7(11):6660-6663.
[18] Han M Y, Zhang Y,Wang H Z,et al.Organocatalytic michael addition of nitro esters to α,β-unsaturated aldehydes: towards the enantioselective synthesis of trans-3-substituted proline derivatives[J].Advanced Synthesis & Catalysis,2012,354(14-15):2635-2640.
[19] Liu C,Lu Y.Primary amine/(+)-CSA salt-promoted organocatalytic conjugate addition of nitro esters to enones[J].Organic Letters,2010,12(10):2278-2281.
[20] Zheng Y,Yao Y,Ye L,et al.Highly enantioselective michael addition of malononitrile to α,β-unsaturated pyrazolamides catalyzed by a bifunctional thiourea[J].Tetrahedron,2016,72(7):973-978.
[21] Zhang J,Liu X,Wang R.Magnesium complexes as highly effective catalysts for conjugate cyanation of α, β‐unsaturated amides and ketones[J].Chemistry- A European Journal,2014,20(17):4911-4915.
[22] Yao Q,Wang Z,Zhang Y,et al.N, N'-Dioxide/gadolinium (III)-catalyzed asymmetric conjugate addition of nitroalkanes to alpha, beta-unsaturated pyrazoleamides[J]. Journal of Organic Chemistry,2015,80:5704-5712.

