升金湖濕地保護區表層沉積物中持久性有機污染物殘留特征
李勝生,譚 浩,陳園園,余 興,黃 勤
(1.安徽省地質實驗研究所,安徽合肥 230001;2.安徽大學資源與環境工程學院,安徽合肥 230601)
持久性有機污染物(POPs)是指具有長期殘留性、生物蓄積性、半揮發性和高毒性,能夠在大氣環境中長距離遷移并能沉積回地球,對人類健康和環境具有嚴重危害的天然或人工合成的有機污染物質[1]。其中,多環芳烴(PAHs)、多氯聯苯(PCBs)和有機氯農藥(OCPs)是3種廣泛分布于環境中的代表性POPs。PAHs的疏水親脂特性使得它們在水體中的含量較低,會強烈地分配到非水相,特別是有機相中。大部分被水體中的懸浮顆粒物吸附,并迅速進入沉積環境,因此,水體沉積物被認為是PAHs的蓄積庫[2]。土壤和底泥中的PCBs釋放到水體,水體和土壤中的PCBs揮發到大氣,大氣中PCBs通過濕沉降和干沉降再沉降到土壤和地表水,沉積物被認為是它們的主要環境歸宿之一[3]。OCPs由于其歷史上的大量施用,至今仍在多種環境介質中廣泛殘留[4]。OCPs可以通過地表徑流、大氣沉降等途徑進入水體。由于其所具有的親脂疏水特性,OCPs主要吸附在懸浮顆粒物表面,并最終通過沉降作用進入沉積物,故而沉積物被認為是水環境中OCPs重要的歸宿之一[5-6]。沉積物中的OCPs一方面可通過解吸和再懸浮作用重新進入水體,造成二次污染[7];另一方面則可通過食物鏈的富集和逐級放大作用,對人類和生物產生不良影響。因此,研究沉積物中OCPs的殘留分布狀況對了解水體的污染情況以及OCPs在水環境中的行為具有重要意義[8-10]。
升金湖是長江中下游重要的湖泊濕地之一,也是澳大利亞遷徙水鳥的重要越冬地和停歇地,具有重要的生態地位和國際影響。1986年被列為國家重點水禽自然保護區,1988年被編入《亞洲重要濕地名錄》,1986年經安徽省人民政府批準建立省級自然保護區,1992年被國家林業部和世界自然基金會(WWF)列為中國40個具有國際意義的自然保護區之一[11-12],1997年晉升為國家級自然保護區,主要保護對象為白頭鶴等越冬珍禽及濕地生態系統。隨著區域社會經濟的快速發展,人類通過直接和間接方式對保護區產生不同程度的干擾,從而對保護區生態環境及其自然資源產生影響。其中,包括當地人在升金湖周圍進行農業活動,施加化肥農藥等外源物質,導致其在土壤及湖泊沉積物中的遷移轉化和沉淀積累。目前,有關升金湖濕地環境污染現狀問題的研究還非常有限,因此,筆者以升金湖湖泊濕地表層沉積物為研究對象,分析其中PAHs、PCBs和OCPs的含量、殘留特征及其來源,評價其污染水平,為升金湖濕地自然保護區環境狀況提供基礎數據,以便升金湖濕地生態系統得到更好的保護與利用。
1 材料與方法
1.1研究區概況升金湖自然保護區位于安徽省南部池州市境內,瀕臨長江,地處116°55′~117°15′ E、30°15′~30°30′ N,總面積33 340 hm2,其中升金湖13 300 hm2,屬亞熱帶季風氣候,年平均氣溫16.1 ℃,最熱月7月平均氣溫28.2 ℃,最冷月1月平均氣溫3.9 ℃,無霜期240 d,年降水量1 600 mm。升金湖水源主要來自地表徑流、張溪河及唐田河,豐水期湖面最高水位17.03 m時,蓄水量可達8.3億m3。湖水經黃湓閘與長江相通。升金湖周圍無工業污染源[13-14]。
1.2樣品采集與處理樣品采集于2016年11月份(枯水期),采樣布點如圖1所示,由于枯水期上湖部分湖區水位太淺,船不能至,一些計劃點位樣品未能采集,此次共采集到表層樣品37個。采樣時,利用彼得森采泥器在每個樣點采集3份平行樣,混合成一個點位樣品。采集的樣品在安徽大學升金湖定位研究站冷凍后運回學校。樣品經冷凍干燥后繼續冷凍保存,直至試驗分析開始。
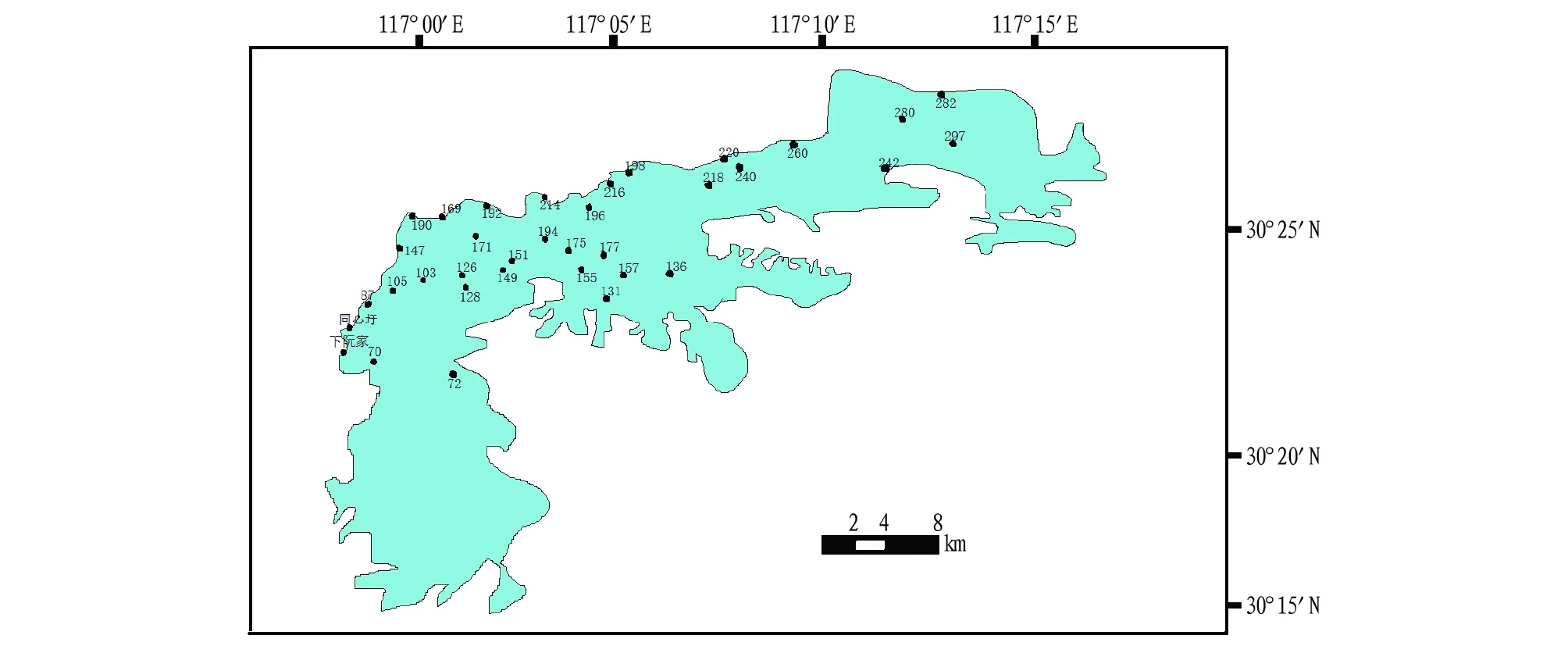
圖1 升金湖表層沉積物采樣點分布Fig.1 Distribution of sampling points of surface sediments in Shengjin Lake
1.3分析方法
1.3.1提取方法。準確稱取冷凍干燥樣品10.00 g和硅藻土4.00 g,攪拌均勻,無損轉入濾紙筒內,濾紙筒的上部蓋一片濾紙,將濾紙筒裝入索氏提取器中,正己烷∶丙酮(1∶1)溶液80 mL提取,其中50 mL溶劑加入平底燒瓶中,索氏提取器中20 mL浸泡樣品12 h后,在70 ℃恒溫水浴鍋中提取8 h。提取液經水洗、旋轉蒸發、氮吹后定容至10 mL,分成2份,一份為正己烷相供氣相色譜測定,另一份換相成乙腈相供高效液相色譜測定。
1.3.2凈化方法。OCPs和PCBs采用弗羅里硅土柱凈化法:凈化柱依次填充2 g無水硫酸鈉、8 g弗羅里硅土、3 g無水硫酸鈉。用9∶1(V∶V)正己烷∶丙酮溶液預淋洗凈化柱,當淋洗液接近上層無水硫酸鈉層時將樣品溶液轉移到凈化柱上,淋洗過程保持一定的流速,收集的淋洗液經旋轉蒸發和氮吹定容至1 mL,供氣相色譜分析測定OCPs。
硅膠凈化柱法:凈化方法同上。
1.3.3儀器條件。
1.3.3.1OCPs和PCBs的測定條件。Varian CP-3800,電子捕獲檢測器,進樣口溫度220 ℃,檢測器溫度300 ℃,色譜柱流量1.0 mL/min,不分流進樣。柱升溫程序為:120 ℃保持3 min,以4 ℃/min速率升溫至220 ℃,保持5 min,以3 ℃/min速率升溫至280 ℃,再以50 ℃/min速率升溫至300 ℃,保持3 min。
1.3.3.2PAHs[苯并(a)芘]的測定條件。Agilent 1200,配熒光檢測器(激發波長294 nm,發射波長430 nm)和紫外檢測器(254 nm),色譜柱HPLC-Cartridge 250-3 PAH、5 μm,流動相為乙腈∶水,流速為0.6 mL/min。
2 結果與分析
2.1升金湖湖泊沉積物中的PAHs
2.1.1PAHs的含量與分布特征。在36份樣品中,只檢出一種PAHs——苯并(a)芘[B(a)P]。B(a)P濃度為0.19~2.43 ng/g(表1),均值為(1.01±0.54)ng/g。B(a)P在沉積物中的含量比水相中的大得多,且在兩相中的分布動態平衡。所以,若沉積物中B(a)P的含量過高,說明水體有很強的潛在危害性,沉積物中B(a)P污染風險的評價更能反映實際的污染和危害程度。根據美國佛羅里達州的海洋及河口沉積物化學品風險評價標準,該標準包括指標低效應值(effect range-low,ERL)和中等效應值(effect range-median,ERM),ERL=430 ng/g、ERM=1 600 ng/g。當沉積物中B(a)P濃度(C)<430 ng/g時,認為對生物極少產生負效應;當430 ng/g≤C≤1 600 ng/g時,認為對生物可能產生負效應;當C>1 600 ng/g時,認為對生物經常產生負效應[15]。而升金湖湖泊沉積物中的B(a)P含量遠遠低于ERL,故可認為其不會對升金湖生物造成負效應。
表1升金湖湖泊沉積物中苯并(a)芘的含量
Table1ContentofBenzo(a)pyreneinsedimentsfromShengjinLake

序號No.采樣點Samplingpoint苯并(a)芘含量Benzo(a)pyrenecontent∥ng/gY170—Y272—Y387—Y41031.27Y51051.60Y61261.74Y71280.81Y81341.79Y91361.94Y101471.47Y111490.87Y121512.43Y131550.54Y141571.14Y151691.00Y161710.50Y171730.63Y181751.34Y191770.92Y201900.68Y211921.14Y221940.79Y231960.90Y24198—Y25214—Y26216—Y27218—Y282200.63Y292400.35Y302420.19Y312600.57Y322800.41Y33282—Y34297—Y35下阮家0.78Y36同心圩0.93檢出限Detectionlimit∥ng/g1.00
注:“—”表示未檢出,檢測值小于檢出限的僅供參考,稱樣量未標注的均為10 g
Note:"-" means no detection,the detection value is less than the detection limit for reference only,and the unlabeled samples are all 10 g
2.1.2PAHs的組成和來源。在樣品中未檢測到其他種類的PAHs。B(a)P是PAHs中最有代表性的強致癌稠環芳烴,容易在人體內積累,導致肺癌、胃癌、皮膚癌等癌病變。它是自然界固有的有機化合物之一,火山爆發、森林草原天然燃燒和生物合成是它的天然來源;各種礦物燃料(如煤、石油、天然氣等)、木材、紙以及其他含碳氫化合物的物質的不完全燃燒或在還原條件下熱解產生大量B(a)P是它的人為來源。升金湖湖泊沉積物中的B(a)P含量水平并不高,其來源主要是近岸污水排放和周圍村民生活中對煤等燃料的利用。
2.2升金湖湖泊沉積物中的PCBs
2.2.1PCBs的含量與分布特征。從升金湖湖泊沉積物中PCBs的組成及含量(表2)可看出,PCBs總量為0.14~5.71 ng/g,平均值為(1.10±1.14)ng/g(n=37)。PCBs集中分布于中湖區,在上湖區和下湖區基本沒有檢測到PCBs。從含量上看,升金湖沉積物中的PCBs水平較低。根據沉積物中POPs環境質量標準,當沉積物中PCBs含量小于其低毒性效應值(ERL)時,生態風險小于10%;當沉積物中PCBs含量大于其毒性效應中值(ERM)時,生態風險大于75%。其中,ΣPCBs的ERL值和ERM值分別為22.7、180.0 ng/g[16]。可見,升金湖湖泊沉積物中ΣPCBs遠小于其ERL值,生態風險很小。

表2 升金湖湖泊沉積物中多氯聯苯的含量
注:“—”表示未檢出,檢測值小于檢出限的僅供參考,稱樣量未標注的均為10 g
Note:"-" means no detection,the detection value is less than the detection limit for reference only,and the unlabeled samples are all 10 g
2.2.2PCBs的組成和來源。沉積物中PCBs的組成為PCB 028和PCB 101,均屬于低氯代PCBs,其中又以PCB 101占多數(占63%)。由于升金湖周圍沒有工業污染源,所以沉積物中的PCBs主要是由周圍村民在生產生活中對于含PCBs物品的使用和使用過后對其不合理的處置所造成。
2.3升金湖湖泊沉積物中的OCPs
2.3.1OCPs的含量與分布特征。沉積物是OCPs主要環境歸宿之一,在一定程度上,表層沉積物OCPs的含量反映當地的OCPs污染狀況[17]。此次研究采集的樣品中,能檢測到的OCPs為七氯和DDT(表3),而在所有的樣品中,均未檢測到HCHs的存在。
樣品中OCPs以滴滴涕(DDTs)和七氯為主。在沉積物樣品中,七氯濃度為0.14~2.21 ng/g,均值為(1.13±0.05)ng/g(n=35);DDT濃度為0.15~1.39 ng/g,均值為(0.50±0.27)ng/g(n=35);DDE濃度為(0.26~4.70)ng/g,均值為(1.99±1.19)ng/g(n=35)。
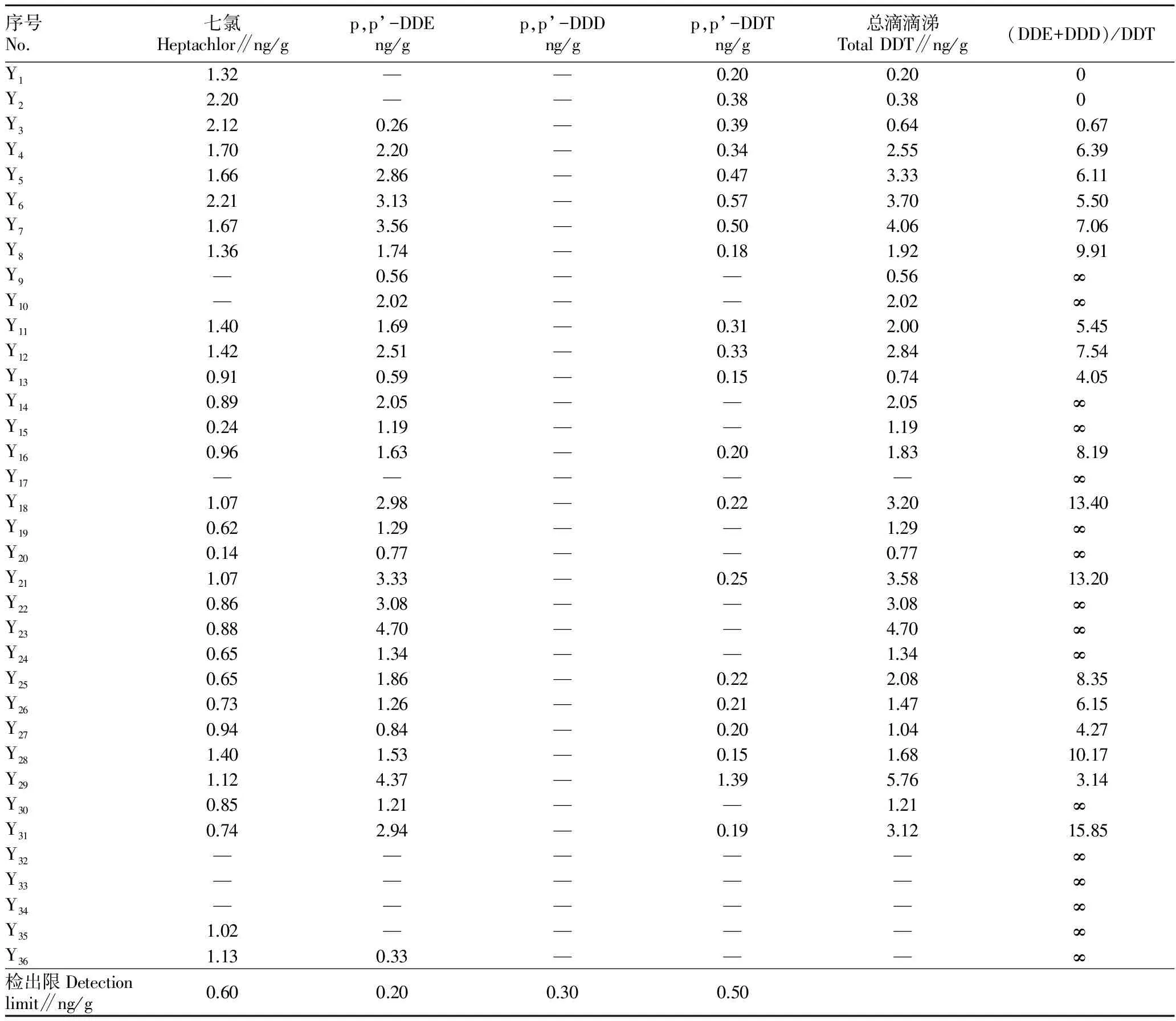
表3 升金湖湖泊沉積物中有機氯農藥的含量
注:“—”表示未檢出,檢測值小于檢出限的僅供參考,稱樣量未標注的均為10 g
Note:"-" means no detection,the detection value is less than the detection limit for reference only,and the unlabeled samples are all 10 g
從空間分布上看,升金湖濕地表層沉積物中ΣOCPs含量最高值出現在中湖(Y29,6.98 ng/g),最低值在下湖(未檢出OCPs)。從OCPs的平均水平來看,上湖最高(3.17 ng/g),其次是中湖(2.98 ng/g),下湖中基本沒有檢出OCPs。可見,相對水平而言,升金湖濕地表層沉積物中OCPs含量由北向南逐漸減弱。造成這一現象的原因可能是由于升金湖北部區域所進行的農業活動中施用了更多的OCPs,而隨著時間推移使其更多地殘留在湖泊表層沉積物中。
不同于我國和世界上其他一些湖泊及其他水體(表4),升金湖湖泊沉積物中未檢測到HCHs,同時DDTs含量明顯低于洪湖、太湖,與鄱陽湖相近,而高于黃河濕地孟津段。這種OCPs含量的區域差異反映了人類活動強度、工業化程度對自然環境的影響,升金湖濕地保護區與扎龍濕地、鄱陽湖均處于人類活動強度較小、工農業較不發達的地區,其沉積物中DDTs、HCHs含量明顯低于人類活動較頻繁地區(Ontario湖、洪湖和太湖等)。總體來看,升金湖濕地保護區有機氯農藥污染處于較低水平。
表4不同地區湖泊表層沉積物中DDTs和HCHs的分布狀況
Table4DistributionsofDDTsandHCHsinsurfacesedimentsfromdifferentlakesintheworld
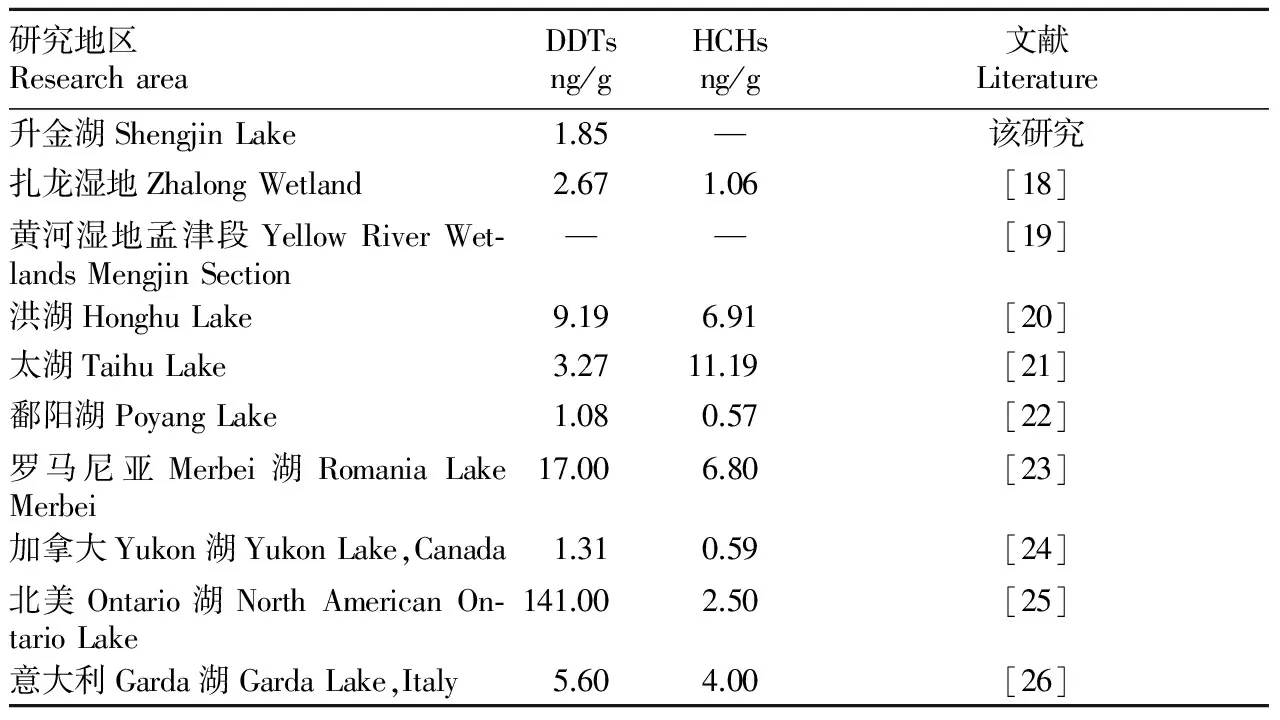
研究地區ResearchareaDDTsng/gHCHsng/g文獻Literature升金湖ShengjinLake1.85—該研究扎龍濕地ZhalongWetland2.671.06[18]黃河濕地孟津段YellowRiverWet?landsMengjinSection——[19]洪湖HonghuLake9.196.91[20]太湖TaihuLake3.2711.19[21]鄱陽湖PoyangLake1.080.57[22]羅馬尼亞Merbei湖RomaniaLakeMerbei17.006.80[23]加拿大Yukon湖YukonLake,Canada1.310.59[24]北美Ontario湖NorthAmericanOn?tarioLake141.002.50[25]意大利Garda湖GardaLake,Italy5.604.00[26]
注:“—”表示未檢出
Note:"-" indicates no detection
2.3.2OCPs的組成和來源。
2.3.2.1升金湖湖泊沉積物中DDTs組成特征。DDT是一種廣泛使用的殺蟲劑,目前我國生產的DDT主要是作為生產三氯殺螨醇的中間體存在。工業品DDT主要由p,p′-DDT(>70%)和o,p′-DDT(約15%)組成,而三氯殺螨醇中則是o,p′-DDT 的含量大于p,p′-DDT,環境中的o,p′-DDT較p,p′-DDT更易降解。因此,當環境中o,p′-DDT 含量大于p,p′-DDT,則可判斷其來源于三氯殺螨醇[27]。由表3可知,樣品中所檢出DDT均為p,p′-DDT,表明升金湖湖泊沉積物中DDT污染并非來自三氯殺螨醇的使用。
DDT在環境中,可在好氧條件下脫氯化氫氧化生成DDE,在厭氧環境中脫氯還原生成DDD。相較于DDT,代謝產物DDE和DDD容易在環境介質內殘留和累積。因此,隨著時間的推移,環境介質中的DDT代謝產物之間的比例會發生變化,表現為DDT百分含量的減少和DDE、DDD的增加。一般研究使用(DDE+DDD)/DDT的比值大小來判斷DDT的使用時間,比值<0.5表示該處近期有DDT的輸入,比值>0.5說明DDT主要為歷史殘留[28]。而從所得數據中易知,(DDE+DDD)/DDT的比值均大于0.5(表3),說明沉積物中DDT已大部分降解轉化為DDE,DDT主要來源于早期殘留,近期基本無新的DDT污染源輸入。
2.3.2.2升金湖湖泊沉積物中的七氯。七氯作為一種OCPs,同時也是一種POPs。盡管七氯所受關注遠不及DDTs等應用更為廣泛的化合物,但由于其高度的持久性和潛在危害,仍然被列入《關于持久性有機污染物的斯德哥爾摩公約》中的首批名單。七氯自1952年在美國第一次注冊成為殺蟲劑并進行商業化生產以來,科學家逐漸認識到其致癌活性和食物鏈富集趨勢。為此,美國環保局于1974年禁止七氯生產,并于1988年禁止所有剩余七氯和含七氯的氯丹產品銷售。作為廣譜性殺蟲劑,七氯主要用于噴灑或玉米、谷物、高粱等作物的拌種,借以殺滅土壤中的螞蟻、毛蟲、蛆、白蟻、牧草蟲、象鼻蟲及線蟲,也用于建筑物殺滅白蟻。我國環境中的七氯更多地源于氯丹施用,商品氯丹中通常含有相當的七氯(體積分數約10%),這些七氯通過施用氯丹直接進入土壤,并長期殘留。我國從20世紀80年代起禁用七氯[29]。與其他有機氯農藥類似,七氯通過農業施用進入環境的途徑因禁用而被切斷,但由于半衰期長達2年,在環境中仍會殘留較長時間,繼續危害生態系統乃至人體健康。除自身影響外,進入環境的七氯還可能轉化為毒性相仿的七氯環氧化物而構成持續威脅。
升金湖表層沉積物中所檢出的七氯分布廣泛,幾乎在所有采樣點都有檢出。另外,下湖區的七氯檢出量較之中湖、上湖更大,可能是由于下湖周邊的農業活動中氯丹類農藥產品的施用量更大。因七氯并非是最重要的持久性有機污染物,其相關資料不多。因此,該研究區域中七氯殘留的原因值得進一步探究,同時應加強對七氯的監測。
3 結論
升金湖表層沉積物中多環芳烴主要是苯并(a)芘,濃度為0.19~2.43 ng/g,均值(1.01±0.54)ng/g(n=36),來源主要是近岸污水排放和周圍村民生活中對煤等燃料的利用;多氯聯苯濃度為0.14~5.71 ng/g,平均值為(1.10±1.14)ng/g(n=37),來源主要是周圍村民在生產生活中對于含PCBs物品的使用和使用過后對其不合理的處置;有機氯農藥檢出七氯和DDTs(包括p,p′-DDT和p,p′-DDE)2類,其中DDT濃度為0.15~1.39 ng/g,均值為(0.50±0.27)ng/g(n=35);DDE濃度為0.26~4.70 ng/g,均值為(1.99±1.19)ng/g(n=35);七氯濃度為0.14~2.21 ng/g,均值為(1.13±0.05)ng/g(n=35)。未檢測到另一類主要OCPs類污染物HCHs,DDTs和七氯主要來源于早期有機氯類農藥的施用。作為保護白頭鶴等越冬珍禽及濕地生態系統的國家級自然保護區,升金湖濕地的持久性有機污染物污染處于較低水平,生態風險水平較低。
[1] 余剛,黃俊,張彭義.持久性有機污染物:倍受關注的全球性環境問題[J].環境保護,2001(4):37-39.
[2] 舒衛先,李世杰.太湖流域典型湖泊表層沉積物中多環芳烴污染特征[J].農業環境科學學報,2008,27(4):1409-1414.
[3] 彭全材,胡繼偉,楊占南,等.長江源頭典型湖泊表層沉積物中多氯聯苯殘留狀況[J].江西師范大學學報(自然科學版),2008,32(1):98-101,107.
[4] 王雁,何偉,秦寧,等.巢湖表層沉積物中有機氯農藥的殘留與風險[J].環境科學學報,2012,32(2):308-316.
[5] PARK J S,WADE T L,SWEET S.Atmospheric deposition of organochlorine contaminants to Galveston Bay,Texas [J].Atmospheric environment,2004,35(19):3315-3324.
[6] 袁旭音,王禹,陳駿,等.太湖沉積物中有機氯農藥的殘留特征及風險評估[J].環境科學,2003,24(1):121-125.
[7] 王曉蓉.環境化學[M].南京:南京大學出版社,1994:3.
[8] NELSON C R,HITES R A.Aromatic amines in and near the Buffalo River [J].Environmental science technology,1980,14(9):1147-1149.
[9] STEINHEIMER T R,PEREIRA W E,JOHNSON S M.Application of capillary gas chromatography mass spectrometry/computer techniques to synoptic survey of organic material in bed sediment [J].Analyica chimica acta,1981,l29(1):57-67.
[10] 麥碧嫻,林崢,張干,等.珠江三角洲沉積物中毒害有機物的污染現狀及評價[J].環境科學研究,2001,14(1):19-23.
[11] 程元啟,吳建勛,邵建章.安徽升金湖國家級自然保護區水生植物區系研究[J].安徽師范大學學報(自然科學版),2009,32(3):256-260.
[12] 遲傳德,許信旺,吳新民,等.安徽省升金湖濕地土壤有機碳儲存及分布[J].地球與環境,2006,34(3):59-64.
[13] 許信旺,朱誠,田曉四.升金湖濕地沉積物地球化學特征[J].池州學院學報,2010,24(3):58-61.
[14] 胡文海,俞貴慶,劉政源.升金湖濕地生態環境及其保護[J].國土與自然資源研究,2004(4):70-71.
[15] 周芳,孫成,鐘明.我國水體中苯并(a)芘污染的生態風險評價[J].環境與健康雜志,2005,22(3):163-165.
[16] 何雋杰,陸光華,丁劍楠,等.太湖北部表層沉積物中多環芳烴和多溴聯苯醚及多氯聯苯的分布和來源及生態風險評價[J].環境與健康雜志,2013,30(8):699-702.
[17] 余剛,牛軍峰,黃俊.持久性有機污染物——新的全球性環境問題[M].北京:科學出版社,2005.
[18] 黎冰,解啟來,廖天,等.扎龍濕地表層沉積物有機氯農藥的污染特征及風險評價[J].農業環境科學學報,2013,32(2):347-353.
[19] 肖春艷,邰超,趙同謙,等.黃河濕地孟津段水體及沉積物中有機氯農藥的分布特征[J].環境科學,2009,30(6):1614-1620.
[20] 龔香宜,祁士華,呂春玲,等.洪湖表層沉積物中有機氯農藥的含量及組成[J].中國環境科學,2009,29(3):269-273.
[21] 袁旭音,王禹,陳俊,等.太湖沉積物中有機氯農藥的殘留特征及風險評估[J].環境科學,2003,24(1):121-125.
[22] 黃云,鐘恢明,劉志剛.鄱陽湖沉積物中主要有機氯農藥的殘留特征[J].江西科學,2010,28(3):336-340.
[23] COVACI A,GHEORGHE A,HULEA O,et al.Levels and distribution of organochlorine pesticides,polychlorinated biphenyls and polybrominated diphenyl ethers in sediments and biota from the Danube Delta,Romania[J].Environmental pollution,2006,140(1):136-149.
[24] RAWN D F K,LOCKHART W L,WILKINSON P,et al.Historical contamination of Yukon Lake sediments by PCBs and organochlorine pesticides:Influence of local sources and watershed characteristics[J].Science of the total environment,2001,280(1/2/3):17-37.
[25] OLIVER B G,NIIMI A J.Trophodynamic analysis of polychlorinated biphenyl congeners and other chlorinated hydrocarbons in the Lake Ontario ecosystem [J].Environmental science & technology,1988,22(4):388-397.
[26] BOSSI R,LARSEN B,PREMAZZI G.Polychlorinated biphenyl congeners and other chlorinated hydrocarbons in bottom sediment cores of Lake Garda(Italy)[J].Science of the total environment,1992,121(2):77-93.
[27] LI J,ZHANG G,QI S H,et al.Concentrations,enantiomeric compositions,and sources of HCH,DDT and chlordane in soils from the Pearl River Delta,South China[J].Science of the total environment,2006,372(1):215-224.
[28] 李豐,祁士華,劉佳,等.洪湖濕地鳥類聚集區沉積物中OCPs殘留特征及風險評價[J].環境科學與技術,2014,37(1):183-189.
[29] 李堯,左謙,劉文新,等.河北表層土壤中七氯殘留污染現狀及其空間分異特征[J].農業環境科學學報,2007,26(1):230-234.

