枯水椪柑果肉揮發性物質及萜烯類合成途徑基因表達特征
姚世響 - 曹 琦 謝 姣 鄧麗莉 - 曾凱芳 -
(1. 西南大學食品科學學院,重慶 400715;2. 重慶市特色食品工程技術研究中心,重慶 400715)
枯水常稱粒化,是柑橘的一種常見生理性病害,多發生于采后貯藏中[1]。枯水果實在外觀方面與正常果實并無二致,果皮表面新鮮,但果肉品質顯著劣變,糖酸風味變淡,嚴重時不堪食用。枯水是當前影響柑橘果實貯藏壽命的重要因子,嚴重制約柑橘的商品價值。自1934年報道柑橘枯水至今,已過去80多年,科學家[2-5]從多方面對柑橘枯水進行了研究,但對枯水的發生機制仍無明確結論。
柑橘果肉的香氣物質來源于果實中合成的揮發性物質[6]。目前對不同柑橘果實揮發性物質的分析研究發現萜烯類物質是含量最大的一類[7-8]。對柑橘萜烯類物質代謝途徑的研究是近年的研究熱點[9-10]。盡管柑橘在貯藏后期發生枯水時,會普遍伴隨著香氣物質的變淡,但這種現象缺乏試驗證據的支撐。椪柑(CitrusreticulataBlanco cv. Ponkan)含糖量高、香氣濃郁,深受消費喜愛,在重慶地區有較大面積的栽培[11]。本研究擬以椪柑為試驗材料,運用氣相-質譜(gas chromatography-mass spectrometry, GC-MS)技術和高通量測序技術(RNA-Sequencing, RNA-Seq),分析椪柑枯水時果肉揮發性物質和萜烯類化合物合成相關基因及基因表達的變化模式,探討揮發性物質與椪柑枯水的關系及其機制,對闡明椪柑枯水的發生機制具有重要意義。
1 材料與方法
1.1 材料與試劑
椪柑:2015年12月于重慶市北碚區柑橘果園采收完全成熟的椪柑果實(C.reticulataBlanco cv. Ponkan)。果實在采收后迅速運回實驗室,挑選大小、性狀和色澤一致的果實,經咪鮮胺和2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)保鮮處理后,單果用聚乙烯薄膜套袋后貯藏于冷庫(8~10 ℃)。在貯藏期間,定期取樣觀察枯水發生情況,在貯藏90 d后選擇沒有枯水癥狀的果實作為對照組,橘瓣大部分枯水的果實作為枯水樣品;
癸酸乙酯:>98%,上海西格瑪奧德里奇公司;
甲基叔丁基醚(methyl tert-butyl ether,MTBE):色譜純,上海西格瑪奧德里奇公司。
1.2 儀器與設備
氣相色譜質譜聯用儀:GCMS-QP2010 plus型,日本島津制作所;
真空離心濃縮儀:ZLS-1型,湖南赫西儀器裝備有限公司。
1.3 方法
1.3.1 GC-MS樣品制備 準確稱取1.00 g果肉樣品,研磨成粉末。加入42.5 μg癸酸乙酯(內標)和5 mL MTBE,充分混勻后于低溫超聲60 min[12]。將有機相進行真空離心濃縮,然后用微孔濾膜(直徑0.22 μm)過濾,供上機分析。
1.3.2 氣相-質譜(GC-MS)條件
(1) 氣相:DB-5MS石英毛細管柱(長30 m、內徑0.25 mm、厚0.25 μm)為色譜柱。升溫程序:以3 ℃/min升溫至50 ℃(停留1 min),以2 ℃/min升溫至70 ℃(停留3 min),以3 ℃/min升溫至160 ℃(停留2 min),以8 ℃/min 升溫至220 ℃(停留2 min);高純度氦氣作為載氣,流速為0.80 mL/min);進樣口溫度:250 ℃;采用不分流進樣模式。
(2) 質譜:EI源,接口溫度250 ℃,電子能量70 eV;離子源溫度230 ℃;掃描范圍30~400 (m/z)。
1.3.3 揮發性物質的鑒定與定量 GC-MS獲得的質譜圖基于數據庫(NIST08和NIST08S)進行檢索,對揮發性物質進行鑒定,用內標法對各揮發性組分進行定量。
1.3.4 RNA-Seq分析 椪柑樣品RNA用TRIzol試劑提取。cDNA文庫用Ultra RNA Kit for Illumina試劑盒構建。高通量測序用Illumina Hiseq完成。測序數據用TopHat v 2.0.12軟件與基因組序列進行比對,參考基因組用Citrusclementina數據(https://www.citrusgenomedb.org/analysis/156)。用FPKM(number of fragments per kilobase of transcript sequence per millions base pairs sequenced)表示基因表達水平。
1.4 數據分析與處理
揮發性成分含量的差異顯著性用t檢驗進行統計學判斷(P<0.05)。基因表達數據的差異顯著性用校正的P值進行統計學判斷。用Excel 2010軟件進行作圖。
2 結果與討論
2.1 椪柑果肉揮發性物質組分的鑒定
圖1為果肉正常果實果肉的TIC圖(總離子色譜圖)。由表1可知,本次試驗共鑒定出13種揮發性物質,其中7種萜烯類物質、1種醇類物質、3種醛類物質和2種酯類物質。果肉揮發性物質組分似乎要少于果皮,本課題組用相同的GC-MS條件從椪柑果皮中鑒定了52種揮發性組分[8];另外前人[13-14]在印度東北地區和日本高知縣的椪柑果皮中分別鑒定到37和39種揮發性組分。本研究鑒定的椪柑果肉揮發性物質組分相對較少,可能與果皮和果肉的差異相關,因為果皮油胞層可以大量合成主要成分為揮發性物質的精油;另外也與椪柑果實已經貯藏3個月有關,果實在貯藏中后期揮發性物質含量會逐漸降低,在研究中也觀察到此時椪柑果實香氣較淡。

圖1 椪柑果肉揮發性物質總離子色譜圖
Figure 1 Total ion current chromatogram of volatile compounds in juice sacs of Ponkan fruit
2.2 枯水對椪柑果肉揮發性物質組分及含量的影響
由表1可知,正常和枯水椪柑果肉中的揮發性組分均為13種,組分種類完全相同,表明揮發性物質的組成在枯水時沒有發生改變。正常椪柑果實中萜烯類物質是最主要的揮發性物質,其相對含量高達88%,d-檸檬烯的相對含量為75%,表明d-檸檬烯是椪柑果實中豐度最高的萜烯類揮發性物質組分。這種揮發性物質的組成特征在莽山野柑[6]、檸檬[15]、臍橙[8]和柚類果實[16]也有類似的報道。本研究用內標法對揮發性組分進行定量分析,結果顯示,枯水椪柑果肉的揮發性物質總量僅為正常果實的32%(P<0.05),其中d-檸檬烯含量僅為正常果實的13%(P<0.05)。13種揮發性組分中的5種在枯水時的含量有顯著性變化(P<0.05)。
2.2.1 萜烯類物質 由表1可知,本研究共鑒定到7種萜烯類物質,其中單萜烯類有4種,分別為水芹烯、β-月桂烯、d-檸檬烯和γ-松油烯,倍半萜烯類有3種,分別為α-古巴烯、瓦倫西亞烯和α-芹子烯。這7種萜烯類物在果肉中的相對含量在枯水時降為正常果實的22.1%(P<0.05)。其中單萜烯類物質組分β-月桂烯、d-檸檬烯和γ-松油烯在枯水時含量顯著降低,分別為正常果實的77.3%,13.1%,41.3%,而水芹烯的含量在枯水時沒有明顯改變。倍半萜烯類物質組分瓦倫西亞烯含量在枯水時升高為對照果實的163%(P<0.05),而α-古巴烯和α-芹子烯的含量則沒有發生明顯改變。
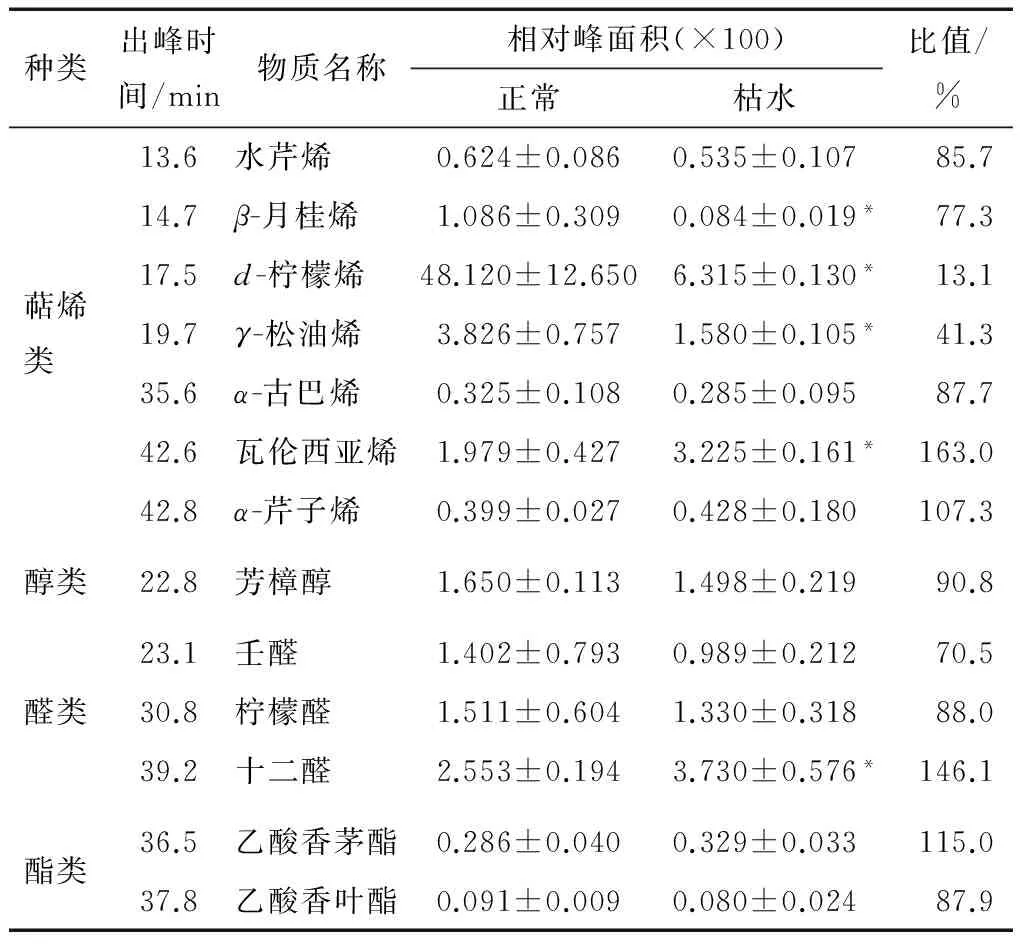
表1 椪柑果肉揮發性物質在正常果實和枯水果實中的含量?Table 1 Contents of volatile compounds in juice sacs from normal or granulated Ponkan fruit
? “*”表示差異顯著,P<0.05。
2.2.2 醇類物質和醛類物質 由表1可知,本研究鑒定到1種醇類物質,即芳樟醇。芳樟醇為萜烯類衍生物,其含量在枯水時降低為正常果實的90.8%,但這種差異并不具備統計學顯著性(P>0.05)。本研究還鑒定并定量了3種醛類物質,相對含量在枯水時為正常果實的110.7%,其中壬醛和檸檬醛含量分別為正常果實的70.5%和88.0%,但這種差異性并沒有統計學意義的顯著性(P>0.05)。十二醛相對含量在枯水時則顯著升高,變為正常果實的146.1%(表1)。
2.2.3 酯類物質 本研究鑒定到2種酯類物質:乙酸香茅酯和乙酸香葉酯。這2種酯類揮發性物質的含量在枯水時分別為對照果實的115.0%和87.9%(P>0.05),因此酯類物質總量在枯水沒有發生顯著性變化(見表1)。
2.3 枯水對椪柑果肉萜烯類合成途徑基因表達的影響
椪柑果肉揮發性物質在枯水時降低為正常果實的32%,其中相對含量為88%的萜烯類物質在枯水時降低為正常果實的22%。這意味著萜烯類物質含量的降低是椪柑果實枯水時揮發性物質含量減少的主要原因。為分析萜烯類化合物含量降低的原因,本研究采用高通量測序技術對椪柑果實枯水時基因的表達特征進行系統分析,共鑒定出8個枯水特異性表達的萜烯類物質合成途徑關鍵酶的編碼基因,表達量均顯著下降,分別是ACAT2(gene encoding acetoacetyl-CoA thiolase,乙酰乙酰輔酶A硫解酶基因)、DXR(gene encoding 1-deoxy-D-xylulose 5-phosphate reductoisomerase,1-去氧-D-木酮糖-5-磷酸還原異構酶基因)、HDS(gene encoding 4-hydroxy-3-methylbut-2-enyl diphosphate synthase,4-羥基-3-甲基-2-丁烯-焦磷酸合成酶基因)、HDR(gene encoding 4-hydroxy-3-methylbut-2-enyl diphosphate reductase,4-羥基-3-甲基-2-鄰苯基二磷酸還原酶基因)、KAO2(gene encoding ent-kaurenoic acid hydroxylase,貝殼杉烯酸羥化酶基因)、KAO3(gene encoding ent-kaurenoic acid hydroxylase,貝殼杉烯酸羥化酶基因)、CYP82G1(gene encoding cytochrome P450 monooxygenase,細胞色素P450單加氧酶基因)、TCS(terpenoidcyclases,萜類環化酶基因)。
2.3.1 萜類骨架代謝合成途徑基因 本研究共鑒定出4個萜烯類骨架代謝合成途徑的差異表達基因,見圖2。萜烯類化合物主要通過甲羥戊酸(Mevalonate,MVA)途徑和2C-甲基-D-赤蘚糖醇-4-磷酸(2C-methyl-D-erythritol 4-phosphate,MEP)途徑合成,異戊烯焦磷酸(isopentenyl pyrophosphate,IPP)和二甲基烯丙基焦磷酸酯(dimethylallyl diphosphate,DMAPP)是萜烯類物質合成的前體。本研究鑒定到基因ACAT2(CICLE_v10015452mg),其編碼的乙酰乙酰輔酶A硫解酶負責在IPP合成途徑中將兩分子乙酰輔酶A合成乙酰乙酰輔酶A。ACAT2在枯水時表達量由正常果實的61.5下降到44.9(P<0.05)。本研究鑒定到一個編碼DXR(1-deoxy-D-xylulose 5-phosphate reductoisomerase,1-去氧-D-木酮糖-5-磷酸還原異構酶)的基因DXR(CICLE_v10028082mg),參與MEP合成途徑。DXR在枯水時表達量顯著下調(P<0.05),由正常果實的207.4下降至枯水果實的99.3。HDS催化 1-羥基-2-甲基-2-丁烯-4-焦磷酸(1-Hydroxy-2-methyl-2-butenyl 4-diphosphate,HMBPP)的合成。本研究鑒定到一個編碼HDS的基因HDS(CICLE_v10027881mg),表達量在枯水時顯著下調(P<0.05),由正常果實的154.5下降至枯水果實的84.8。本研究還鑒定到HDR(CICLE_v10028384mg),編碼的4-羥基-3-甲基-2-鄰苯基二磷酸還原酶參與催化HMBPP生成IPP的反應。HDR在枯水時表達量由正常果實的67.9下降至52.0(P<0.05)。
2.3.2 二萜合成途徑基因 本研究共鑒定出3個二萜合成途徑中的差異表達基因,見圖3。它們分別是編碼貝殼杉烯酸羥化酶(ent-kaurenoic acid hydroxylase,KAO)和細胞色素P450單加氧酶(cytochrome P450 monooxygenase,CYP82G1)的KAO2、KAO3和CYP82G1。這3個基因在枯水時均呈顯著下調的趨勢(P<0.05),表達量從正常果實中的11.0,47.0,113.3下降為枯水果實中的4.9,27.3,48.9。
2.3.3 萜類物質合成途徑其它基因 本研究還鑒定到編碼萜類環化酶(terpenoidcyclases,TCS)的基因TCS,見圖4。萜類環化酶又稱萜類合成酶,是一類包括單萜合成酶、倍半萜合成酶和二萜合成酶在內的一大類酶家族。本研究鑒定的TCS在枯水表達量顯著下降(P<0.05),從正常果實中的5.8下降為枯水果實中的3.2。

圖2 萜烯類骨架代謝合成途徑基因在椪柑果肉 枯水時的表達特征
Figure 2 Changes in expression pattern of genes involved in biosynthesis pathway of terpenoid backbone in pulp of Ponkan fruit during section-drying
果實揮發性物質的含量與其合成和降解速度密切相關,當合成減慢而降解加快時,總量必然減少。本研究基于以上基因表達結果得出結論:萜烯類物質合成途徑在枯水時顯著下調,是椪柑果實香氣喪失和揮發性物質含量降低的重要原因。本研究所鑒定的揮發性物質組分和萜烯類合成途徑差異表達基因的數量分別為13種和8個,數量較少。這可能與試驗樣品有關,果實已經貯藏3個月,香味偏淡,如果比較分析貯藏前與貯藏后的果實,可能會鑒定到更多的揮發性物質種類和萜烯合成相關的差異表達基因。本研究的結果基于貯藏后的正常和枯水果之間的比較,在以后研究中可對果實內部正常汁胞和枯水汁胞進行比較,結果能更好地反映枯水時的生理狀態[17]。
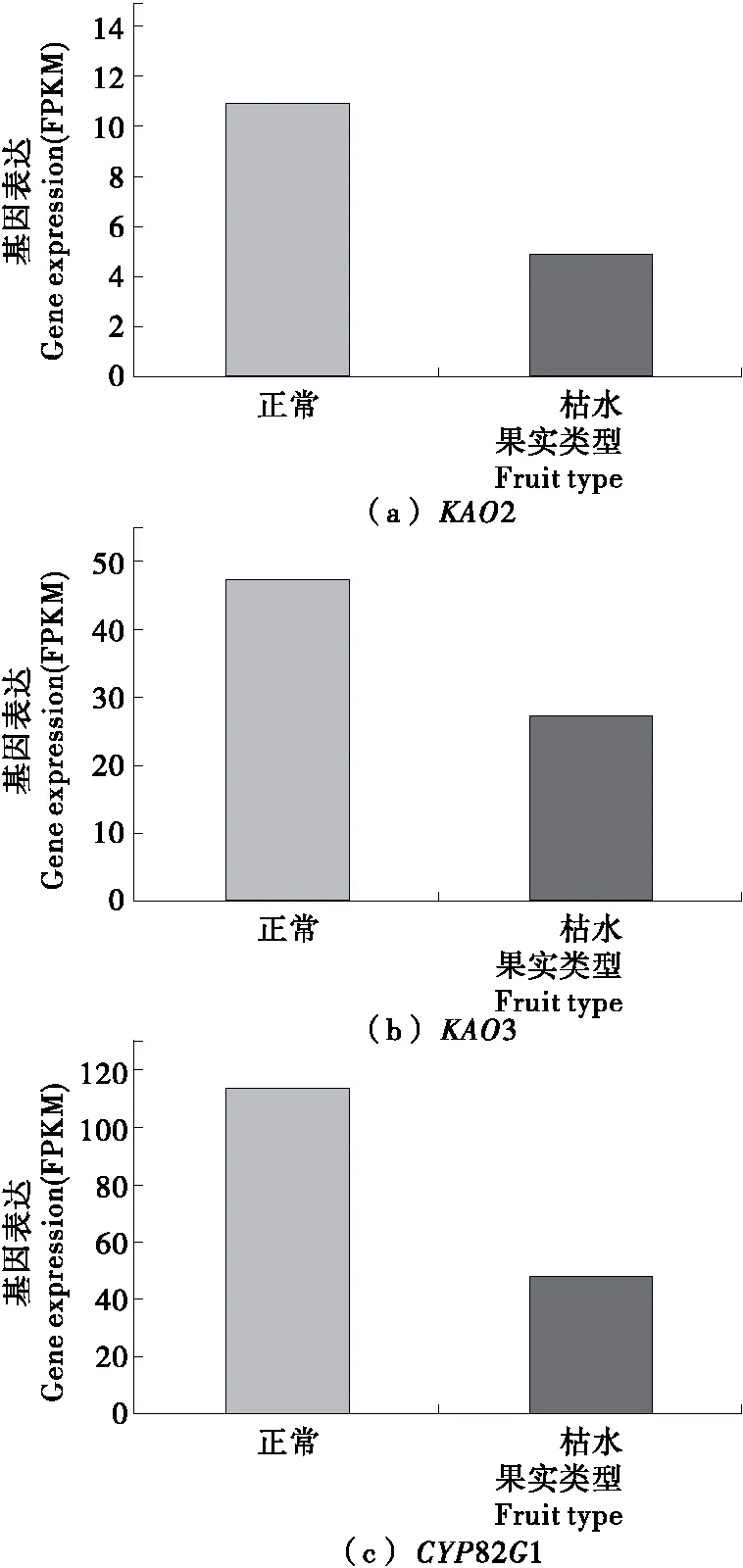
圖3 二萜合成途徑相關基因在椪柑果肉枯水時的表達特征
Figure 3 Changes in expression pattern of genes involved in biosynthesis pathway of diterpenoid in pulp of Ponkan fruit during section-drying

圖4 萜類環化酶基因在椪柑果肉枯水時的表達特征
Figure 4 Change in expression pattern of gene encoding terpenoidcyclases (TCS) in pulp of Ponkan fruit during section-drying
本研究結果為后續深入研究椪柑果實的枯水機制提供了新的思路。一方面,可以從揮發性物質合成途徑的相關基因入手,探討其在枯水時表達量下降的調控機制,可以利用酵母單雜交技術篩選上游轉錄因子,最終解析枯水時揮發性物質合成的分子機制。另一方面,借助高通量代謝組學技術[18],高通量測序技術[19]、鳥槍法蛋白質組學技術[20]等,分析不同椪柑種類中不同枯水程度的汁胞揮發性物質的變化規律、轉錄組和蛋白質組的動態變化模式,在組學水平分析椪柑枯水的分子網絡及調控機制。
3 結論
本研究發現枯水與正常椪柑果實相比,果肉揮發性物質的含量顯著降低,但是組分種類沒有變化。基因表達分析的結果表明萜烯類化合物合成的相關基因(ACAT2、DXR、HDS、HDR、KAO2、KAO3、CYP82G1、TCS)在枯水時表達量下調,意味著萜烯類物質的合成在枯水時受到抑制,這是椪柑枯水時揮發性物質降低的重要原因。本研究揭示了柑橘果肉揮發性物質在枯水時的降解特征,并分析萜烯類物質代謝途徑相關基因的表達特征,初步闡明了椪柑枯水時揮發性物質降低的生物學機制。萜烯類合成途徑相關基因的表達在枯水時為何下降,目前還不清楚,對其調控機制的研究是未來的重點。
[1] RITENOUR M A, ALBRIGO L G, BURNS J K. Granulation in Florida citrus[J]. Proceedings of the Florida State Horticultural Society, 2004, 117: 358-361.
[2] 丁健. 柑橘果實粒化變異體的遺傳背景及其性狀形成的機理研究[D]. 武漢: 華中農業大學, 2009: 17.
[3] WU Jia-ling, PAN Teng-fei, GUO Zhi-xiong, et al. Specific lignin accumulation in granulated juice sacs ofCitrusmaxima[J]. Journal of Agricultural and Food Chemistry, 2014, 62(50): 12 082-12 089.
[4] ZHANG Jing, WANG Miao, CHENG Fan-sheng, et al. Identification of microRNAs correlated with citrus granulation based on bioinformatics and molecular biology analysis[J]. Postharvest Biology and Technology, 2016, 118: 59-67.
[5] BURNS J K, ACHOR D S. Cell-wall changes in juice vesicles associated with section drying in stored late-harvested grapefruit[J]. Journal of the American Society for Horticultural Science, 1989, 114(2): 283-287.
[6] LIU Cui-hua, CHENG Yun-jiang, ZHANG Hong-yan, et al. Volatile constituents of wild citrus Mangshanyegan (CitrusnobilisLauriro) peel oil[J]. Journal of Agricultural and Food Chemistry, 2012, 60(10): 2 617-2 628.
[7] 張涵, 魯周民, 王錦濤, 等. 4種主要柑橘類香氣成分比較[J]. 食品科學, 2017(4): 192-196.
[8] XIE Jiao, DENG Li-li, ZHOU Ya-han, et al. Analysis of changes in volatile constituents and expression of genes involved in terpenoid metabolism in oleocellosis peel[J]. Food Chemistry, 2017, 243: 269-276.
[9] LI Xiang, XU Ya-ying, SHEN Shu-ling, et al. Transcription factor CitERF71 activates the terpene synthase geneCitTPS16 involved in the synthesis of E-geraniol in sweet orange fruit[J]. J Exp Bot, 2017, 68(17): 4 929-4 938.
[10] 馮桂蓉, 謝姣, 鄧麗莉, 等. 柑橘果實萜烯類揮發性物質研究進展[J]. 食品與機械, 2017, 33(10): 200-204.
[11] 姚世響, 謝姣, 曾凱芳. 溫州蜜柑和椪柑橘絡主要礦質元素含量的比較分析[J]. 光譜學與光譜分析, 2017(4): 1 250-1 253.
[12] DING Yu-duan, CHANG Ji-wei, MA Qiao-li, et al. Network analysis of postharvest senescence process in citrus fruits revealed by transcriptomic and metabolomic profiling[J]. Plant Physiology, 2015, 168(1): 357-642.
[13] CHUTIA M, BHUYAN P, PATHAK M. Antifungal activity and chemical composition ofCitrusreticulataBlanco essential oil against phytopathogens from North East India[J]. LWT-Food Science and Technology, 2009, 42(3): 777-780.
[14] SAWAMURA M, THI M T N, ONISHI Y, et al. Characteristic odor components ofCitrusreticulataBlanco (ponkan) cold-pressed oil[J]. Bioscience, Biotechnology, and Biochemistry, 2004, 68(8): 1 690-1 697.
[15] LOTA M L, DE ROCCA S D, TOMI F, et al. Volatile components of peel and leaf oils of lemon and lime species[J]. Journal of Agricultural and Food Chemistry, 2002, 50(4): 796-805.
[16] NJOROGE S M, KOAZE H, KARANJA P N, et al. Volatile constituents of redblush grapefruit (Citrusparadisi) and pummelo (Citrusgrandis) peel essential oils from Kenya[J]. Journal of Agricultural and Food Chemistry, 2005, 53(25): 9 790-9 794.
[17] YAO Shi-xiang, CAO Qi, XIE Jiao, et al. Alteration of sugar and organic acid metabolism in postharvest granulation of Ponkan fruit revealed by transcriptome profiling[J]. Postharvest Biology and Technology, 2018, 139: 2-11.
[18] 吳超. 高產油微藻基于基因組的初級代謝網絡重構和代謝流分析[D]. 北京: 清華大學, 2015: 8-9.
[19] VANBUREN R, BRYANT D, EDGER P P, et al. Single-molecule sequencing of the desiccation-tolerant grassOropetiumthomaeum[J]. Nature, 2015, 527(7 579): 508-511.
[20] 姚世響. 穩定同位素標記水稻幼苗的定量蛋白質組學新方法的研究[D]. 北京: 清華大學, 2015: 4-10.

