藏豬和長白豬對口蹄疫疫苗免疫應答特性的比較
盧建均 ,楊霄 *,萬小平 *,呂學斌 ,王澤洲 ,高榮 **
(1.生物資源與生態環境教育部重點實驗室,四川省動物疫病預防與食品安全重點實驗室,四川大學生命科學學院,四川 成都 610064;2.四川省畜牧科學研究院,四川 成都 610066;3.四川省動物疫病預防控制中心,四川 成都 610041)
目前國內外關于藏豬免疫遺傳特性的系統研究并不多見,本試驗用豬口蹄疫O型滅活苗免疫藏豬和長白豬,采集不同時期的前腔靜脈血,通過檢測免疫細胞數量變化、豬口蹄疫O型病毒特異性抗體水平以及免疫應答相關基因表達的變化情況,深入了解免疫后藏豬和長白豬免疫應答特性的差異。
1 材料與方法
1.1 試劑 豬口蹄疫O型滅活苗(OZK,93+OS,99株),改良型RPMI1640淋巴細胞分離液:比重為1.113±0.002,豬口蹄疫O型病毒ELISA特異性抗體檢測試劑盒,熒光定量PCR試劑So-fast evagreen supermix。
1.2 試驗豬 隨機選取8日齡、體重均約2kg的健康藏豬和長白豬各5頭,分別設為藏豬試驗組和長白豬試驗組,兩組豬均肌肉注射2頭份豬口蹄疫O型滅活苗(試驗前進行了常見病原和抗體檢測,結果均為陰性)。在免疫疫苗前(記為第0d)和免疫后6、8、12周和16周分別采集豬前腔靜脈血于抗凝管中,用于血液免疫細胞計數,并對抗豬口蹄疫O型病毒特異性抗體、免疫基因表達水平進行分析。
1.3 試驗方法
1.3.1 血液免疫細胞計數 按期在無菌狀態下采集藏豬和長白豬的新鮮前腔靜脈抗凝血1mL,用血細胞自動計數儀進行血常規檢測。
1.3.2 分離血清 取新鮮的前腔靜脈抗凝血1 mL,5 000 r/min室溫下離心5 min,收集上層淡黃色血漿,-20℃保存備用。
1.3.3 淋巴細胞的分離與培養 參照豬淋巴細胞分離液使用說明,從新鮮采集的前腔靜脈抗凝血中分離免疫細胞,用RPMI1640培養液(含青霉素100U/mL,鏈霉素100μg/mL和10%胎牛血清)懸浮。將細胞懸液稀釋至5×106/mL,置于細胞培養板上,在37℃ CO2培養箱中培養48h。
1.3.4 間接ELISA法檢測血清中的特異性抗體 參照試劑盒說明書進行。
1.3.5 淋巴細胞總RNA提取和cDNA制備 取培養48h的藏豬和長白豬淋巴細胞,1500r/min離心5min,收集細胞,加入Trizol試劑裂解細胞。參照Trizol試劑使用說明書提取總RNA,并按M-MLV逆轉錄酶操作指南,以Oligo(dT)和隨機引物反轉錄合成cDNA。
1.3.6 熒光定量引物設計 根據GenBank中報道的豬 β-actin、TRL4、TLR7、TLR9、CCR7、CD62L、CD4、IL-6、IL-10基因的cDNA序列,設計合成了9對擴增引物(表1)。
1.3.7 熒光定量PCR 免疫相關基因的定量PCR表達分析用Bio-Rad CFX96熒光定量PCR儀進行。以藏豬和長白豬不同時期的淋巴細胞cDNA為模板,用上述引物擴增。定量PCR擴增參數為:95℃30s,95℃ 2s,60℃ 2s,共45個循環。溶解曲線參數為:65~95℃,每5s上升0.5℃。以β-actin作為內參基因,采用ΔCt法分析實時熒光定量PCR數據,比較同一目的基因不同時期的相對表達水平。

表1 定量PCR擴增引物
2 結果
2.1 血液中免疫細胞數量的變化 對抗凝血常規免疫細胞分析,結果顯示:免疫后6~12周,藏豬組的白細胞數量顯著高于長白豬組(P<0.05);免疫后6~16周,藏豬組的紅細胞數量和血紅蛋白含量明顯高于長白豬組,且呈上升趨勢(P<0.05),而長白豬組的紅細胞數量無顯著變化(P>0.05)。
2.2 血清特異性抗體含量的變化 用間接ELISA法檢測豬口蹄疫O型病毒特異性抗體水平,結果如圖1所示。
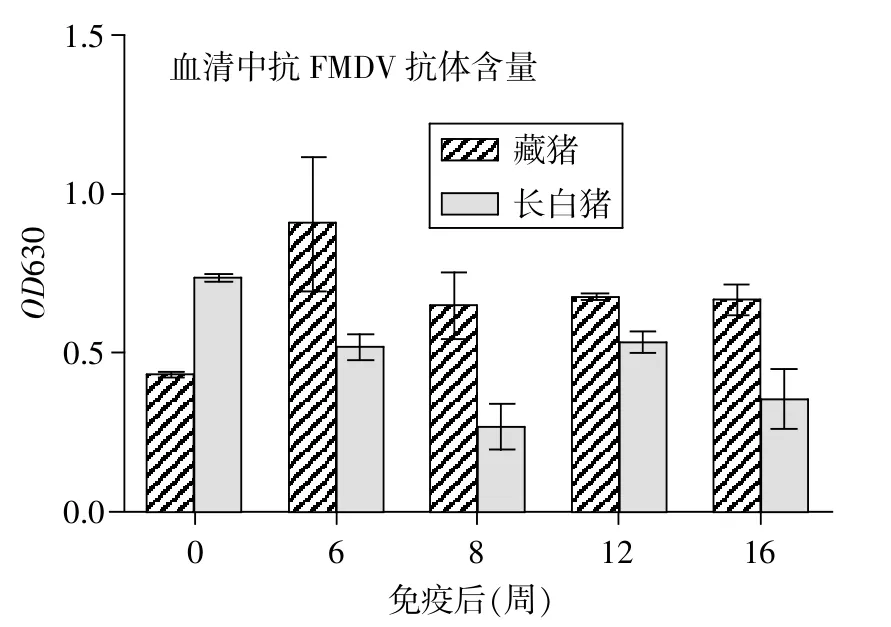
圖1 血清中豬口蹄疫O型病毒特異性抗體的變化情況
在藏豬免疫后6~16周,其特異性抗體水平明顯高于長白豬(P<0.05);第6周,血清中豬口蹄疫O型病毒的特異性抗體水平最高;之后8~16周,特異性抗體保持在一個相對穩定的水平,但均明顯高于免疫前。
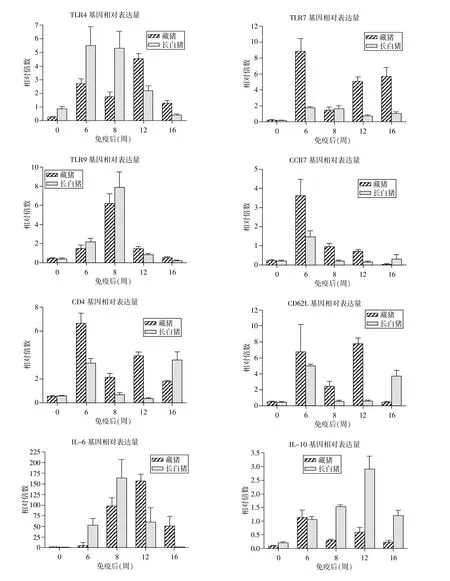
圖2 RT-PCR檢測不同時期免疫基因的表達情況
2.3 免疫應答基因表達水平的變化 從圖2免疫相關基因表達水平的定量分析結果可以看出,藏豬與長白豬的8個基因的表達水平在免疫后均明顯增高(P<0.05)。
藏豬 TLR4、CD4、CD62L 和 IL-10 基因在 6~16周期間均表現為先下降后上升再下降(P<0.05);CCR7基因的表達量在免疫后6~16周顯著降低;TLR7的表達量在免疫后6~8周降低,而在8~16周顯著升高,這與TLR9基因表達的變化趨勢正好相反(P<0.05)。免疫后6~12周,藏豬IL-6基因的表達量顯著升高(P<0.05),長白豬的TLR9和 IL-6在免疫后6~8周表達量升高,而在8~16周顯著降低(P<0.05)。長白豬CCR7、CD4和CD62L基因的表達量在免疫后6~12周降低,而IL-10基因的表達量明顯上升(P<0.05),TLR4基因在免疫后 6~16周表達量降低(P<0.05),TLR7在免疫后的6~16周表達量無顯著變化。
免疫后 8~16周,藏豬的 TLR4、TLR9和IL-6基因表達水平顯著高于長白豬(P<0.05),6~8 周低于長白豬。免疫后6~12周,藏豬的CCR7、CD4和CD62L基因表達水平顯著高于長白豬(P<0.05)。免疫后8~16周,長白豬的IL-10基因表達水平顯著高于藏豬(P<0.05)。而另一個特點是,免疫后除第8周,藏豬TLR7基因的表達水平均明顯高于長白豬(P<0.05)。
3 結論與分析
3.1 從ELISA結果分析可知,在豬口蹄疫O型病毒疫苗刺激下藏豬更易從自身B淋巴細胞分泌特異性抗體,并迅速在體內維持相對穩定的抗體水平。藏豬在抗FMDV的體液免疫反應方面明顯優于長白豬。免疫后兩個試驗組豬的8種與免疫相關的mRNA含量均顯著高于免疫前水平,表明肌注FMDV滅活疫苗有效地誘發了兩組豬的抗FMDV免疫反應。
3.2 Toll樣受體(TLR)是模式識別受體的一類,識別與宿主不同的病原體分子。TLRs是Ⅰ型跨膜蛋白,能夠識別侵入體內的微生物進而激活免疫細胞的應答反應,被認為在先天性免疫系統中起關鍵作用[1-2]。TLR4和TLR9能夠促進樹突狀細胞的成熟,被認為在先天免疫和誘導適應性免疫中有重要作用[3-4]。免疫FMDV滅活疫苗后,兩個試驗組的TLR4和TLR9表達水平較免疫前明顯提高,說明兩組中的FMDV滅活疫苗均誘發了較強的免疫防御應答。免疫后藏豬TLR7的表達明顯高于長白豬,表明藏豬較長白豬對O型FMDV有更好的固有識別能力。此外,藏豬免疫FMDV滅活疫苗后,白細胞水平也顯著高于長白豬。以上結果均說明藏豬的先天免疫應答能力如免疫識別等優于長白豬。
3.3 CD4作為輔助性T細胞表面特異性抗原,它識別MHCⅡ分子,激活下游細胞因子的轉錄和分泌,調節獲得性免疫應答[5]。CCR7是一種趨化因子,確保淋巴細胞到達外周淋巴組織的正確位置。CD62L(L-選擇素)是一種淋巴細胞歸巢受體,參與淋巴細胞向外周淋巴組織遷移的粘附作用。它們共表達決定了淋巴細胞向外周淋巴組織遷移的能力[6]。此外,有研究表明CD4、CCR7和CD62還與機體的免疫記憶有關[7]。免疫后6~12周,藏豬CD4、CCR7和CD62L基因的表達水平顯著高于長白豬,提示免疫后期藏豬的免疫調節增強效應和免疫記憶能力都優于長白豬。
3.4 IL-6是主要由單核巨噬細胞、T細胞及纖維細胞等合成的多肽,在B細胞參與的免疫反應和CD4 Th細胞分化中有重要作用。在正常生理狀態下,甲狀腺上皮細胞(TEC)僅產生少量IL-6,但在病理情況下,IL-6的表達會異常升高。IL-10是一類重要的抗炎免疫調節因子,它能夠抑制促炎因子如IFN-γ、IL-2、IL-3、TNF-α和GM-CSF的產生,負反饋調節免疫系統[8]。在免疫后8~16周,長白豬IL-10的表達水平明顯高于藏豬(P<0.05)。長白豬IL-10高表達引起的免疫應答負反饋調節作用,可能是導致其體液免疫水平及免疫細胞數量低于藏豬的原因。
本研究初步表明:藏豬對FMDV滅活疫苗的先天免疫、體液免疫、細胞免疫、免疫記憶、免疫調節等各項指標均優于長白豬。因此,藏豬對FMDV感染的抵抗能力要強于長白豬。
參考文獻:
[1]Akira S,Takeda K,Kaisho T.Toll-like receptors:critical proteins linking innate and acquired immunity[J].Nat Immunol,2001,2(8):675-680.
[2]Imler J L,Hoffmann J A.Toll receptors in innate immunity[J].Trends Cell Biol,2001,11(7):304-311.
[3]Kawai T,Akira S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].Nat Immunol,2010,11(5):373-384.
[4]Kawai T,Akira S.Toll-like receptors and their crosstalk with otherinnate receptors in infection and immunity[J].Immunity,2011,34(5):637-650.
[5]Yu Yongmao,Rabinowitz R,Michael S,et al.Correlation between the expression of CD4 and the level of CD4 mRNA in human B-cell lines[J].Cell Immunol,2002,215(1):78-86.
[6]Totte P,Duperray C,Dedieu L.CD62L defines a subset of pathogen-specific bovine CD4 with central memory cell characteristics[J].Dev and Comp Immunol,2010,34(2):177-182.
[7]Unsoeld H,Pircher H.Complex memory T-cell phenotypes revealed by coexpression of CD62L and CCR7[J].J Virol,2005,79(7):4510-4513.
[8]Mocellin S,Panelli Mc,Wang E,et al.The dual role of IL-10[J].Trends Immunol,2003,24(1):36-43.

