氯嘧磺隆降解菌的篩選及對污染土壤的生物修復
王海蘭 ,臧海蓮 ,成 毅 ,安雪姣 ,徐春紅 ,李春艷 * (.東北農業大學資源與環境學院,黑龍江 哈爾濱5000;.中國農業大學理學院,北京 0008;.牡丹江友搏藥業有限責任公司,黑龍江 牡丹江 57000)
氯嘧磺隆是美國杜邦公司于20世紀80年代研制的一種磺酰脲類除草劑,被廣泛用于大豆田選擇性防除闊葉雜草、莎草及某些禾本科雜草.該除草劑殘效期長(2~3年),長期大量重復施用極易對后茬敏感作物產生藥害,阻礙大豆田的合理輪作,對生態環境和人類健康存在著巨大的潛在威脅[1-2].磺酰脲類除草劑在土壤中的降解主要包括光解、化學水解和微生物降解,其中微生物降解技術因具有時間短、不產生二次污染等優點而受到廣泛關注[3-5].因此,獲得可修復氯嘧磺隆污染土壤的高效降解菌株以減輕氯嘧磺隆對后茬作物的藥害及環境的污染具有重要的理論和現實意義[6-10].
目前,一些氯嘧磺隆降解微生物已被分離和鑒定,主要有曲霉菌屬、芽孢桿菌屬、念珠菌屬、鏈霉菌屬、假單孢菌屬、諾卡氏菌屬、寡養單胞菌屬、擲孢酵母屬、叢梗孢科曲霉屬等[11-15].除對降解微生物分離鑒定及降解條件優化外,研究人員還考察了部分菌種對氯嘧磺隆污染土壤的修復能力,汪佳秀等[16]利用克雷伯氏菌研究了其對被氯嘧磺隆污染土壤的生物修復作用,并以小麥、玉米、黃瓜為供試植物,研究了該菌株對氯嘧磺隆藥害的緩解作用.但是,利用膠紅酵母菌修復氯嘧磺隆污染土壤的研究尚未有報道.
本研究分離獲得 1株能以氯嘧磺隆為唯一碳源生長的氯嘧磺隆高效降解菌,根據菌株最佳降解條件,考察土壤溫度、土壤pH值、土壤含水量以及接種量對降解菌降解土壤中氯嘧磺隆的影響,優化菌株對土壤中氯嘧磺隆的降解條件.通過敏感作物盆栽實驗檢測降解菌對氯嘧磺隆污染土壤的修復效果.以期豐富氯嘧磺隆降解菌菌種資源,降低殘留氯嘧磺隆對后茬作物的藥害,為實際氯嘧磺隆污染土壤修復提供有價值的參考.
1 材料與方法
1.1 菌株篩選及土壤采集
污泥樣品采自江蘇某激素研究所污水處理池(連續生產磺酰脲類除草劑20余年).
供試土壤為經檢測無氯嘧磺隆殘留的自然土(NS),取自東北農業大學試驗田,取 0~30cm 深耕層土壤,過篩(孔徑 2mm)、風干后備用,用于進行氯嘧磺隆污染土壤生物修復試驗、盆栽試驗.經測定可知:土壤 pH 6.23,全氮含量 93.5mg/kg,全磷含量為 42.1mg/kg,全鉀含量為 416.9mg/kg,含水率為3.6%.
1.2 培養基
無機鹽基礎培養液:K2HPO40.1g,CaSO40.04g,MgSO4·7H2O 0.2g,NaCl 0.1g,(NH4)2SO40.1g,FeSO4·7H2O 0.001g,加蒸餾水至 1L,121℃滅菌30min.
YPD 培養基(酵母膏胨葡萄糖培養基):酵母膏 10g,蛋白胨 20g,葡萄糖 20g,加蒸餾水至 1L,112℃滅菌20min.
以上培養基在配制固體培養基時按2%添加瓊脂粉,按照實驗要求調節pH值.
1.3 主要儀器與試劑
實驗所用氯嘧磺隆(分析純,96.02%)購自江蘇激素研究所有限公司.Taq DNA聚合酶、dNTPs、DNA Marker DL2000購自TaKaRa公司;所用有機試劑均為色譜純,其余試劑均為國產分析純.所用引物均由上海生物工程技術服務有限公司合成.
使用的主要儀器有:AgelienT1100高效液相色譜儀(美國安捷輪)、SW-CJ-2FD 型雙人單面凈化工作臺(蘇州凈化)、SPX-250B-Z生化培養箱(上海博訊)、YXQ-SG46-280S手提式壓力蒸汽滅菌器(上海博訊)、TU-1810分光光度計(北京普析)等.
1.4 氯嘧磺隆降解菌分離
采用富集培養方法,以氯嘧磺隆為唯一碳源,富集培養污泥樣品.具體步驟如下:取污泥樣品10g放入裝有90mL無菌生理鹽水和玻璃珠三角瓶中,振蕩約20s至樣品形成均勻懸濁液.以10%接種量轉接于裝有 40mL氯嘧磺隆無機鹽培養基 250mL三角瓶中,氯嘧磺隆濃度為 100mg/L,置于 30℃,165r/min恒溫搖床培養,每隔 7d按10%接種量接入新鮮氯嘧磺隆無機鹽培養基中,以一定濃度梯度提高氯嘧磺隆含量,至終濃度達到 1000mg/L,如此馴化約 2個月[17].于氯嘧磺隆終濃度為 500mg/L基礎無機鹽平板上采用平板劃線法分離純化 3~4次,選擇生長較好的菌株分別回接于含 100mg/L氯嘧磺隆無機鹽基礎培養液中,測量其生長量(OD600)及降解率,進行后續實驗研究.
1.5 氯嘧磺隆降解菌鑒定
采用平板劃線法將氯嘧磺隆降解菌接種于無機鹽基礎固體培養基,30℃恒溫培養5d后觀察菌落形態.
利用細菌16S rDNA的27F/1492R通用引物27F:5'-AGAGTTTGATCCTGGCTCA-3'和1492R:5'-GGTTACCTTGTTACGACTT-3',ITS序列的通用引物 ITS1:5'-TCCGTAGGTGAACCTGCGG-3'和ITS4:5'-TCCTCCGCTTATTGATATG-C-3'及酵母菌26S rDNA的D1/D2通用引物N L1:5'-GCATATCAATAAGCGGAGGAAAAG-3'和 NL4:5'-GGTCCGTGTTTCAAGACGG-3'分別擴增降解菌株的16S rDNA區域序列、ITS1-5.8S-ITS2的ITS區域序列和26S rDNA D1/D2區域序列.擴增反應體系為:10×buffer (Mg2+) 5μL,dNTPs(2mmol/L) 4μL,上下游引物(20pmol/μL)各 1μL,菌體 DNA(50ng/μL) 1μL, Taq DNA 聚合酶(5U/μL) 0.5μL,加ddH2O至50μL. PCR反應條件:95℃ 5min,94℃ 30s,56℃ 30s, 72℃ 90s,3 0個循環,72℃ 10min.測序結果提交 NCBI進行BLAST比對分析,采用軟件DNAMAN 8.0構建系統發育樹.
1.6 氯嘧磺隆降解菌降解率測定
氯嘧磺隆濃度采用高效液相色譜 Waters 600檢測.色譜柱為 symmetry-C18反相柱(250mm×4.6mm,i.d.5μm),紫外檢測器為 Waters 2487,流動相為甲醇:水=70:30(V/V),冰乙酸調節pH 值,流量 1.0mL/min,波長 254nm,進樣量 20μL,柱溫 25℃.氯嘧磺隆采用外標法定量分析.采用Empower Software(Waters,MA,USA)記錄和計算氯嘧磺隆峰面積,得出菌株LCY-4氯嘧磺隆降解率[18-19].
降解率計算公式:
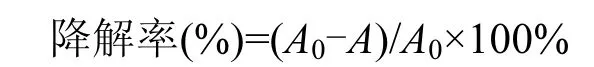
式中:A0-未接菌對照培養液中氯嘧磺隆含量;A-接菌處理培養液中氯嘧磺隆含量.
1.7 氯嘧磺隆降解菌降解條件優化
分別以24、26、28、30、32、34、36、38℃作為溫度實驗組,分別以5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5作為pH值實驗組,分別以1.0%、1.5%、2.0%、2.5%、3.0%作為接種量實驗組.以上各實驗組均使用 100mL含氯嘧磺隆濃度為100mg/L的無機鹽培養液.每實驗設3個處理,同時設加藥但不加菌懸液的處理為對照.180r/min恒溫振蕩培養5d后,分別測定菌株生長量OD600及氯嘧磺隆降解率,考察不同因素對LCY-4降解氯嘧磺隆的影響.
1.8 氯嘧磺隆降解菌對污染土壤中氯嘧磺隆降解條件優化
1.8.1 降解菌對滅菌及未滅菌污染土壤中氯嘧磺隆的降解 在降解菌降解條件優化基礎上,土壤中添加氯嘧磺隆濃度為 10mg/kg (干土),檢測降解菌LCY-4在滅菌土壤及未滅菌土壤中的降解率,同時設定未投加降解菌LCY-4的滅菌土壤及未滅菌土壤作為對照組.
1.8.2 不同因素對降解菌降解土壤中氯嘧磺隆的影響 取過篩土壤 50g,氯嘧磺隆添加量為10mg/kg (干土).分別以1.0%、1.5%、2.0%、2.5%、3.0%作為接種量實驗組,分別以20、25、28、30、33、38℃作為溫度實驗組,分別以5.0、5.5、6.0、6.75、7.0、7.5、8.0作為土壤pH值實驗組,分別以 10%、20%、30%、40%、50%、60%為土壤含水量實驗組.除接種量實驗組外,其他各組均以2.5%的接種量接種LCY-4;除培養溫度實驗組外,其他各組均于28℃條件下培養;除土壤pH值實驗組外,其他各組土壤均為自然pH值(6.75);除土壤含水量實驗組外,其他各組土壤含水量均為田間最大持水量的40%.靜息培養30d后,采用高效液相色譜測定氯嘧磺隆殘留量,計算降解率.
整個實驗階段適時補水,保持含水量不變,每實驗設 3個重復,同時設加藥但不加菌懸液的處理為對照.在以上最佳降解條件下,靜息培養 30d后采用高效液相色譜測定氯嘧磺隆殘留量,計算降解率.
1.9 氯嘧磺隆降解菌對污染土壤上小麥苗期生長的影響
土壤過篩,分裝于花盆中,每盆3kg,空白對照組只添加土壤;實驗對照組添加氯嘧磺隆濃度為10mg/kg的土壤,配制好的藥液均勻噴灑在土上,邊噴邊攪拌,使藥液與土壤混拌均勻;實驗組將降解菌LCY-4以2.5%接種量添加于氯嘧磺隆濃度為10mg/kg的土壤中.所有處理于28℃條件下靜息培養,實驗階段保持含水量恒定[18].
投加降解菌10d后,選取經清水浸種、催芽、萌發一致的小麥種子,分別播種于各處理土壤中,每盆播種10粒.于28℃條件下靜息培養,第3d時測定出苗率,繼續培養15d后測定幼苗株高,幼苗根長,植株鮮重,用數據統計學進行相關分析.
1.10 數據處理
所有的實驗結果為 3次重復的平均值,實驗數據分析和制圖采用Origin8.0軟件完成.
2 結果與討論
2.1 氯嘧磺隆降解菌的篩選
采用富集、馴化培養方法,從連續生產磺酰脲類除草劑20余年的江蘇某激素研究所污水處理池污泥樣品中分離出1株氯嘧磺隆降解菌,該菌株能以氯嘧磺隆為唯一碳源進行生長,對氯嘧磺隆具有較高的降解能力,命名 LCY-4.LCY-4的菌體形態呈卵形或球形,大小為 2.0~5.0μm,單一、成對,不形成子囊孢子或擔孢子.單一菌落形態為圓形,表面凸起,邊緣整齊,不透明,濕潤,粘稠,在 YPD培養基上菌落為橙紅色.在液體培養基中,液體表面不形成菌膜,菌液均勻混濁,無起泡現象.
2.2 氯嘧磺隆降解菌分子生物學鑒定
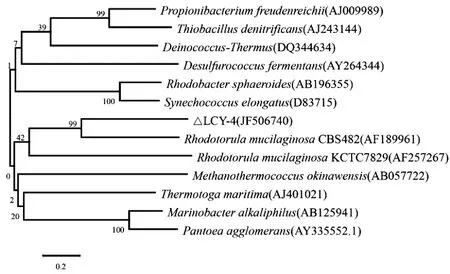
圖1 菌株 LCY-4 基于26S rDNA基因序列的系統發育樹Fig.1 A phylogenetic tree based on 26S rDNA sequence of strain LCY-4
以菌株基因組DNA為模板,以16S rDNA的通用引物 27F/1492R、ITS區的通用引物ITS1/ITS4及26S rDNA的通用引物NL1/NL4對菌株LCY-4進行PCR擴增,測序結果提交NCBI進行BLAST比對,結果顯示,菌株LCY-4的5.8s ITS區段基因序列與 Rhodotorula mucilaginosa同源性最高,達99%;菌株LCY-4的26Sr DNA區段序列與Rhodotorula mucilaginosa聚為一族,與菌株 Rhodotorula mucilaginosa CBS428(AF189661)的相似度為99.95%(系統發育關系見圖 1).確定菌株 LCY-4為膠紅酵母(Rhodotorula mucilaginosa)的一個菌株.菌株LCY-4序列已在GenBank中注冊,登錄號為JF506740.
2.3 氯嘧磺隆降解菌降解條件優化

圖2 不同因素對降解菌LCY-4生長及氯嘧磺隆降解能力的影響Fig.2 Effects of different factors on strain LCY-4 growth and chlorimuron-ethyl degradation
不同因素對菌株LCY-4生長量及氯嘧磺隆降解率影響見圖2. LCY-4的最適生長及降解溫度為28℃,此溫度下其最大生長量及降解率分別為1.70和81.03%.菌株LCY-4的最佳生長及降解 pH值為 6.0,其最大生長量及降解率分別為1.532和82.46%.菌株LCY-4在接種量為2.5%時,生長量為 1.68,此時降解率亦達到最大 81.1%.最佳條件下,在含100mg/L氯嘧磺隆的無機鹽培養基中培養5d后,菌株LCY-4降解率為87.33%.
2.4 氯嘧磺隆降解菌對污染土壤中氯嘧磺隆降解條件優化
2.4.1 降解菌對土壤中氯嘧磺隆的降解能力圖3表示土壤中氯嘧磺隆初始濃度10mg/kg (干土),降解菌 LCY-4在滅菌土壤及未滅菌土壤中的降解曲線.由圖 3可知,滅菌的對照組(CK1)氯嘧磺隆本身存在一定程度的降解,在第 30d氯嘧磺隆降解率達到 9.03%,表明土壤中氯嘧磺隆的降解有一部分是非生物作用引起的,而未滅菌的對照組(CK2)在0~10d氯嘧磺隆降解效果與CK1區別不大,在15~30d降解率逐漸升高,第30d氯嘧磺隆降解率達到36.87%,說明氯嘧磺隆的添加可能誘導了某些自然狀態下土著微生物對氯嘧磺隆降解作用,但作用緩慢且降解率較低[18].
投加降解菌LCY-4于滅菌的氯嘧磺隆污染土壤處理組(TR1)降解率明顯高于對照組(CK1),第30d菌株LCY-4在TR1處理中對氯嘧磺隆的降解率為 81.54%,表明降解菌 LCY-4對氯嘧磺隆有較高的降解能力.降解菌LCY-4投加于未滅菌的氯嘧磺隆污染土壤處理組(TR2)降解率略高于降解菌LCY-4投加于滅菌氯嘧磺隆污染土壤處理組(TR1),第30d菌株LCY-4在TR2處理組中的降解率達到 85.21%,表明降解菌株 LCY-4添加提高了土壤中氯嘧磺隆的降解.后續實驗選擇未滅菌的自然土壤作為研究對象.
2.4.2 菌株對土壤中氯嘧磺隆降解條件的優化 不同因素對菌株LCY-4降解土壤氯嘧磺隆的影響見圖4.降解菌株LCY-4以不同的接種量添加到土壤中,其降解效果如圖 4a所示.降解菌的加入,促進了土壤中氯嘧磺隆的降解.盡管微生物只有在數目上達到一定規模才能實現對底物的高效降解,但接種量并非越大越好,當接種量達到一定程度后,繼續增加接種量對底物降解能力影響不大,實際應用不經濟,尋求能達到氯嘧磺隆降解要求的最適接種量有利于生物修復過程中菌種培養的成本控制[19-20].菌株LCY-4在接種量為 2.5%和 3.0%時,降解率分別為 83.74%和84.11%,差別相對較小,后續實驗以 2.5%的接種量添加.
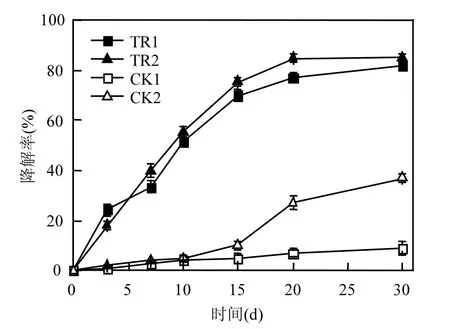
圖3 降解菌株 LCY-4 在滅菌土壤及未滅菌土壤中對氯嘧磺隆的降解Fig.3 Chlorimuron-ethyl degradation by strain LCY-4 in sterile and unsterile soil
培養溫度對高效降解菌LCY-4降解氯嘧磺隆的影響結果見圖 4b.結果表明,隨著培養溫度的升高降解率呈現先上升后下降的趨勢,在 25~30℃范圍內,降解菌株整體降解能力較好,降解率均在 70%以上,其最高降解率出現在 25℃,為87.66%,較高溫度對降解菌株降解能力的抑制作用明顯,當溫度升至 28℃時,降解率略有降低,為82.27%.
土壤pH值對高效降解菌LCY-4降解氯嘧磺隆的影響結果見圖4c.結果表明,在土壤pH為5.0~8.5范圍內,菌株降解能力均大于 50%,表明降解菌LCY-4具有較強的土壤適應性,當pH值低于6.0時,LCY-4的降解能力隨pH值的升高而增強,當pH值高于6.0時,菌株降解能力隨之減弱.菌株LCY-4的最適降解pH值為6.0,此條件下降解率為88.33%.
土壤含水量對高效降解菌LCY-4降解氯嘧磺隆的影響結果見圖 4d.結果表明,當土壤中含水量為田間最大持水量的 10%~60%范圍內,降解菌株表現出較強的降解能力,當土壤中含水量在 10%~30%之間,菌株降解能力隨著含水量的升高而升高,當含水量在 30%~40%之間時,降解率隨著含水量升高呈現下降趨勢,當含水量在40%~60%之間時,降解率隨之呈現出緩慢下降趨勢,變化不大.當菌株LCY-4在含水量為30%時,降解率最高,為86.33%.
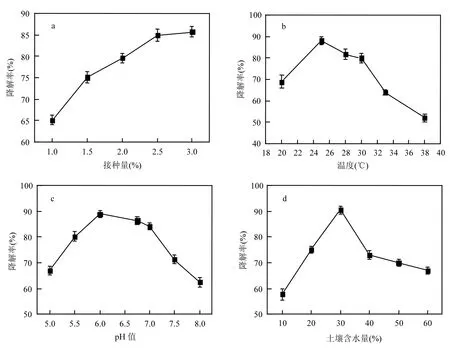
圖4 不同因素對土壤中氯嘧磺隆降解的影響Fig.4 Effects of different factors on chlorimuron-ethyl degradation by strain LCY-4 in soil
最佳條件下,當接種量 2.5%、溫度 25℃、pH 6.0、土壤含水量 30%時,靜息培養 30d后,氯嘧磺隆降解率達到 90.74%,表明氯嘧磺隆高效降解菌 LCY-4對土壤中的氯嘧磺隆存在較高的降解能力.
2.4.3 降解菌株對氯嘧磺隆污染土壤的修復作用 播種小麥3d后,出苗情況如圖5所示,空白對照的出苗率達到 90%,而添加氯嘧磺隆的土壤明顯抑制小麥出苗率,出苗率僅 70%;投加 LCY-4于氯嘧磺隆污染土壤的處理組,出苗率達到85%,結果表明降解菌的加入有效減輕了氯嘧磺隆對小麥出苗率的抑制作用,由此可見,降解菌可有效緩解氯嘧磺隆對小麥種子發芽的毒害作用,具有一定的應用潛能.
播種 15d后,小麥幼苗株高、根長及鮮重如圖 6所示.氯嘧磺隆污染土壤中小麥幼苗株高、根長及鮮重明顯低于未污染土壤生長的小麥(P<0.05),表明氯嘧磺隆的殘留對小麥幼苗生長有一定的抑制作用.投加降解菌LCY-4的氯嘧磺隆污染土壤中小麥株高、根長及鮮重[分別為(28.25±2.72)cm、(7.48±0.17)cm、(0.25±0.01)g]明顯大于未加入降解菌的氯嘧磺隆污染土壤生長的小麥株高、根長及鮮重[分別為(23.20±1.74)cm、(6.42±0.10)cm、(0.19±0.02)g](P<0.05),說明施用降解菌LCY-4可降低氯嘧磺隆對小麥幼苗的藥害.結果表明,高效降解菌株 LCY-4對土壤中的氯嘧磺隆具有一定的降解,從而降低對小麥幼苗的藥害.

圖5 LCY-4 修復氯嘧磺隆污染土壤對盆栽小麥出苗率影響Fig.5 The effect of chlorimuron-ethyl-contained soil bioremediation by strain LCY-4 on wheat seedling emergence
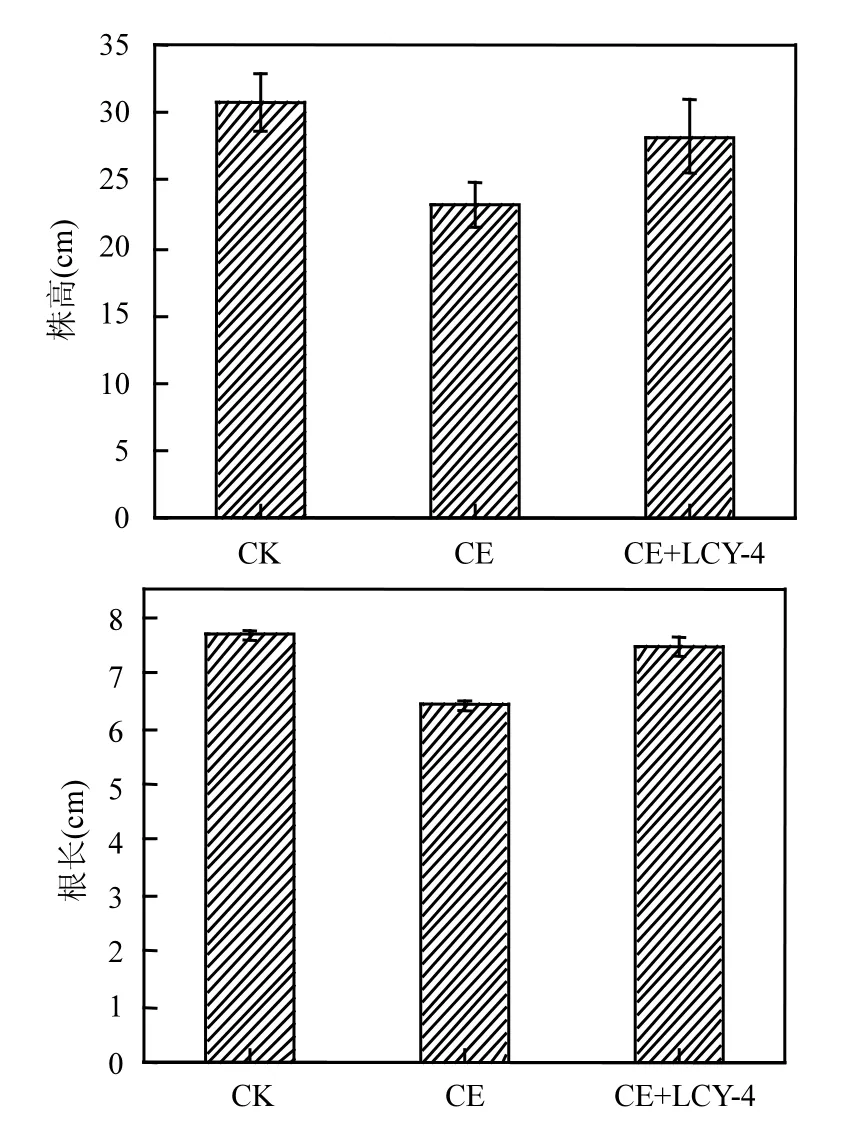
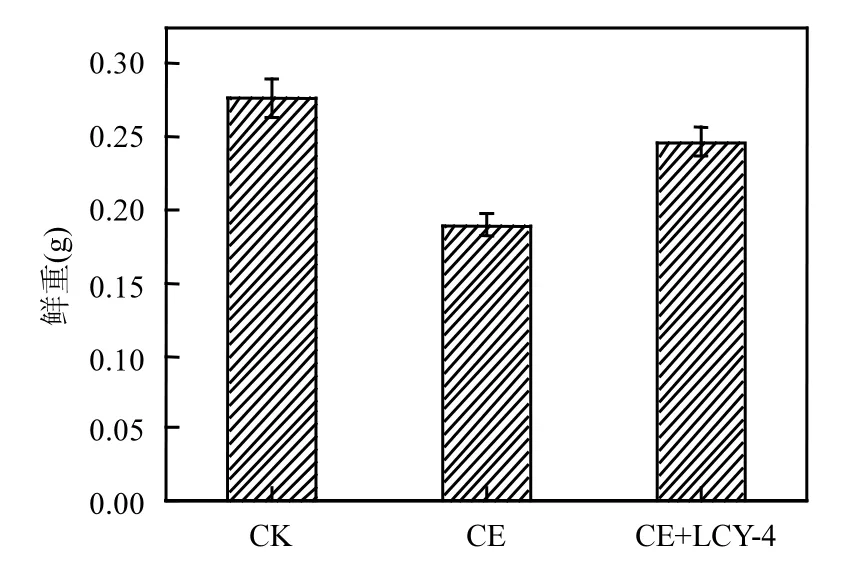
圖6 LCY-4修復氯嘧磺隆污染土壤對小麥生長狀況的影響Fig.6 The effect of chlorimuron-ethyl-contained soil bioremediation by strain LCY-4 on wheat seeding growth
氯嘧磺隆是一種超高效、長殘留性除草劑,植株苗期是植物生長的敏感階段,除草劑藥害首先會體現在植物生長的敏感時期[21].本研究選取盆栽土培法種植對氯嘧磺隆比較敏感的農作物小麥,考察降解菌的投加對氯嘧磺隆藥害的解除效果,以及對敏感作物的影響,為該降解菌在大田生產實際應用中提供參考.
應用微生物降解土壤中污染物具有環保高效的優點,但微生物與土壤微環境的相互作用機制[22],高效降解菌在不同土壤條件下(如鹽堿地、巖性土等)降解能力以及適應性,土壤微生物群落的改變以及微生物降解技術在農業生產實踐中的生態風險評估等仍有待進一步探討.
3 結論
3.1 本研究以氯嘧磺隆為目標污染物篩選獲得的 1株高效氯嘧磺隆降解酵母菌,經菌株形態特征和26S rDNA序列分析,鑒定該菌株屬膠紅酵母菌(Rhodotorula mucilaginosa),命名為LCY-4.
3.2 利用單因素實驗對菌株 LCY-4在含氯嘧磺隆的無機鹽培養基中優化降解條件為:接種量2.5%,培養溫度 28℃,pH 6.0,在含 100mg/L氯嘧磺隆的無機鹽培養基中培養 5d后,降解率為87.33%.
3.3 菌株 LCY-4在氯嘧磺隆初始濃度為10mg/kg(干土)的土壤中,最佳降解條件為:接種量2.5%、溫度25℃、pH 6.0、土壤含水量30%,靜息培養30d后,氯嘧磺隆的降解率為90.74%.
3.4 當土壤中氯嘧磺隆的濃度為 10mg/kg時,投加降解菌LCY-4后,小麥的出苗率、株高、根長及鮮重均明顯高于未投加降解菌的對照組(P<0.05).盆栽實驗結果表明,施用降解菌 LCY-4可減輕氯嘧磺隆對小麥幼苗的藥害.
參考文獻:
[1]包 磊,謝 明,張艷軍,等.巨大芽胞桿菌 E-1菌株對土壤氯嘧磺隆殘留的降解效果 [J]. 中國生物防治學報, 2016,32(5):672-675.
[2]侍 南.氯嘧磺隆降解菌的分離鑒定、降解特性和機理及其修復效果 [D]. 杭州:浙江大學, 2016.
[3]侯憲文,吳建軍,徐建明.鉛-芐嘧磺隆對土壤微生物活性與群落結構的影響 [J]. 中國環境科學, 2007,27(6):738-742.
[4]趙衛松.煙嘧磺隆和噻吩磺隆微生物降解研究 [D]. 北京:中國農業大學, 2015.
[5]黃 星,何 健,潘繼杰,等.噻吩磺隆降解菌 FLX的分離鑒定及降解特性 [J]. 中國環境科學, 2006,26(2):214-218.
[6]鄒月利,陶 波.磺酰脲類除草劑的降解機制及代謝產物的研究進展 [J]. 農藥科學與管理, 2011,32(10):24-31.
[7]司友斌,岳永德,湯 鋒,等.磺酰脲類除草劑在硅膠 G 表面的光解 [J]. 環境科學學報, 2002,22(2):270-272.
[8]郭 敏,單正軍,石利利,等.三種磺酰脲類除草劑在土壤中的降解及吸附特性 [J]. 環境科學學報, 2012,32(6):1459-1464.
[9]徐建民,汪海珍,謝正苗,等.甲磺隆結合殘留物在土壤結合態腐殖物質中的分布 [J]. 中國環境科學, 2002,22(1):2-6.
[10]Zhang X L, Li X, Zhang C G, et al. Ecological risk of long- term chlorimuron- ethyl application to soil microbial community: an in situ investigation in a continuously cropped soybean field in Northeast China [J]. Environmental science and pollution research international, 2011,18(3):407-415.
[11]滕春紅,李曉薇,陶 波.氯嘧磺隆降解真菌的分離和鑒定 [J].東北農業大學學報, 2008,39(12):19-22.
[12]劉 艷,范麗薇,王曉萍.氯嘧磺隆降解菌的分離鑒定及其降解特性 [J]. 微生物學通報, 2010,37(8):1164-1168.
[13]Al-Kharusi S, Abed R M, Dobretsov S. Changes in respiration activities and bacterial communities in a bioaugmented oil-polluted soil inresponse to the addition of acyl homoserine lactones [J]. International Biodeterioration & Biodegradation,2016,107:165–173.
[14]Zhang X L, Li X, Zhang C G, et al. Responses of soil nitrogenfixing, ammonia- oxidizing, and denitrifying bacterial communities to long- term chlorimuron- ethyl stress in a continuously cropped soybean field in Northeast China [J].Annals of Microbiology, 2013,63(4):1619-1627.
[15]Yang L Q, Li X Y, Li X, et al. Bioremediation of chlorimuron-ethyl-contaminated soil by Hansschlegelia sp.strain CHL1 and the changes of indigenous microbial population and N-cycling function genes during the bioremediation process[J]. Journal of Hazardous Materials, 2014,274:314-321.
[16]汪佳秀,張祥輝,穆文輝,等.降解菌 2N3對被氯嘧磺隆污染土壤的生物修復 [J]. 農藥學學報, 2010,12(1):49-53.
[17]Zhang H, Zhang X G, Mu W H, et al. Biodegradation of Chlorimuron-ethyl by the Bacterium Klebsiella jilinsis 2N3 [J].Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes, 2010,45(6):501-507.
[18]Li C Y, Zang H L, Yu Q, et al. Biodegradation of chlorimuronethyl and the associated degradation pathway by Rhodococcus sp.D310-1 [J]. Environmental Science and Pollution Research,2016,23(9):8794-8805.
[19]Tan H B, Xu M K, Li X Y, et al. Effects of chlorimuron-ethyl application with or without urea fertilization on soil ammoniaoxidizing bacteria and archaea [J]. Journal of Hazardous Materials, 2013,260:368-374.
[20]劉 輝,陶 波.土壤微生物對氯磺隆降解的研究 [J]. 農業與技術, 2003,23(1):36-39,55.
[21]Zang H L, Y Q, Lv T Y, et al. Insights into the degradation of chlorimuron-ethyl by Stenotrophomonas maltophilia D310-3 [J].Chemosphere, 2016,144:176-184.
[22]徐建民,黃昌勇,安 曼,等.磺酰脲類除草劑對土壤質量生物學指標的影響 [J]. 中國環境科學, 2000,20(6):491-494.

