替加環素對復雜性腹腔感染患者免疫功能影響
郭茂松,余維麗,孫 昀
復雜性腹腔感染(complicated intra-abdominal infections,cIAI) 是腹腔內臟器穿孔或破裂,導致感染源侵入腔內,形成膿腫或腹膜炎的一類疾病[1]。cIAI多數情況為混合細菌感染,感染源包括革蘭陰性厭氧菌、有氧桿菌、陽性有氧和厭氧球菌等,需廣譜抗生素或多種抗生素聯合[1-2]。替加環素是首個甘氨酰四環素類抗生素,有廣譜抗菌活性,治療cIAI療效肯定,是臨床一線藥物[3]。替加環素可降低cIAI患者外周血IgA水平、升高IgM和IgG水平[4]。此外,替加環素可降低脂多糖(lipopolysaccharide, LPS)刺激下大鼠神經元細胞炎性細胞因子和介質的釋放,提示替加環素具有免疫調控作用[5]。該研究進一步探討替加環素體內外對cIAI患者免疫功能的影響,為深入研究替加環素抗感染藥理作用提供一定的實驗依據。
1 材料與方法
1.1病例資料2015年6月~2017年6月,安徽醫科大學第二附屬醫院ICU科室共收治24 例cIAI患者,其中男17 例,女7 例,年齡27~68歲(51.92±9.17) 歲,原發性疾病種類及病例數如下:上消化道穿孔8 例,胃腸道手術后吻合口漏5例,闌尾膿腫3 例,急性闌尾穿孔4 例,化膿性膽囊炎2 例,肝膿腫2 例。所收患者因感染性休克或血液動力學不穩定入住重癥醫學科。此外,15 例健康志愿者男11 例,女4 例,年齡23~76歲(50.64±9.49)歲。相關標本來自同期安徽醫科大學第二附屬醫院體檢中心,經統計分析,兩組患者年齡、性別差異無統計學意義。
1.2cIAI診斷標準[1]具有cIAI手術指征(剖腹手術、腹腔鏡手術或經皮引流膿腫手術),二次手術或影像學證明具有至少一項以上診斷:膽囊炎伴有破裂或穿孔、憩室性疾病伴有穿孔和膿腫、闌尾穿孔或圍闌尾膿腫、急性胃或十二指腸穿孔、腸外傷性穿孔、內臟穿孔引起的腹膜炎、手術后腹膜炎、腹腔膿腫等。排除標準如下:腹壁膿瘍、小腸梗阻、女性生殖道感染、納入研究前72 h內接受其他系統抗生素治療、患者伴有血細胞低比容水平(<25%),血小板計數低于75 000/mm3或中性粒細胞計數低于1 000/mm3以及其他危及生命疾病(急性肝衰竭和肝疾病),因腹腔感染具有替加環素、舒普深、替考拉寧、泰能等使用史的患者。
1.3治療方案和療效評價當前研究符合醫學倫理學標準,經安徽醫科大學第二附屬醫院倫理委員會批準,患者或家屬均知情同意后執行。cIAI患者治療方案如下,替加環素(輝瑞制藥公司泰格,批號:H20143394)首次治療劑量100 mg, 維持劑量 50 mg/每12 h,靜脈滴注,治療時間7~14 d,采用經驗性治療有效后根據微生物培養結果,抗生素采用降階梯和序貫治療,如標本中分離出真菌或者其它非替加環素抗菌譜覆蓋的病原微生物(如銅綠假單胞菌),則根據藥敏結果加用相應敏感抗菌藥物,尋找腹部感染灶并行積極沖洗引流等措施,但該部分數據不納入最終統計分析結果。根據《抗菌藥物臨床試驗技術指導原則》[6],考察患者臨床癥狀消失, 實驗室檢查及細菌學檢查結果;上述結果均為陰性為顯著性有效;治療后患者臨床癥狀、體征基本消失或者顯著改善,且實驗室檢查及細菌學檢查結果部分改善記為有效;治療前后患者臨床癥狀、實驗室檢查及細菌學檢查結果無明顯變化為無效。VITEK-2型全自動微生物分析系統(法國梅里埃生物公司)對腹腔感染標本分離的病原體進行鑒定。
1.4外周血單個核細胞(peripheralbloodmononuclearcell,PBMC)制備及增殖水平[7]在替加環素干預前及干預后采用梯度離心法制備cIAI患者和健康志愿者PBMC。清晨空腹取外周血3 ml,肝素抗凝,以磷酸鹽緩沖鹽(PBS)等體積稀釋,Ficoll進行密度梯度離心(1 800 r/min,20 min)后,吸取白絮狀單核細胞層,PBS洗滌,重懸細胞,調整細胞濃度為 5×109/L。將上述細胞按照1×105個/每孔接種于96孔板中,每孔終體積 200 μl。實驗分組如下:正常組、模型組、1 mg/L、2 mg/L和5 mg/L替加環素(阿拉丁試劑公司,純度>96%)組, 其中,除正常組外,各組均用100 μg/L金黃色葡萄球菌腸毒素A(staphylococcal enterotoxins A, SEA, 美國毒素科技公司) 刺激24 h。實驗結束前4 h,加入100 μl MTT溶液(5 g/L) 繼續培養4 h,終止培養, 采用酶標儀 (美國BioTek公司) 檢測各孔吸光度(absorbance,A)值 (A570 nm)。
1.5細胞因子水平取健康志愿者、治療前以及治療后cIAI患者外周血3 ml,分離血清。同前法制備PBMC細胞。白細胞介素-1(interleukin-1 , IL-1)、IL-6和IL-8的水平檢測參照酶聯免疫試劑盒(美國RD Systems公司)說明書步驟進行。
1.6PBMCT亞群細胞分別在治療前和治療后抽取健康志愿者、治療前以及治療后的cIAI患者外周血2 ml,加入抗凝劑EDTA。取100 μl抗凝血加入流式管,加入熒光標記的抗體10 μl 染色混勻,包括 CD3+、CD4+、CD8+抗體(美國Santa Cruz公司)。室溫避光孵育30 min,加入溶血素500 μl裂解紅細胞,室溫避光孵育 20 min 上流式細胞儀檢測(FC500,美國Beckman Coulter 公司)。
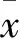
2 結果
2.1替加環素有效抑制cIAI患者腹腔感染替加環素對cIAI患者總有效率為70.8%(顯效率45.80%+有效率25.0%),無效率為29.2%。此外,24例患者共分離出大腸桿菌17株、陰溝腸桿菌7 株、鮑氏不動桿菌9 株、梭狀芽孢桿菌8株、消化鏈球菌11株、腸球菌9株、金黃色葡萄球菌10株、咽峽炎鏈球菌11株、奇異變形菌9株、肺炎克雷伯菌6株。替加環素對病原微生物抑制率依次為70.6%(大腸桿菌)、42.9%(陰溝腸桿菌)、55.6% (鮑氏不動桿菌)、75.0%(梭狀芽孢桿菌)、72.7%(消化鏈球菌)、77.8%(腸球菌)、60.0%(金黃色葡萄球菌)、72.7%(咽峽炎鏈球菌)、55.6%(奇異變形菌)、83.3%(肺炎克雷伯菌)。
2.2替加環素降低cIAI患者血清和PBMC炎性細胞因子的水平與正常組比較,cIAI患者治療前的血清炎性細胞因子IL-1β、IL-6和IL-8含量水平明顯較高(t=-3.119、-5.964、-6.723,P<0.01);與治療前相比較,cIAI患者治療后IL-1β、IL-6和IL-8含量水平顯著降低(t=4.734、5.552、7.968,P<0.01)。此外,體外制備PBMC細胞,采用SEA刺激可顯著提高細胞分泌IL-1β、IL-6和IL-8的水平(P<0.01),替加環素體外給藥能夠顯著降低PBMC上清液中IL-1β、IL-6和IL-8的含量水平(P<0.01),提示替加環素直接降低炎性細胞因子水平。見圖1、2。
2.3替加環素降低cIAI患者PBMC增殖水平與正常組PBMC比較,SEA體外刺激能夠明顯增加PBMC的增殖水平(P<0.01)。替加環素體外給藥能顯著降低SEA刺激下PBMC的增殖水平(P<0.01),結果提示替加環素對SEA激活的PBMC增殖反應具有直接的抑制作用。見圖3。
2.4替加環素調節cIAI患者外周血CD3,CD4和CD8的表達水平與正常組比較,cIAI患者治療前外周血CD3+、CD4+百分比明顯降低,CD4+/ CD8+比值明顯降低,CD8+百分比明顯升高(P<0.01);與cIAI患者治療前比較,替加環素治療后可顯著提高外周血CD3+、CD4+百分比和CD4+/CD8+比值,并同時降低CD8+百分比(P<0.01),提示替加環素對cIAI患者的體內免疫失衡存在一定的調節作用。見表1。

圖1 替加環素降低cIAI患者血清炎性細胞因子的水平

圖2 替加環素降低cIAI患者PBMC上清液炎性細胞因子的水平

項目正常組(n=15)替加環素(n=17)治療前治療后t1值t2值CD3+(%)70.24±6.3360.17±5.59#68.92±5.08??2.230-4.269CD4+(%)38.02±4.2730.72±4.67##36.69±5.05??2.252-5.254CD8+(%)23.55±3.7129.02±3.66##24.11±4.08?-3.6043.328CD4+/CD8+1.54±0.321.03±0.29##1.49±0.34??2.257-6.783
與正常組比較:#P<0.05,##P<0.01;與替加環素治療前比較:*P<0.05,**P<0.01;t1:治療前與正常組比較;t2:治療后與治療前比較

圖3 替加環素降低SEA誘導下PBMC的增殖水平
1:正常組;2:SEA組;3、4、5:1、2、5 mg/L替加環素組;與正常組比較:##P<0.01;與SEA組比較:**P<0.01
3 討論
替加環素是四環素類廣譜抗生素,2006年獲歐洲藥品管理局批準上市。替加環素抗菌譜廣,是混合感染情況未明下常用的一線藥物[1],廣泛用于治療革蘭陰性或陽性病原體、厭氧性病原體和耐甲氧西林金葡菌導致的cIAI, 復雜皮膚及軟組織感染、社區獲得性肺炎等[8]。已有研究[5,9-12]顯示替加環素體內外作用感染性疾病同時還兼有一定的抑制炎癥和調節免疫活性。Yagnik et al[5]研究發現替加環素體外作用大鼠神經元細胞可有效抑制LPS誘導炎性細胞因子IL-1和腫瘤壞死因子(tumor necrosis factor alpha,TNF-α)的釋放。Pichereau et al[9]報道替加環素能夠有效抑制細菌內毒素刺激下人PBMC細胞分泌干擾素和TNF-a的水平。在動物模型上,Salvatore et al[10]考察支原體肺炎小鼠模型發現,替加環素治療給藥能夠顯著改善肺部病理,降低支氣管肺泡灌洗液中IL-1、IL-12 (p40/p70) 和 TNF-α表達水平和炎性趨化因子MIG、MIP-1α和IP-10的含量水平。Parra et al[11]研究確認溶血卵磷脂聯合替加環素明顯降低實驗性小鼠腹腔敗血癥和肺炎模型炎癥反應。臨床研究[4, 12]顯示,替加環素治療cIAI患者能夠降低患者外周血Ig A水平、升高Ig M和Ig G水平,也能降低患者血清白細胞、C-反應蛋白、一氧化氮合和降鈣素原的含量水平,上述研究提示替加環素體內外均具有一定的抗炎和免疫調節活性。
本研究首先顯示替加環素治療cIAI患者總有效率為70.8%,對分離出來的數十種致病菌均有較高清除率,這些結果與文獻[13-14]報道基本相一致。此外本研究還顯示替加環素治療給藥后能夠降低cIAI患者血清炎性細胞因子IL-1β、IL-6和IL-8表達水平,可顯著提高外周血CD3+、CD4+百分比和CD4+/CD8+比值,降低CD8+百分比。CD3+是T淋巴細胞表面標志物,CD4+是輔助性T細胞的表面標志物,CD8+是細胞毒性T細胞的表面標志物。CD4+亞群細胞可通過增強、誘導細胞因子產生增強細胞和體液免疫應答,CD8+亞群細胞主要通過分泌抑制因子對系統免疫起著負向調節作用[15]。本研究中顯示,與正常組相比,cIAI組CD3+、CD4+百分比明顯降低,CD4+/CD8+比值明顯降低,CD8+百分比明顯升高,提示機體CD4+介導細胞免疫反應不足以對抗病原體感染,需借助CD8+清除感染源的生物作用來維持機體需求。替加環素能夠使的這些參數指標接近正常組水平,提示替加環素整體給藥能夠調節患者體內的免疫失衡。
為進一步探討替加環素是否對cIAI患者免疫系統具有直接作用,本研究繼續考察替加環素體外對SEA刺激下cIAI患者外周血PBMC 增殖水平和炎性細胞因子含量水平。研究結果顯示替加環素可直接下調SEA刺激下PBMC的增殖水平,降低IL-1β、IL-6和IL-8的含量水平,提示替加環素對cIAI患者免疫細胞具有直接調控作用。一般認為,感染導致的機體組織產生的非特異性炎癥反應是一種自我保護機制,但過度活化免疫反應會對組織造成一定的損傷并加重疾病進展。當前研究顯示替加環素在發揮抗感染作用同時,可體內外作用cIAI患者免疫細胞,提示替加環素臨床用于治療混合感染所產生的療效除了與抑制病原微生物生存之外,還與其調控機體內免疫失衡有關,值得思考的是該作用可能是其獨立的活性體現,而與抗微生物作用無關。
綜上所述,替加環素可調控cIAI患者免疫反應,降低外周血PBMC增殖水平、炎性細胞因子含量水平,恢復外周血CD4+和CD8+之間的平衡。
[1] Solomkin J S, Mazuski J E, Bradley J S, et al. Diagnosis and management of complicated intra-abdominal infection in adults and children: guidelines by the surgical infection society and the infectious diseases society of america[J]. Clin Infect Dis, 2010, 50(2):133-64.
[2] Syue L S, Chen Y H, Ko W C, et al. New drugs for the treatment of complicated intra- abdominal infections in the era of increasing antimicrobial resistance [J]. Int J Antimicrob Agents, 2016, 47 (4):250-8.
[3] 馬永馳, 潘亞萍,佘婷婷,等.產KPC肺炎克雷伯菌檢測方法構建與耐藥機制[J].安徽醫科大學學報,2017,52 (8): 1173-8.
[4] 李 儒,王旭明,郭紅荔,等.替加環素聯合頭孢哌酮舒巴坦對多重耐藥鮑曼不動桿菌肺部感染患者的臨床療效及機制探討[J].中國醫院藥學雜志, 2017, 37(5):450-3.
[5] Yagnik R M, Benzeroual K E. Tigecycline prevents LPS-induced release of pro-inflammatory and apoptotic mediators in neuronal cells [J].ToxicolInVitro, 2013, 27(2):686-93.
[6] 《抗菌藥物臨床試驗技術指導原則》寫作組.抗菌藥物臨床試驗技術指導原則[J].中國臨床藥理學雜志,2014, 30(9):844-56.
[7] 朱貞貞,毆 欣,張 茜,等. 腎移植受者早期外周血CD4+CD25+FoxP3+T細胞、Th17細胞表達變化[J].安徽醫科大學學報, 2016,51 (12):1828-31.
[8] Shen F, Han Q, Xie D, et al. Efficacy and safety of tigecycline for the treatment of severe infectious diseases: an updated meta-analysis of RCTs[J]. Int J Infect Dis, 2015, 39: 25-33.
[9] Pichereau S, Moran J J, Hayney M S, et al. Concentration-dependent effects of antimicrobials on Staphylococcus aureus toxin-mediated cytokine production from peripheral blood mononuclear cells[J]. J Antimicrob Chemother, 2012, 67(1):123-9.
[10] Salvatore C M, Techasaensiri C, Tagliabue C, et al.Tigecycline therapy significantly reduces the concentrations of inflammatory pulmonary cytokines and chemokines in a murine model of Mycoplasma pneumoniae pneumonia[J]. Antimicrob Agents Chemother, 2009, 53(4):1546-51.
[11] Parra Millán R, Jiménez Mejías M E, Sánchez Encinales V, et al. Efficacy of lysophosphatidylcholine in combination with antimicrobial agents against acinetobacter baumannii in experimental murine peritoneal sepsis and pneumonia models[J]. Antimicrob Agents Chemother, 2016 ,60(8):4464-70.
[12] 張敬毅,韓 偉,顧晶晶,等.替加環素對多藥耐藥鮑氏不動桿菌
微生物學清除率與治療效果的分析[J].中華醫院感染學雜志,2017,27(11):2420-3.
[13] Chen Z, Wu J, Zhang Y, et al. Efficacy and safety of tigecycline monotherapyvs. imipenem/ cilastatin in Chinese patients with complicated intra-abdominal infections: a randomized controlled trial [J]. BMC Infect Dis, 2010, 10:217.
[14] Towfigh S, Pasternak J, Poirier A, et al. A multicentre, open-label, randomized comparative study of tigecycline versus ceftriaxone sodium plus metronidazole for the treatment of hospitalized subjects with complicated intra-abdominal infections[J].Clin Microbiol Infect, 2010, 16 (8):1274-81.
[15] Bedoui S, Heath W R, Mueller S N. CD4(+) T-cell help amplifies innate signals for primary CD8 (+) T-cell immunity[J]. Immunol Rev, 2016, 272(1):52-64.

